Что такое водородная связь какую точку зрения физиков или химиков
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
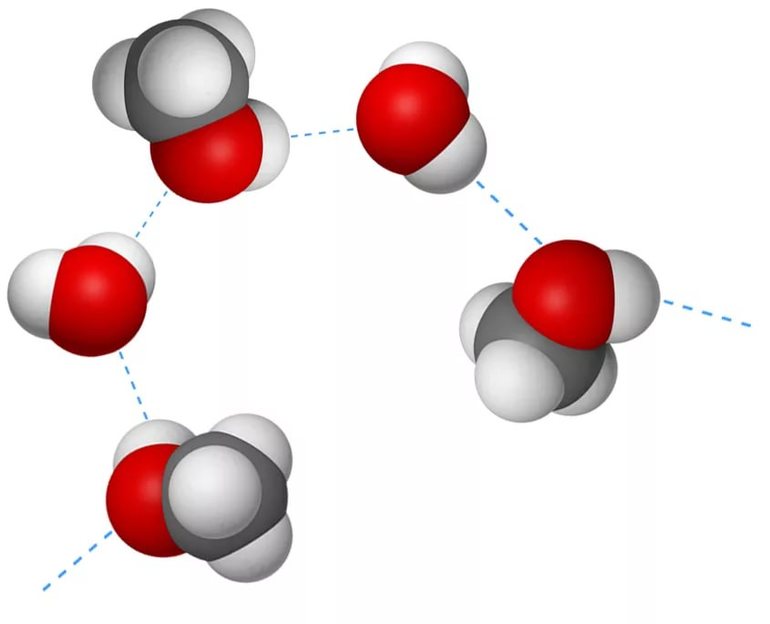
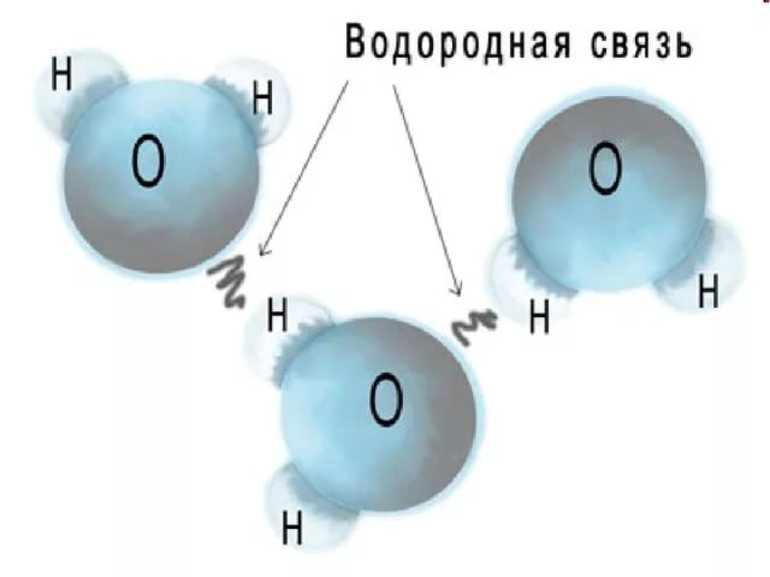
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
Определение «водородная связь» появилось в 1920 году. Его применили учёные Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
Например, борная кислота с формулой H3BO3 имеет слоистую триклинную кристаллическую решётку, где каждая из молекул посредством H-связей крепится к трём другим. В результате образуются плоские слои, которые за счёт межмолекулярных связей создают кристаллическую структуру — «паркет» из шестиугольников.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров
Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
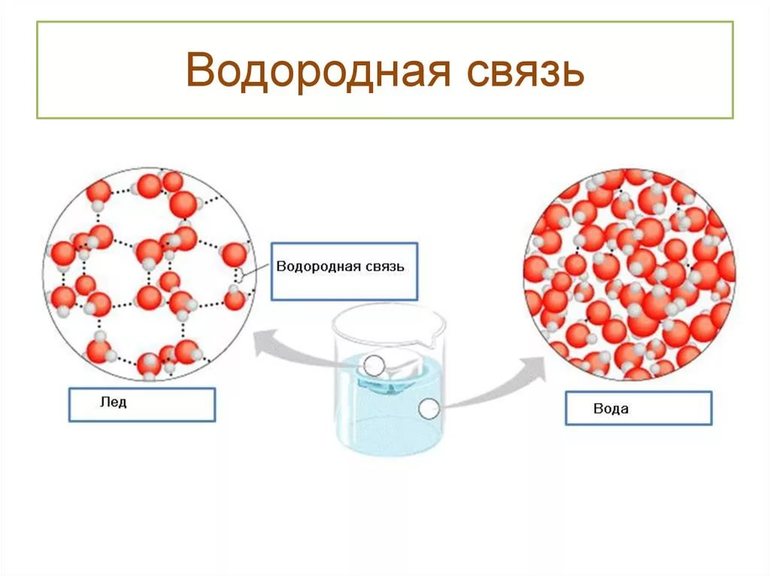
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.
Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.
Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.
Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
В энергию водородной связи существенный вклад вносят ковалентные взаимодействия
Рис. 1. Рассмотрение природы водородной связи с точки зрения теории валентных связей позволяет говорить о том, что трехцентровая четырехэлектронная связь, в которой четыре электрона одновременно связывают три ядра (донора водородной связи D, водорода H и акцептора водородной связи A), вносит существенный вклад в энергию водородной связи. Два электрона для образования этой многоцентровой связи предоставляет электронная пара ковалентной связи H–D, еще два — неподеленная электронная пара акцептора водородной связи. Рисунок из обсуждаемой статьи в Physical Chemistry Chemical Physics
В поисках ответа на вопрос о природе водородной связи специалисты по квантовой химии применили к этому типу межмолекулярных взаимодействий теорию валентных связей. Для наиболее изученных типов водородных связей (F–H⋯FH, F–H⋯OH2, F–H⋯NH3, HO–H⋯OH2, HO–H⋯NH3 и H2N–H⋯NH3) они определили вклад различных факторов в общую энергию водородной связи и установили, что в ряде изученных систем ковалентное взаимодействие может составлять более половины энергии водородной связи.
Говоря о связях в химических веществах и химических процессах, мы выделяем два типа связей — химические (внутримолекулярные) и межмолекулярные. Химические связи — это достаточно прочные взаимодействия атомов или продуктов их превращений друг с другом, благодаря которым образуются молекулы или другие формы существования веществ. Существует всего три типа химических связей:
1) ковалентная связь образуется за счет того, что два или более атомов связываются общим электронным облаком;
2) ионная связь — атомы или их группы, приобретая или отдавая электроны, превращаются, соответственно, в отрицательно или положительно заряженные ионы, которые связываются друг с другом за счет электростатических взаимодействий;
3) металлическая связь существует только в металлах и сплавах, где всем атомам кристаллической решетки металла одновременно принадлежит общее электронное облако.
Межмолекулярные связи (иногда их называют «нехимическими связями») — менее прочные по энергии взаимодействия, они притягивают друг к другу молекулы, находящиеся в жидкой или твердой фазах, и не приводят к образованию ковалентных (химических) связей. Несмотря на различие в энергии, и химические, и межмолекулярные связи могут формироваться либо за счет объединения электронной плотности, либо за счет электростатических взаимодействий, либо (и это происходит чаще всего) за счет их суперпозиции.
Водородная связь — это межмолекулярное взаимодействие, которое возникает между атомом водорода, ковалентно связанным с атомом электроотрицательного химического элемента, и атомом другого электроотрицательного элемента. Атом водорода, будучи связанным с одним электроотрицательным атомом, испытывает недостаток электронной плотности и притягивается ко второму электроотрицательному атому, богатому электронами. Обычно водородную связь обозначают следующим образом: D–H⋯A. Связанный с водородом ковалентной химической связью атом «D» называют донором водородной связи, а атом «A» — акцептором водородной связи.
Термин «водородная связь» впервые появляется в 1920 году в работе Венделла Латимера и Уорта Родебуша (W. M. Latimer, W. H. Rodebush, 1920. Polarity and Ionization from the Standpoint of the Lewis Theory of Valence). В 1930-е годы концепция водородной связи была успешно использована для объяснения значений аномально высоких температур кипения и диэлектрической проницаемости органических веществ, содержащих фрагменты –ОН и –NH (W. D. Kumler, 1935. The Effect of the Hydrogen Bond on the Dielectric Constants and Boiling Points of Organic Liquids), а также необычных свойств воды в жидком и твердом агрегатном состоянии (M. L. Huggins, 1936. Hydrogen Bridges in Ice and Liquid Water).
Благодаря образующимся между молекулами воды водородным связям вода (Н2О) отличается самой высокой температурой кипения среди водородных соединений элементов 16-й группы, в которую входит кислород (а также сера, селен, теллур, полоний и ливерморий). При этом в ряду H2S—H2Se—H2Te температура кипения увеличивается параллельно увеличению молекулярной массы. Водородные связи также ответственны за то, что при замерзании плотность воды понижается и лед плавает на поверхности воды, не давая водоемам промерзнуть до дна. Именно эта особенность воды (и, следовательно, образующихся в ней водородных связей) не раз позволяла жизни сохраняться во время ледниковых периодов и даже глобальных обледенений Земли.
За почти сто лет существования концепции водородной связи этот вид межмолекулярного взаимодействия изучали и с помощью теоретических, и с помощью экспериментальных методов — инфракрасной и ЯМР-спектроскопии, рентгеновской и нейтронной дифракции. В настоящее время без привлечения концепции водородных связей нельзя объяснить ни особенности тонкой структуры белков и нуклеиновых кислот, ни механизм протекания катализируемых ферментами процессов, протекающих в организме. Образование и разрушение водородных связей может объяснить даже то, почему во время стирки изделия из льняных и хлопковых тканей мнутся, и какие физические процессы протекают во время глажения тканей (см., например, задачу Химия глажения).
Несмотря на большое количество исследований, посвященных влиянию водородных связей на физические и химические свойства веществ, природа этого межмолекулярного взаимодействия до сих пор не ясна. C одной стороны, это не мешает химикам применять концепцию водородной связи для объяснения многочисленных химических и физических явлений, с другой — химики стремятся установить механизм образования водородно-связанных комплексов.
В свое время Лайнус Полинг, непререкаемый тогда авторитет в области природы химических связей, предполагал, что водородная связь представляет собой исключительно электростатическое взаимодействие: несущий частичный положительный заряд атом водорода, от которого более электроотрицательный донор водородной связи (кислород, фтор или азот) оттягивает электронную плотность, притягивается к заряженному отрицательно акцептору водородной связи (L. Pauling, 1960. The Nature of the Chemical Bond). Он исключал, что атом водорода может образовать ковалентную связь сразу с двумя атомами. Тем не менее открытие многоцентровых многоэлектронных ковалентных химических связей позволило уже современникам Полинга заметить, что перенос заряда между атомами, который наблюдается в водородно-связанном комплексе D–H⋯A, можно объяснить только тем, что в водородной связи имеется ковалентная составляющая (C. G. Cannon, 1958. The nature of hydrogen bonding: A review of published work and discussion), вклад которой в общую энергию связи, однако, в те времена не удавалось оценить.
Сейчас, спустя шесть десятков лет после начала дискуссий о том, что же главное в водородной связи — электростатика или ковалентные взаимодействия, — единства удалось достичь только в том, что для образования водородной связи важны и электростатические, и ковалентные взаимодействия. Вопрос же о том, какое из них вносит больший вклад в притяжение водорода к акцептору водородной связи, до сих пор остается открытым. Интерес к водородной связи не праздный — учитывая ее значение для химии и молекулярной биологии; полное понимание ее природы — не просто голое теоретизирование, но и перспектива более эффективного управления процессами, в которых происходит образование или разрыв водородных связей.
Исследователи из Колледжа маристов (Marist College, Поукипси, штат Нью-Йорк, США) под руководством Джона Моррисона Гэлбрайта (John Morrison Galbraith) впервые решили применить к изучению водородной связи теорию валентных связей. Эта теория — приближенный квантовохимический метод, основным допущением которого является то, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Выбор такого приближения был продиктован тем, что теория валентных связей — достаточно гибкий инструмент для анализа химических взаимодействий, который, благодаря простоте возможных моделей связывания, легко может быть адаптирован и для анализа водородных связей (рис. 2).
Рис 2. Шесть вариантов представления водородной связи, предложенных на основании метода валентных связей. Н — водород, А — акцептор водородной связи, D — донор водородной связи. Точками обозначены электроны. Окружность и чечевицеобразные фигуры — s-орбиталь водорода и р-орбитали донора и акцептора водородной связи, соответственно. Дугами показано взаимодействие электронов — образование общей электронной пары для двух атомов. Рисунок из обсуждаемой статьи в Physical Chemistry Chemical Physics
Авторы использовали метод валентных связей для изучения следующих водородно-связанных ассоциатов: F–H⋯FH, F–H⋯OH2, F–H⋯NH3, HO–H⋯OH2, HO–H⋯NH3 и H2N–H⋯NH3. Конечно, существует большое количество водородных связей и другого типа, однако выбор моделей для исследования был продиктован тем, что именно они лучше всего соответствуют простейшему определению водородной связи, упоминаемому еще в школьном учебнике: «притяжение между связанным с N, O или F атомом водорода и другим электроотрицательным атомом».
Для анализа модельных водородных связей исследователи раскладывали общую энергию каждой из них на «элементарные» составляющие. С помощью метода функционала плотности (см. также А. Сатанин, 2009. Введение в теорию функционала плотности) были поэтапно рассчитаны следующие составляющие энергии водородной связи (рис. 3): изменение геометрического состояния участников водородного связывания, вклад кулоновского взаимодействия (электростатическая составляющая), вклад поляризации химических связей и вклад переноса заряда (ковалентная составляющая).
Рис. 3. Графическое отображение предпринятого в ходе работы разложения энергии водородной связи на составляющие. Соотношение вкладов разных составляющих показано лишь качественно, а конкретные значения энергий не приводятся, так как они отличаются у разных комплексов с водородной связью и зависят от типа донора и акцептора водородной связи. Рисунок из обсуждаемой статьи в Physical Chemistry Chemical Physics
Такое разложение традиционно используют при анализе химических и отличающихся большой энергией межмолекулярных взаимодействий. И попытки проделать это с водородной связью уже предпринимались ранее, но применялись квантовохимические модели, дающие менее точные предсказания (см., например, D. Danovich et al., 2013. Understanding the Nature of the CH⋯HC Interactions in Alkanes).
Расчеты показали, что из шести возможных вариантов представления водородной связи наиболее выгодными с точки зрения энергетической стабилизации являются структуры, в которых ковалентность водородной связи максимальна — на рис. 2 они обозначены номерами IV и V. Для структуры IV ковалентная связь образуется за счет взаимодействия водорода с неподеленной парой электронов акцептора водородной связи; граничная структура V образуется за счет того, что пара электронов ковалентной связи H–D и неподеленная электронная пара акцептора водородной связи образуют единое четырехэлектронное облако, которое связывает одновременно все четыре ядра системы D–H⋯A. Такую химическую связь называют четырехэлектронной трехцентровой.
Также было определено, что в водородно-связанном комплексе F–H⋯NH3, для которого наблюдается наиболее прочная водородная связь с энергией 57,3 кДж/моль (эта величина сравнима с прочностью «обычных», внутримолекулярных связей), вклад ковалентной связи в общую энергию водородной связи составляет 82,6%. В целом же для изученных систем перенос заряда (ковалентная составляющая) составляет от 32,6% до 82,6% от общей энергии водородной связи.
Полученные результаты противоречат результатам проведенного в прошлом году теоретического исследования водородной связи (тем же методом), в котором делался вывод о том, что водородная связь преимущественно определяется электростатическими взаимодействиями (A. J. Stone, 2017. Natural Bond Orbitals and the Nature of the Hydrogen Bond). Сторонники двух точек зрения на водородную связь — «ковалентной» и «электростатической» — уверены в своей правоте, критикуя работы оппонентов примерно одинаковыми аргументами: ошибками в подборе математических функций для квантовохимического анализа и неточностями в разбиении вкладов различных факторов на общую энергию водородной связи.
Тем не менее, если отвлечься от выводов двух работ и посмотреть на объекты, которые в них изучены, то нельзя сказать о непреодолимом противоречии. В указанной работе 2017 года вывод об электростатическом характере водородной связи делается на основании исследования единственного водородно-связанного комплекса — F–H⋯FH, для которого в обсуждаемой работе 2018 года как раз отмечается наименьший вклад ковалентной составляющей в общую энергию. Очевидно, что формулировка столь важного вывода о сути водородной связи только по одному примеру вряд ли может считаться объективной.
Скорее всего в ближайшее время мы увидим и другие попытки интерпретировать природу этого межмолекулярного взаимодействия, благодаря которому вода кипит при 100°С, а белки образуют сложные надмолекулярные структуры.
Источник: Coleen T. Nemes, Croix J. Laconsaya, John Morrison Galbraith. Hydrogen bonding from a valence bond theory perspective: the role of covalency // Physical Chemistry Chemical Physics. 2018. DOI: 10.1039/C8CP03920H.