Что такое внутридолевая секвестрация легкого
Секвестрация легкого
МКБ-10
Общие сведения
Причины секвестрации легкого
Секвестрация легкого является сложным пороком, вызванным комбинированным нарушением формирования различных бронхолегочных структур. Аномалия развивается в результате тератогенных влияний в раннюю внутриутробную фазу. Источником развития легочного секвестра являются добавочные выпячивания первичной кишки, рудименты дивертикула пищевода, отделившиеся от организующихся легких и затем теряющие связь с первичной кишкой и бронхиальным деревом. Иногда может оставаться связь рудимента легкого с пищеводом или желудком с помощью соустья-тяжа (бронхолегочно-кишечная мальформация).
Согласно теории тракции, развитию секвестрации легкого способствует нарушение редукции ветвей первичной аорты с трансформацией их в аномальные сосуды. Через эти сосудистые ветви зачаточные фрагменты легкого отграничиваются от нормальной легочной закладки.
Классификация
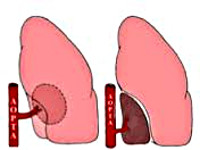
Различают 2 формы секвестрации легкого: внутридолевую (интралобарную – ИЛС) и внедолевую (экстралобарную – ЭЛС). При интралобарной легочной секвестрации кистозный участок располагается среди функционирующей паренхимы легкого в границах висцерального листка плевры (чаще всего в области медиально-базальных сегментов нижней доли левого легкого) и васкуляризуется одним или несколькими аберрантными сосудами. ИЛС можно рассматривать как врожденную кисту с аномальным кровообращением. Секвестрированные легочные кисты имеют эпителиальную выстилку и жидкое или слизистое содержимое, часто первично не связаны с бронхиальным деревом. В кистозно-измененном участке секвестрации легкого рано или поздно возникает нагноение.
Встречаемость внутридолевой секвестрации легкого примерно в 3 раза выше, чем внедолевой, иногда возможно их одновременное присутствие у одного больного. ЭЛС в 3–4 раза чаще выявляется у мальчиков, чем у девочек.
По клиническим критериям выделяют 3 формы секвестрации легкого:
Симптомы секвестрации легкого
Клиническая картина секвестрации легкого определяется локализацией секвестра, наличием или отсутствием его связи с дыхательными путями, степенью развития гипоплазии легочной ткани и воспалительных изменений. Симптомы интралобарной секвестрации легкого редко проявляются на этапе новорожденности и раннего детства, развиваясь обычно в более старшем возрасте при инфицировании, воспалении, нагноении и прорыве кистозного секвестра.
Экстралобарная секвестрация легкого часто протекает асимптомно и начинает беспокоить больного только в подростковом и более позднем возрасте. Внедолевые секвестры могут провоцировать сдавление пищевода, желудка и других органов, что может проявляться одышкой, цианозом, нарушением эвакуации пищи. Риск инфекционного процесса крайне низок.
Секвестрация легкого может осложниться пневмомикозом, туберкулезом, профузным легочным кровотечением и массивным гемотораксом, формированием опухоли, развитием острой сердечной недостаточности по причине объемной перегрузки сердца за счет артериовенозного шунтирования в секвестрированной кисте.
Диагностика
Ранняя диагностика секвестрации легкого затруднена из-за схожести ее клинико-рентгенологических симптомов с таковыми при другой легочной патологии. Диагноз устанавливают по совокупности данных обзорной рентгенографии и КТ легких, бронхографии, бронхоскопии, УЗИ брюшной полости, аортографии, ангиопульмонографии.
Рентгенологически интралобарная секвестрация легких (в отсутствии связи с бронхом и воспаления) определяется как затенение неправильной формы разной степени интенсивности с просветлением в толще или как полостное образование с горизонтальным уровнем жидкости или без него. При обострении вокруг секвестра в нижней доле легкого отмечается выраженная деформация сосудисто-бронхиального рисунка, умеренная перифокальная инфильтрация легочной ткани. При бронхографии наблюдается деформация и смещение бронхов, соседних с пораженным сегментом легкого. Бронхоскопическая картина секвестрации легкого, сообщающейся с дыхательными путями, соответствует катарально-гнойному эндобронхиту на стороне пораженного легкого.
Брюшнополостная ЭЛС выявляется на УЗИ как четко отграниченное образование однородной эхогенности с кровоснабжением через ветви крупных артерий. Диагноз окончательно подтверждается МСКТ легких и ангиопульмонографией с установлением наличия, количества и топографии аномальных сосудов, питающих область секвестрации. Радиоизотопное сканирование печени и перитонеография помогают отграничить правостороннюю секвестрацию легких от патологии органов ЖКТ. Секвестрация легкого нередко выявляется в ходе хирургического вмешательства по поводу хронического гнойного процесса в легком. Дифференциальный диагноз при секвестрации легкого проводится с деструктивной пневмонией, туберкулезным процессом, кистой или абсцессом легкого, бронхоэктазами, опухолью грудной полости.
Лечение секвестрации легкого
При секвестрации легких требуется проведение оперативного вмешательства – удаление аномального участка легочной ткани. При выявлении бессимптомной внутридолевой секвестрации легких возможно выполнение сегментэктомии, однако чаще всего требуется удаление всей пораженной легочной доли (обычно нижней) – лобэктомия. Тактика хирургического лечения внедолевой формы заключается в удалении секвестрированного участка (секвестрэктомии). Наличие при секвестрации легких аномальных крупных артериальных сосудов нетипичной локализации делает важным тщательную предварительную диагностику во избежание их интраоперационного повреждения и развития тяжелого угрожающего жизни кровотечения.
Прогноз при интралобарной форме в отсутствие гнойно-септических процессов – удовлетворительный, при экстралобарной секвестрации легкого брюшнополостной локализации, как правило, лучше, чем при ее внутригрудном расположении.
Что такое внутридолевая секвестрация легкого
Секвестрация легких (s. pulmonary sequestration, bronchopulmonary sequestration, BPS, bronchoarterial malinosculation) — порок развития, характеризующийся двумя основными признаками: отсутствием связи пораженного участка с бронхиальной системой легкого и кровоснабжением из аномальных артерий, отходящих непосредственно от аорты или ее ветвей [1–6]; среди всех врожденных заболеваний органов дыхания распространенность данной аномалии составляет 0.15 % — 6 % [1]. Наиболее часто поражаются нижнедолевые сегменты [14], правое и левое легкое вовлекаются в патологический процесс с одинаковой частотой. Заболевание чаще встречается у мужчин, чем у женщин (3:1) [7]. Легочная секвестрация может сочетаться с другими пороками развития, такими как гипоплазия почек, открытое средостение, воронкообразная грудная клетка, легочные кисты, врожденные аномалии сердца, пищеводно-бронхиальные свищи, диафрагмальные грыжи [8].
Термин «легочная секвестрация» впервые был использован в 1946 году Pryce [1], некоторые авторы используют определение bronchoarterial malinosculation [16]. В 1777 г. Huber сообщил о двухлетнем ребенке, у которого отмечалась аномалия сосудов — сообщение грудной аорты с сосудами нижней доли правого легкого [1].
Патогенез порока сложен, приводятся многочисленные, частично противоречивые теории. Преимущественное признание имеет концепция, согласно которой пороку развития сосуда предшествует появление аберрантной артерии. Через этот сосуд отшнуровываются и фиксируются единичные или множественные зародыши развивающегося бронхиального дерева. При секвестрации часть легочной ткани, обычно аномально развитой и представляющей собой кисту или группу кист, оказывается отделенной от нормальных анатомо-физиологических связей (бронхи, легочные артерии) и васкуляризуется артериями большого круга кровообращения, отходящими от аорты. Масса нефункционирующей эмбриональной или кистозной ткани, не имеющей связи с функционирующими дыхательными путями и снабжаемой кровью из большого круга кровообращения, носит название секвестра. Несмотря на то, что в большинстве случаев секвестры не сообщаются с функционирующими воздухоносными путями, это не является правилом. Как внутри, так и внедолевые секвестры образуются по одному и тому же патоэмбриологическому механизму как рудименты дивертикула пищевода. Внутри секвестра может быть обнаружена ткань желудка или поджелудочной железы. Тератогенный период этого сложного порока относится к ранней эмбриональной фазе.
Выделяют следующие анатомические варианты:
1. Внутридолевую секвестрацию (киста или кисты легкого с аномальным кровоснабжением) (75 %);
2. Внедолевую секвестрацию (добавочное легкое, или доля, с аномальным кровоснабжением) с формированием добавочного недоразвитого органа (киста или группа кист) вне нормально функционирующего легкого и васкуляризацией первого артерией или артериями большого круга. (25%) [7].
При внутридолевой секвестрации изменения чаще всего локализуются в заднемедиальных сегментах отделе нижней доли левого (реже правого) легкого и представляют собой кисту или группу кист бронхогенного типа, выстланных изнутри цилиндрическим или многорядным плоским эпителием, первично не сообщающихся с бронхиальным деревом и заполненных слизистой жидкостью. К ним подходит артериальный сосуд, начинающийся чаще всего на боковой поверхности нисходящего отдела грудной аорты и проходящий в толще легочной связки. Венозный отток из аномально развитой зоны осуществляется через легочные вены. В кисте (или кистах) рано или поздно начинается нагноение. Клинические проявления возникают только после развития нагноительного процесса в кистозной полости (полостях). Характерен субфебрилитет, а после прорыва содержимого кисты в бронх — обильная слизисто-гнойная мокрота, иногда кровохарканье.
При внедолевой секвестрации аномальный участок легочной ткани появляется вне нормально развитого органа и может располагаться в плевральной полости, в брюшной полости или на шее. Рудиментарное легкое (доля) имеет небольшие размеры и аномальное артериальное кровоснабжение за счет сосуда, отходящего от аорты или от другой крупной артерии большого круга. Его строение также чаще бывает кистозным, обычно не имеющим сообщения с воздухоносными путями. Внедолевая секвестрация клинически не проявляется и обнаруживается случайно во время операций или при патологоанатомическом исследовании, инфекционный процесс возникает редко [6, 8].
Выделяют 3 клинико-рентгенологические формы легочной секвестрации:
1. бронхоэктатическую, при которой после повторных воспалений и расплавления пограничной легочной ткани вторично возникает сообщение с бронхиальным деревом;
2. псевдотуморозную, характеризующуюся бедностью симптоматики;
3. форму, принимающую характер абсцесса или эмпиемы, при которой вследствие инфекции в области секвестра возникает гнойное воспаление легкого или эмпиема плевры [4, 6, 9, 10, 11, 12].
Диагностика:
Физикальное исследование обычно малоинформативно. Иногда удается определить влажные разнокалиберные хрипы в задненижних отделах одного из легких. При сообщении полостей недоразвитого легкого с воздухоносными путями распознаванию способствует бронхография. Показаны также аортография, поиск и селективное контрастирование аномальной артерии.
Рентгенологическое исследование позволяет определить кисту или группу кист с горизонтальным уровнем жидкости или без такового в медиально-базальном отделе одной из нижних долей. По периметру кист в период обострения может выявляться умеренная инфильтрация легочной ткани. Иногда же в этом отделе легкого определяется неправильной формы затенение, на фоне которого при томографическом исследовании можно выявить полость [11,12,13].
Лечение:
Легочная секвестрация требует хирургического вмешательства, которое часто сводится к клиновидной резекции секвестрированного участка. Она показана и в бессимптомных случаях, так как в секвестре развивается рецидивирующее воспаление [15].
Приводимый в качестве примера клинический случай демонстрирует внутридолевую секвестрацию нижней доли правого легкого у молодого мужчины с повторными пневмониями.
Пациент К., 28 лет обратился за амбулаторной помощью к врачу терапевту с жалобами на боли колющего характера в грудной клетке справа, субфебрилитет, слабость, кашель с небольшим количеством мокроты слизистого характера. В течение последних 5 лет ежегодно госпитализировался по поводу рецидивирующей правосторонней нижнедолевой пневмонии, без существенного эффекта от проводимого лечения. Консультирован фтизиатром, данных за туберкулез легких не получено.
На обзорной рентгенограмме органов грудной клетки выявлена правосторонняя нижнедолевая очаговая сливная пневмония. Пациент направлен в стационар МСЧ 41 для дальнейшего лечения, проведенный курс терапии без значимого эффекта. Бронхологическая картина (ФБС) без особенностей (фото 1, 2).
В качестве уточняющего метода диагностики рекомендована компьютерная томография (КТ) органов грудной клетки. КТ-картина характеризуется следующими изменениями:
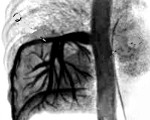
Грудная клетка правильной формы симметричная. Во внутреннем и заднем нижних сегментах правого легкого (S 7,10) на фоне инфильтрации легочной ткани с локальными участками плевропневмофиброза определяется секвестр (рис. 1) с аберрантным сосудом (рис. 2) отходящим от грудной аорты (рис. 3, 4). По остальным легочным полям патологических изменений не определяется.
Бронхи нижней доли расширены, стенки их утолщены. Трахея и главные бронхи проходимы. Просветы бронхов свободны. Легочной рисунок усилен локально на уровне нижней доли справа. Жидкость в плевральных полостях не выявлена.
Сердце, грудной отдел аорты обычно расположены, не смещены. Внутригрудные лимфатические узлы единичные до 1.0 см., однородной структуры.
Со стороны костного остова: Умеренные дегенеративные изменения. Грыжа Шморля Th 10, склероз замыкательных пластинок тел позвонков. Позвоночный канал не сужен. Структура дурального мешка не изменена.
Заключение:
СКТ-картина: внутридолевая секвестрация заднемедиального отдела нижней доли правого легкого, хр. бронхит. Ограниченный правосторонний плевропневмофиброз. Данный случай характеризует редко встречающуюся аномалию развития, долгое время остававшуюся нераспознанной. Обращает на себя внимание факт рецидивирующих пневмоний у пациента в течение длительного времени, без значимого эффекта от проводимой терапии, что, тем не менее, не позволило клиницистам заподозрить порок, обнаруженный много лет спустя от момента начала клинических проявлений благодаря уточняющей методике (КТ). После разрешения пневмонии пациент был направлен в одну из клиник г. Москвы для решения вопроса о плановом хирургическом лечении.
Диагностика и хирургическое лечение секвестрации легких у детей
Проведен анализ результатов диагностики и лечения 14 больных с секвестрацией легких (СЛ). Описаны анатомические формы и клинико-рентгенологические варианты СЛ, проведен анализ ошибочных диагнозов и трудности дифференциальной диагностики СЛ на догоспитальном и госпитальном этапах. Представлены основные варианты хирургического лечения данного порока развития легких.
Diagnosis and surgical treatment of pulmonary sequestration in children.
Analysis of results of diagnosis and treatment of 14 patients with pulmonary sequestration SL is conducted. Anatomical and clinical-radiologic variants of the SL, the analysis of erroneous diagnoses and the difficulties of differential diagnosis of SL in the pre-admission and hospital stages are described. It is presented the main variants for surgical treatment this of pulmonary malformation of light in our clinic.
Секвестрация легкого (СЛ) относится к редким порокам развития, обусловленным комбинированным нарушением развития всех структур, образующих легкое, при котором участок легочной ткани, частично или полностью отделившийся на ранних стадиях эмбриогенеза, развивается независимо от основного легкого, представляя полностью эктопированную ткань, или располагается внутри функционирующей ткани легкого. СЛ имеет изолированную бронхиальную систему и одну или несколько аномальных артерий, отходящих чаще от аорты или ее ветвей.
Термин «секвестрация» в 1946 году ввел D. Pryce, ему же принадлежит заслуга глубокого изучения этого порока развития легких [11]. Этот термин используется до настоящего времени, хотя не является удачным, так как речь идет о жизнеспособном порочно сформированном участке легкого. В то же время в литературе иногда используются другие названия СЛ [12]. Наиболее удачным названием этой патологии является «сепарация легкого», на что указывает ряд зарубежных и отечественных исследователей [6].
Тератогенный период этого сложного порока относится к ранней эмбриональной фазе. До настоящего времени преимущественное признание имеет теория тракции, выдвинутая еще в 1946 году D. Pryce [11]. Легочная артерия развивается из сосудистого сплетения, связанного с дорсальной и вентральной аортой. В процессе развития легкого связи с аортой прерываются. Если происходит нарушение эмбриогенеза, то нередуцированные ветви первичной аорты отшнуровывают часть первичного легкого в результате тракции и сдавления бронха. В дальнейшем они превращаются в аномальные артерии, кровоснабжающие одну из ветвей развивающегося бронхиального дерева. СЛ может сочетаться с другими пороками развития [2, 5, 10].
Как и большинство исследователей, мы выделяем две анатомические формы СЛ: внутридолевую и внедолевую [1, 10]. При внутридолевой форме секвестрированный участок не имеет своего плеврального листка и находится среди воздушной легочной ткани, но обязательно имеет один или несколько аберрантных сосудов. Связей секвестрированного участка с окружающей легочной тканью через нормальные бронхи, ветви легочной артерии и вены, как правило, нет. При внедолевой форме секвестрированный участок имеет собственную висцеральную плевру и может располагаться в междолевых щелях, средостении, полости перикарда, под диафрагмой, в толще грудной стенки, на шее. Кровоснабжение осуществляется аберрантным сосудом, отходящим чаще от грудной или брюшной аорты. Имеются сообщения о кровоснабжении секвестрированного участка легкого из системы легочной артерии при внедолевой форме [8, 9]. Описано одновременное существование внутри- и внедолевой секвестрации [4, 5]. Частота СЛ среди хронических неспецифических заболеваний легких (ХНЗЛ), по данным разных авторов, составляет 0,8-2% [1, 7].
С 1981 по 2006 год в нашей клинике проходили обследование и лечение 14 детей с СЛ. В возрасте от 5 месяцев до 1 года были 2 пациента, 4-7 лет — 5 детей, 11-15 лет — 7 больных. Среди них было 5 мальчиков и 9 девочек. Половина пациентов попали в поле зрения детских хирургов в возрасте старше 10 лет.
Внутридолевая СЛ локализовалась в зоне базальных сегментов у 8 больных, в одном случае располагалась в верхней доле левого легкого. Внедолевая форма СЛ отмечена у 5 больных — в трех случаях патологическая ткань легкого располагалась над диафрагмой, в одном случае прилегала к передне-боковой поверхности перикарда и в одном случае тесно прилегала к верхней доле в верхнем отделе плевральной полости.
Диагностика СЛ до настоящего времени представляет непростую задачу, особенно на догоспитальном этапе. Больные поступали в клинику с различными диагнозами: деструктивная пневмония (БДЛ), абсцесс легкого, киста легкого, опухоль грудной полости, туберкулез легкого. Часто они безрезультатно получали противовоспалительную терапию, в том числе и у фтизиатров. Использование обычных рентгенологических методов исследования не всегда позволяет однозначно интерпретировать их результаты. В результате у большинства больных окончательный диагноз СЛ был установлен в ходе оперативного вмешательства.
В зависимости от клинической картины больные разделены на две группы: СЛ с отсутствием клинической симптоматики — выявлялась во время рентгенологического обследования, у другой группы больных отмечались признаки хронического воспалительного процесса в легких: продуктивный и непродуктивный кашель, болевой синдром, симптомы интоксикации.
Уточнить диагноз позволяли дополнительные методы исследования — у больных были выполнены различные варианты рентгенологической диагностики: рентгенография грудной клетки (14), томография (2), РКТ (6), бронхография (6), бронхоскопия (12) аортография (2), ангиопульмонография (1). Правильный диагноз до операции был установлен у 2 больных, в других случаях СЛ выявлена при оперативном вмешательстве. Следует отметить, что появление современных высокотехнологичных методов исследования: РКТ, аортографии, ангиопульмонографии значительно расширяет диагностические возможности в определении точного диагноза до оперативного лечения.
Суммируя клинические данные и результаты рентгенологических исследований, мы выделили следующие встретившиеся варианты СЛ:
1. Кистозно-абсцедирующий вариант СЛ (9 больных). Клиническая картина соответствовала хроническому нагноительному процессу в легких. В течение длительного времени больных беспокоил сухой или продуктивный кашель, а в периоды обострения появление гнойной мокроты, умеренных болей в груди на стороне поражения, одышки при физической нагрузке, симптомов интоксикации: слабости, утомляемости, потливости. В 2 случаях прогрессирование воспалительного процесса в легочной ткани привело к плевральным осложнениям. При рентгенологических исследованиях на фоне выраженной деформации сосудисто-бронхиального рисунка визуализировались множественные полостные образования — от 0,5 до нескольких сантиметров в диаметре. Часть полостных образований содержала жидкостный компонент. При бронхологическом исследовании эндоскопическая картина чаще соответствовала катарально-гнойному эндобронхиту на стороне поражения. На бронхограммах бронхи соседних сегментов были оттеснены патологическим образованием и сближены, контрастное вещество в полость кист не проникало. Окончательно определиться с диагнозом до операции позволяет выполнение аортографии.
В качестве примера кистозно-абсцедирующего варианта СЛ приводим следующее наблюдение: Больная Ф., 1 г. 7 мес., неоднократно находилась на стационарном лечении по поводу пневмонии, бронхита по месту жительства. В июне 2004 года с целью дальнейшего обследования и лечения поступила в пульмонологическое отделение ДРКБ, где проведены РКТ, бронхологическое обследование. При УЗИ было обнаружено высокое расположение правой почки. После проведенного обследования был выставлен предварительный диагноз: поликистоз нижней доли правого легкого, высокое расположение правой почки. Для уточнения диагноза 28.09.04 г. проведена аортография, которая подтвердила дистопию (высокое расположение) правой почки с наличием добавочной артерии к нижнему полюсу дистопированной почки. Кроме того, было выявлено, что на уровне ThXII от аорты отходит дополнительная артерия к нижней доле правого легкого диаметром 2,8 мм, с контрастированием нижней доли правого легкого. Клинический диагноз: секвестрация нижней доли правого легкого, дистопия правой почки. 06.10.04 г. операция — торакотомия, удаление нижней доли правого легкого. Послеоперационный период протекал без осложнений, больная выписана в удовлетворительном состоянии. Окончательный диагноз: внутрилегочная секвестрация нижней доли правого легкого, кистозно-абсцедирующая форма. Дистопия правой почки без нарушения уродинамики.
2. Псевдотуморозный вариант СЛ (4 больных). Характеризуется бедностью или отсутствием клинических симптомов. У 2 больных с этим вариантом СЛ патология была выявлена случайно, при рентгенологическом исследовании органов грудной полости. На рентгенограммах гомогенные интенсивные тени с четкими контурами. При бронхографии контрастное вещество в патологическое образование не попадало. Макроскопически СЛ в этом случае была похожа на ателектазированную легочную ткань или ткань селезенки, внутри располагались несколько кистозных полостей. На гистологических срезах препарата стенки кист покрыты цилиндрическим эпителием, легочная ткань по строению соответствует легкому плода. Приводим одно из наших наблюдений: Больной Ш., 5 мес. 19 дн., поступил в ДРКБ на обследование по поводу выявленного при рентгенографии грудной клетки затенения в верхних отделах слева. До этого лечился амбулаторно у педиатра от коклюша. Были проведены УЗИ, РКТ, рентгеноскопия под ЭОП органов грудной полости, которые указывали на наличие объемного образования средостения слева. Предварительные диагнозы: дермоидная киста средостения, легочная секвестрация. 09.11.00 г. операция — торакотомия слева, удаление СЛ. В ходе оперативного вмешательства обнаружены три аномальных сосуда, идущих к дуге аорты. Сосуды перевязаны, пересечены. Произведено удаление секвестрированной легочной ткани. Окончательный диагноз: внедолевая секвестрация слева, псевдотуморозная форма. В послеоперационном периоде осложнений не было, ребенок выписан в удовлетворительном состоянии.
3. Бронхоэктатический вариант СЛ (1 больной), формирующийся в результате вторично возникающего сообщения с бронхиальным деревом вследствие расплавления пограничной легочной ткани на фоне повторных воспалительных реакций в легком. Клиническая картина соответствовала хроническому рецидивирующему воспалительному процессу в легких с присоединением плевральных осложнений.
Из 14 больных, обратившихся в нашу клинику, 13 были оперированы, 1 больная находится под наблюдением. При внутридолевой форме СЛ у 6 пациентов была выполнена операция по удалению пораженной доли легкого, в 2 случаях — удаление сегментов. В случаях внедолевой формы СЛ проведено удаление дополнительной секвестрированной легочной ткани. Во время всех операций проводилось выделение и обработка аномальных сосудов. Анализ наших наблюдений больных с СЛ подтверждает необходимость оперативного лечения этого порока развития легких после его выявления, независимо от выраженности клинических проявлений. Это совпадает с мнением других исследователей [1, 6]. Консервативное лечение может быть использовано для устранения выраженного воспалительного процесса в участке СЛ и возможных гнойных осложнений в легочной ткани и плевральной полости и, таким образом, является этапом предоперационной подготовки.
В ходе операции у большинства больных в плевральной полости имел место спаечный процесс разной степени выраженности. Разъединение и пересечение спаек представляло опасность из-за возможности повреждения дополнительных сосудов, находящихся в этих сращениях. Особый риск в этом аспекте имел место в тех случаях, когда диагноз СЛ у больного до операции как один из вариантов интерпретации клинико-рентгенологических данных не предполагался. Пересечение нелигированного аберрантного сосуда приводит к массивному кровотечению и может закончиться смертью больного, на что указывают ряд авторов [1, 3]. Таким образом, мы считаем, что наличие триады симптомов, характерных для СЛ, — локализация в зоне базальных сегментов кистовидного образования с обедненным легочным рисунком вокруг и отсутствие связи с бронхиальным деревом (отсутствие контрастированных бронхов в зоне затемнения и вокруг нее, по данным бронхографии) — является показанием для проведения РКТ в сосудистом режиме и аортографии (АГ) с целью уточнения диагноза. Выполнение АГ, кроме подтверждения диагноза СЛ, позволяет судить о количестве аномальных сосудов, их топографии, что сводит риск выполнения операции к минимуму. У обследованных и лечившихся у нас больных секвестрированная ткань легкого получала кровоснабжение дополнительными сосудами, отходившими от дуги аорты, грудного и брюшного ее отделов. Количество аберрантных сосудов — от 1 до 3, их диаметр — от 2 до 8 мм. Мы встретили следующие варианты отхождения аномальных сосудов от аорты: дуга аорты — у 1 больного, грудной и брюшной отдел аорты — у 7 и 5 пациентов соответственно, в 1 случае сосуды отходили от грудного и брюшного отделов аорты.
Учитывая различные варианты сосудистой архитектоники, необходимо особенно тщательно перевязывать добавочные сосуды, идущие к секвестрированной ткани легкого. При хирургических манипуляциях по поводу кисты или гнойных процессах легочной ткани необходимо помнить о возможном существовании СЛ и наличии дополнительных сосудов к ней.
Отдаленные результаты операций, выполненных у проанализированных больных, хорошие, прослежены у всех пациентов.
1. Своевременная ранняя диагностика СЛ вызывает определенные трудности из-за редкости патологии, отсутствия характерных симптомов и настороженности по врожденной патологии легких, сложности инструментальных, рентгенологических исследований и трудности их однозначной интерпретации.
2. Основным методом диагностики является рентгенологический, включающий в себя обзорную рентгенографию, томографию, РКТ в сосудистом режиме, бронхологическое обследование и контрастное исследование сосудов (аортография).
3. Триада симптомов, которая позволяет заподозрить СЛ, это: локализация в зоне базальных сегментов, кистовидное образование с обедненным легочным рисунком вокруг и данные бронхографии: отсутствие связи с бронхиальным деревом — контрастированных бронхов в зоне затемнения и вокруг нее нет. Обнаружение при аортографии аномального аберрантного сосуда позволяет окончательно определиться с диагнозом СЛ.
4. Важна своевременная ранняя диагностика порока развития до развития осложнений.
5. Оперативное вмешательство является основным методом лечения данного порока развития легких и дает хороший результат.
П.Н. Гребнев, А.Ю. Осипов
Казанский государственный медицинский университет
Детская республиканская клиническая больница, г. Казань
Гребнев Павел Николаевич — доктор медицинских наук, профессор кафедры детской хирургии
1. Бородулин Б.Е., Гелашвили П.А., Бородулина Е.А., Подсевалова Н.В. // Пороки развития и наследственные заболевания легких. — Учебное пособие. — Самара, 2003.
2. Гринберг Л.М., Худяков Л.М., Мезенцев И.А. // Вест. рентг. и радиол. — 1990. — № 4. — С. 16-20.
3. Дужий И.Д., Тертышный Н.Г. // Клинич. хир. — 1989. — № 10. — С. 35-36.
4. Картавова В.А., Левашев Ю.Н., Некласов Ю.Ф. и др. // Груд. хир. — 1984. — № 5. — С. 31-36.
5. Коновалов Ю.Н. // Труды ленинградского научного общества патологоанатомов. — 1974. — Т. 15. — С. 149-151.
6. Королев Б.А., Шахов Б.Е., Павлунин А.В. // Аномалии и пороки развития легких. — НГМА. — Н. Новгород, 2000.
7. Рокицкий М.Р., Гребнев П.Н., Осипов А.Ю. // Детская хирургия — 1998. — № 1. — С. 54-57.
8. Феофилов Г.Л., Хроменков И.Х. // Сов. мед. — 1970. — № 8. — С. 147-148.
9. Феофилов Г.Л. // Груд. хир. — 1977. — № 3. — С. 68-72.