Что такое витрификация эмбрионов
Витрификация эмбрионов: отличия от медленного замораживания
Честкова Екатерина Олеговна
Витрификация – это инновационный сверхбыстрый метод, предполагающий замораживание эмбрионов без промежуточной фазы кристаллообразования. Способ подразумевает переход всей воды, содержащейся в эмбрионе в желеобразное состояние максимально быстро. Отличие витрификации от замораживания медленным способом в том, что благодаря большой скорости удается избежать образования микрокристаллов льда, травмирующих клетки эмбриона. Таким образом, витрификация переносится эмбрионом значительно лучше, нежели медленное замораживание.
Для чего замораживают эмбрионы?
Для замораживания и хранения специалисты отбирают только хорошего качества эмбрионы с высокими показателями жизнеспособности. У женщин молодых и среднего возраста таких жизнеспособных эмбрионов хорошего качества большая часть. Трудности с отбором эмбрионов для замораживания могут возникнуть у женщин после 35 лет или у пациенток, перенесших в прошлом операции на яичниках.
Где и как долго хранятся эмбрионы в замороженном состоянии?
Эмбрионы, замороженные методом витрификации, хранятся в специальных контейнерах, заполненных жидким азотом, при предельно низкой температуре (-196С). В криобанках при соблюдении адекватного температурного режима эмбрионы могут находиться на протяжении многих лет.
Имеет ли смысл замораживание эмбрионов, если многократные попытки ЭКО не дали результатов?
Отсутствие беременности после процедуры ЭКО может быть следствием факторов временного характера, таких как гиперстимуляция яичников, простудные или инфекционные заболевания, нарушения гормонального характера. К моменту следующего переноса размороженного эмбриона эти факторы могут исчезнуть сами по себе или будут устранены, что увеличивает вероятность успешности процедуры ЭКО.
Отличается ли течение беременности и развитие плода после переноса замороженного эмбриона?
Эмбрионы, размороженные после витрификации, ничем не отличаются от эмбрионов, полученных непосредственно стандартным циклом ЭКО. Частота наступления беременности такая же как и в свежих протоколах ЭКО, а иногда чуть выше. Они одинаково хорошо приживаются и развиваются. Вероятность осложнений беременности ничуть не выше. Однако не все эмбрионы выживают после размораживания. Примерно 15% эмбрионов оказываются нежизнеспособными.
Как подготовиться женщине к переносу размороженных эмбрионов?
В случае внедрения в матку витрифицированных эмбрионов никакой специальной подготовки, как правило, не требуется. Главное условие – наличие собственного естественного цикла с нормальной периодичностью. Использование размороженных зародышей избавляет женщину от многочисленных сложностей подготовительных процедур и гормональной стимуляции. Если же женщина не имеет нормального естественного цикла (например, по причине немолодого возраста), то врач может сформировать нужный для проведения процедуры гормональный фон.
Можно ли заниматься сексом в период крио цикла, и какова вероятность забеременеть от партнера в результате естественного полового акта?
Половая жизнь на протяжении всего крио цикла не запрещается, а даже рекомендуется для обеспечения хорошего психосоматического фона. Вероятность забеременеть путем естественного полового акта имеется только при бесплодии неопределенной этиологии. Если же бесплодие вызвано факторами, исключающими естественную беременность (например, отсутствие труб), то она исключена абсолютно.
Причины бесплодия, часто остающиеся без внимания
ЭКО – это достаточно сложная и дорогостоящая процедура, требующая немалых сил. Пары, как правило, возлагают на ЭКО большие надежды, но не всегда, даже многократные попытки, дают ожидаемый результат. Наряду с физиологическими причинами неудачи могут быть вызваны и психологическими факторами. В период подготовки к проведению ЭКО обычно все внимание врача сосредоточено на физиологии, а изучению психологических проблем уделяется совсем мало времени, или не уделяется вообще.
Нередко именно психологические проблемы являются барьером, препятствующим наступлению беременности. Онлайн диагностика психосоматического здоровья бесплодных женщин разработана опытными и квалифицированными психологами специально для того, чтоб помочь выявить, оценить и устранить психологические факторы бесплодия. Пройдя тестирование, Вы сможете узнать:
Квалифицированная помощь психологов в комплексе с физиологической подготовкой в разы увеличивает шансы на успешное проведение процедуры ЭКО и долгожданную беременность.
Витрификация эмбрионов
Экстракорпоральное оплодотворение — это методика вспомогательных репродуктивных технологий, которая помогает побороть бесплодие у пациентов, которые уже отчаялись испытать радость материнства и отцовства. Суть процедуры заключается в оплодотворении экстракорпорально (вне организма женщины, то есть, в условиях лаборатории) и переносе полученных эмбрионов в полость матки женщины. Но не всегда ЭКО может закончиться в одном цикле. Или же эмбриологи получили большее количество жизнеспособных эмбрионов, нежели возможно перенести в матку женщины в данном протоколе. Именно тогда применяется такой метод, как витрификация эмбрионов.
Заведующая лабораторией, к.б.н.
Стаж работы 18 лет.
Что такое витрификация
Что такое витрификация эмбрионов? Это метод криоконсервации (заморозки) эмбрионов с возможностью сохранения их жизнеспособности и качества для дальнейшего использования в протоколах экстракорпорального оплодотворения.
Криоконсервация, витрификация — это особый метод, который подразумевает под собой мгновенное замораживание эмбрионов. Отличительной особенностью от обычной заморозки биологического материала является то, что при витрификации жидкая среда не превращается в кристаллы, не кристаллизуется.
Важными моментами в проведении процедуры витрификации является качество используемых криопротекторов (от этих материалов зависит безопасность материала как в период заморозки, так и на этапе разморозки эмбрионов), а самое главное — квалификация специалистов.

Преимущества метода
Метод витрификации полностью исключает такие риски.


Показания
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Преимущества витрификации эмбрионов
Пациентки часто спрашивают меня, не опасна ли заморозка/разморозка эмбрионов? На сколько эффективен протокол, если перенос делать с использованием размороженных эмбрионов?
Доктор Масашиге Куваяма изобрел метод витрификации на криотопах в 2000 году. С тех пор его метод использовался более 500000 раз по всему миру в более чем 1200 клиниках сорока стран с неизменно превосходными результатами. Доктор Куваяма основал первый в мире банк человеческих ооцитов и получил первого ребенка на витрифицированных эмбрионах в Японии в 2002 и в США в 2003 г.
В настоящее время метод был значительно усовершенствован, улучшены растворы и создан новый дизайн витрификационных планшетов и планшетов для размораживания. В результате метод КриоТех (CryoTechVitrification) приобрел высочайшую эффективность и простой протокол использования.
Внедрение метода витрификации в эмбриологическую практику позволило повысить выживаемость ооцитов и эмбрионов человека при криоконсервации до 98%.
У 50% пациенток после ЭКО могут оставаться эмбрионы для криоконсервации. Цикл замораживания и переноса размороженных эмбрионов значительно дешевле, чем проведение нового цикла ЭКО, и наличие замороженных эмбрионов является для пациентов своего рода «страховкой» на тот случай, если беременность не наступит.
Витрификация эмбрионов позволяет существенно повысить шансы наступления беременности после ЭКО и предотвратить гибель нормальных жизнеспособных эмбрионов, оставшихся после протокола. Это самое важное преимущество криоконсервации.
По данным разных клиник выживаемость эмбрионов после витрификации находится в интервале 80-90%, в то время как при «медленном» замораживании существенно ниже.
В ряде исследований была выявлена более высокая частота наступления беременности и родов после переноса витрифицированных эмбрионов по сравнению с переносом свежих эмбрионов в стимулированном цикле – это связано с «гормональным взрывом» во время стимуляции овуляции (когда растет не один фолликул, а несколько), что может негативно отражаться на эндометрии и приводить к раннему закрытию «окна имплантации». В связи с этим появилось мнение, что тактика отложенного («сегментированого», т.е. разделенного со стимуляцией) переноса может быть эффективна не только для снижения риска СГЯ, но и для повышения шансов на наступление беременности.
Более того, беременность, наступившая в стимулированном цикле чаще осложняется такими проблемами, как гестационный сахарный диабет, гипотиреоз, гестоз и другие.
Замораживание всех эмбрионов для будущего переноса в полость матки может быть рекомендовано женщинам, имеющим повышенный риск развития синдрома гиперстимуляции яичников после проведения индукции суперовуляции в цикле ЭКО, а также пациенткам перед проведением химио- или радиотерапии по поводу онкологических заболеваний.
Витрификация эмбрионов показана во всех случаях, когда вероятность имплантации эмбриона в полости матки снижена, например, при наличии полипа эндометрия, недостаточной толщине эндометрия к моменту переноса эмбриона, дисфункциональном кровотечении. Замораживание эмбрионов может быть включено в цикл донации яйцеклеток, если по каким-то причинам сложно провести синхронизацию менструальных циклов донора и реципиента.
Таким образом, процедура ЭКО становится все безопаснее, доступнее и эффективнее. А детки ЭКО радуют и дают смысл к жизни своим родителям.
Несколько клинических случаев из практики:
Пациентка А., 27 лет, абсолютный трубный фактор (удаление обеих труб по поводу внематочных беременностей), гормональные показатели в пределах нормы, параметры спермограммы хорошие, МАР-тест – отрицательный, два неудачных протокола ЭКО в других клиниках, оба свежие переноса, т.е. через 5 дней после пункции. Гистероскопия (оценка состояния полости матки и эндометрия) проведена перед 2-ым протоколом – без патологии. Нами получено 18 яйцеклеток, заморожено на 5 сутки 10 хороших эмбрионов, отмена переноса. У пациентки пришла менструация, на 10-12 день цикла узи – практически полный регресс желтых тел, явка на 4-5 день цикла, перенос размороженного эмбриончика на 17 день цикла при подготовке эндометрия препаратами заместительной гормональной терапии, ХГЧ на 12 ДПП 178 мЕД\мл J
Пациентка М., 36 лет, субмукозная миома матки (миома, которая растет в полость матки, деформирует полости матки и мешает имплантации) и мужской фактор бесплодия, подготовлена к протоколу ЭКО + ИКСИ (интрацитоплазматическая инъекция сперматозоида), получено 6 яйцеклеток, заморожено 3 эмбриона на 5 сутки, следующим этапом проведена гистерорезектоскопия и удаление узла миомы, подготовка эндометрия 2 месяца, перенос размороженного эмбриона на 18 дмц, ХГЧ 11 ДПП 125 J
Пациентка, С, 32 лет, бесплодие обусловленное эндометриозом (оперирована дважды L по поводу эндометриоидных кист), снижение овариального резерва, АМГ 0,7, проведен протокол ЭКО, получено 8 яйцеклеток, 3 эмбриона на 5 сутки, пациентка очень настаивала на переносе в свежем цикле, на 5 сутки перенесли 1 эмбрион (2 криконсервированы), прогрессирующая беременность осложнилась сахарным диабетом беременных с 18 недели, с 26 недель стало повышаться давление и появились отеки рук и ног, госпитализирована, в 35 недель преждевременное излитие околоплодных вод, кесарево сечение, родился недоношенный мальчик 2900 г (при диабете детки часто крупнее обычного), переведен в отделение детской реанимации, затем на выхаживание, выписан домой через 20 дней в удовлетворительном состоянии J) Все хорошо, что хорошо заканчивается!
Всем счастливой беременности и родов!
Автор статьи: врач-репродуктолог Клиники «Мать и дитя» Юго-запад Кузнецова Е.М.
Витрификация — контролируемая пауза развития в стеклоподобном состоянии
Витрификация — контролируемая пауза развития в стеклоподобном состоянии
«Приручение холода» методами витрификации дает возможность контроля над онтогенезом преимплантационных эмбрионов и позволяет осуществлять их криоконсервацию и хранение на любой стадии.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Проблема сохранения живых и функциональных клеток вне организма чрезвычайно важна в современной медицине и затрагивает многие ее области, однако наиболее остро данный вопрос встает в центрах экстракорпорального оплодотворения (ЭКО), где необходима криоконсервация не только отдельных клеток — гамет, — но и целого организма — эмбриона на преимплантационной стадии развития. Наиболее перспективным и интенсивно развивающимся направлением в криоэмбриологии сейчас является витрификация, которая постепенно вытесняет традиционно используемое медленное замораживание.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Глубокая заморозка: жизнь коротка — притормози!
Процесс индивидуального развития организма — онтогенез — начинается с момента оплодотворения и заканчивается его смертью. И, как известно, этот процесс непрерывен во времени и носит необратимый характер. И как бы нам не хотелось, мы не можем его остановить или замедлить. Однако существуют и исключения: так, например, многие растения и беспозвоночные животные, а также некоторые примитивные позвоночные с наступлением отрицательных температур перестают проявлять свойства, характерные для живых систем. В этот период их существования практически полностью останавливаются процессы обмена веществ, возобновляющиеся с повышением температуры. Такой своеобразный период покоя получил название анабиоз, — то есть, в буквальном смысле, — отсутствие жизни. Многие живые организмы Сибири способны переносить понижение температуры до −90 °С и практически полную дегидратацию. При наблюдении этой паузы онтогенеза в природе закономерно возникает вопрос о возможности применения низких температур для временной и обратимой остановки жизнедеятельности высших позвоночных, в том числе и человека. Данной проблематикой занимается наука, получившая название криобиология. Еще в 1776 году Спаланцани были предприняты первые попытки сохранения ценных клеток человека (сперматозоидов) с использованием низких температур.
Осуществляемые в центрах ЭКО процедуры лечения бесплодия немыслимы без процедуры криоконсервации, позволяющей сохранить эмбрионы и гаметы (в том числе, у пациентов, проходящих лечение рака или имеющих другие риски приобретения бесплодия), транспортировать биологический материал на любые расстояния, избежать многоплодной беременности, добиться беременности без дополнительной стимуляции, осуществлять программы донорства гамет и эмбрионов, создавать накопительные индивидуальные банки спермы для пациентов со значительной патологией эякулята [2]. Все это значительно увеличивает результативность процедуры ЭКО, сокращает ее стоимость и затрачиваемое время, что дает возможность оказать помощь большему количеству людей, желающих иметь ребенка [3].
Применение нового подхода к сверхбыстрому замораживанию — витрификации (достижения жидкостью стеклоподобного состояния без кристаллизации при сверхбыстром охлаждении) — позволяет добиться значительных успехов в криоконсервации гамет, эмбрионов и фрагментов тканей, что позволяет повысить результативность лечения бесплодия.
Но. не все так просто
Однако, главное, чего следует опасаться, подвергая эмбрионы криоконсервации, — чтобы данная пауза в их жизни, определяемая временем хранения, не была остановкой перед смертью. Иными словами, необходимо добиться максимальной сохранности замороженных клеток для полноценного функционирования после размораживания. Что же мешает использовать методы глубокого замораживания живых клеток и тканей тотально в медицине, и почему только сравнительно недавно стало возможным применять данный подход для эмбрионов? Дело в том, что процесс криоконсервации плохо переносится живыми клетками, ведь оптимумом их биологической активности являются температуры, лежащие в пределах 25–37 °C. Как известно, с понижением температуры замедляются процессы обмена веществ. При понижении температуры на 10 градусов скорость обмена веществ замедляется примерно в два раза, поэтому при температурах 20..−10 °C клетки переходят в состояние неполного анабиоза, характеризующееся сильным замедлением обменных процессов, уплотнением упаковки их мембран и переохлаждением клеток без формирования кристаллов льда. Так как содержимое клетки отлично от чистой воды, то и температура кристаллизации содержимого клеток (т.е. замерзания) отлична от нуля и сдвинута в сторону отрицательных температур. Другими словами, раствор солей и белков внутри клетки препятствует ее замерзанию при 0 °С и, подобно солевому раствору на улицах города зимой, превращающего снег и лед в грязь, поддерживает жидкое состояние цитоплазмы клеток. Естественно, такая «буферная» способность солей не безгранична, и с понижением температуры до −37 °С начинается кристаллизация внеклеточной, а затем и внутриклеточной воды (−80 °С) и переход клетки в состояние полного анабиоза. До −130 °C продолжается кристаллизация воды, и начинается кристаллизация адсорбированной воды (образующей тонкий слой около больших молекул (таких как белки) и представляющей собой сложноструктурированную воду с компактной упаковкой молекул, близкой к таковому в гелях). При дальнейшем понижении температуры образование кристаллов льда уже не происходит, и вода замерзает аморфной стеклоподобной массой.
Какие же основные факторы, кроме резкого снижения обмена веществ, препятствуют сохранности биологических объектов при замораживании?
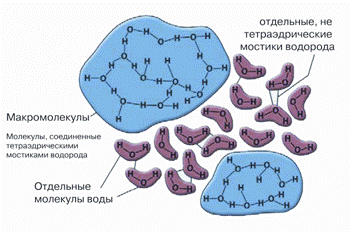
Рисунок 1. Образование кластера воды. Самопроизвольно возникающее повышение степени организации молекул жидкости — будущий центр кристаллизации при охлаждении раствора.
Для возникновения крупных кластеров необходим центр кристаллизации — любой маленький объект или неоднородность в структуре воды (пузырек воздуха, пыль, кристалл другого вещества и т.п.). В отсутствии центров кристаллизации вода не замерзнет и не станет льдом, а будет прибывать в состоянии переохлажденной жидкости. Но, как только в такой жидкости образуются центры кристаллизации, она мгновенно перейдет в твердое состояние. Формирование центров кристаллизации наиболее активно происходит при температурах, близких к −40 °С. Такие температурные условия наиболее благоприятны для запуска процесса кристаллизации воды. Однако рост кристаллов льда интенсивней всего происходит при более высоких температурах: −2..−10 °C. Напротив, при −30 °С скорость роста кристаллов воды достаточно мала. Таким образом, проводя замораживание и постепенно охлаждая образец ниже 0 °С, мы вначале имеем мало центров кристаллизации и благоприятные условия для роста кристаллов (рис. 2). Таким образом, увеличивая скорость охлаждения, мы легко проходим оптимум температуры роста кристаллов без повреждения клеток. Дальнейшее охлаждение приводит к тому, что условия для роста кристаллов льда становятся неблагоприятными, и поэтому они (кристаллы) практически не образуются. В то же время возникает множество центров кристаллизации, которые пока никак не сказываются на жизнеспособности клетки.
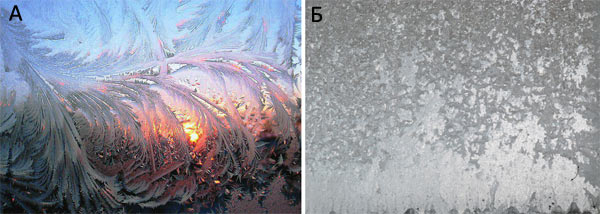
Рисунок 2. Рост кристаллов льда на стеклах трамвая или автобуса зимой. А — При небольшом морозе, когда трамвай выходит на маршрут из теплого депо, на его стеклах образуются причудливые и очень красивые узоры из огромных кристаллов льда — мало центров кристаллизации, но идеальные условия для роста кристаллов. Б — При сильном морозе стекла становятся матовыми — без узоров мороза, и, присмотревшись, мы сможем различить множество очень мелких кристалликов на них: есть множество центров кристаллизации, но условия роста кристаллов льда не подходящие.
Однако ситуация резко меняется при размораживании. Связано это со следующими особенностями: вначале, увеличивая температуру, мы снова проходим температуру, наиболее благоприятную для формирования центров кристаллизации (−40 °С), а затем, продолжая нагревание, приближаемся к оптимуму роста кристаллов (−10..−2 °C), и получаем лавинообразное образование кристаллов льда, интенсивно растущих и разрывающих клетки. Поэтому процесс размораживания требует максимально быстрого повышения температуры, что снижает вероятность роста кристаллов льда внутри клеток. Наиболее часто используемые методы размораживания — это погружение образца в теплую водяную баню и сверхвысокочастотное (СВЧ) электромагнитное нагревание. Кроме того, при плавлении внеклеточного льда в процессе размораживания возникает избыток свободной воды и, как следствие, резкое снижение осмолярности раствора, что может привести к гипотоническому шоку клеток [5].
Таким образом, процесс замораживания/размораживания клеток будет тем эффективнее, чем больше факторов риска удастся минимизировать. Для предотвращения образования кристаллов льда, губительно воздействующих на клетки, применяют разнообразные вещества с относительно низкими температурами замерзания — криоптротекторы.
Спасатели ото льда — криопротекторы
Криопротекторы — это вещества, способные снизить повреждающее действие физико-химических факторов при криоконсервации (рис. 3). Криопротекторы разделяют на проникающие (низкомолекулярные вещества с молекулярной массой менее 300 Да: метилформамид, пропандиол, глицерин, этиленгликоль, метанол, сахароза, трегалоза, диметилсульфосид, 2-метил-2,4-пентандиол) и непроникающие (высокомолекулярные веещства: некоторые белки, фикол, поливинилпиралидон, полиэтиленоксид, гидроксиэтилкрахмал, поливинилальдегид, полиэтиленгликоль желток куриного яйца, многие олигосахариды и др.).
Рисунок 3. Защитное действие криопротекторов. При отсутствии криопротектора в растворе, охлажденном ниже точки его замерзания, уже через минуту формируются кристаллы льда (верхний ряд), которые, несмотря на свою привлекательность, губительны для клеток. Напротив, при добавлении криопротекторов происходит подавление роста кристаллов в растворе (нижний ряд).
Соответственно, проникающие криопротекторы способны попасть внутрь клетки и препятствовать формированию кристаллов льда за счет формирования водородных связей с молекулами воды. Они сами замещают воду, что препятствует криодеструкции биологически важных макромолекул, и связывают некоторое количество свободной воды (что уменьшает общую дегидратацию клеток). Кроме того, проникающие криопротекторы образуют водородные связи с макромолекулами клетки, что стабилизирует их структуру [6]. Проникновение низкомолекулярных криопротекторов внутрь клетки осуществляется либо путем диффузии, либо, как было показано для глицерина, через специальные белковые каналы — аквапорины.
Непроникающие криопротекторы не могут пройти через цитоплазматическую мембрану и препятствуют осмотическим перепадам при замораживании и росту кристаллов внеклеточного льда. Также непроникающие криопротекторы позволяют снизить концентрацию проникающих, часто оказывающих токсическое влияние на клетку. Отмечено защитное действие непроникающих криопротекторв на фософолипидный компонент плазматической мембраны [7], [8], однако полностью защитное действие непроникающих криопротекторов не объяснено.
Для реализации своей функции — защиты клетки от повреждающего воздействия замораживания / размораживания — проникающим криопротекторам необходимо некоторое время для насыщения клетки. То есть биологический образец должен быть уравновешен с раствором проникающего криопротектора непосредственно перед заморозкой. Очевидно, что чем больше крипоротектора будет внутри клетки, тем эффективнее будет ее защита от кристаллов льда, однако большинство криопротекторов достаточно токсичны. Наибольшим токсическим эффектом обладают проникающие криопротекторы, поскольку они образуют неспецифические водородные связи не только с водой (защищая клетку от деструктивного действия кристаллов льда), но и с жизненно важными макромолекулами клетки (ДНК, РНК, ферментные системы), что приводит к нарушению их функционирования. Поэтому необходимо подбирать индивидуальные параметры насыщения того или иного типа клеток на разных стадиях развития растворами криопротекторов, варьируя их концентрацию и время экспозиции.
Наиболее эффективно использование комбинации проникающих и непроникающих криопротекторов: это значительно снижает токсичность раствора для криоконсервации. В качестве проникающих криопротекторов могут быть использованы дисахариды [9] или этиленгликоль, всего 11–15% которого в присутствии непроникающих криопротекторов позволяет и при небольших скоростях охлаждения добиться витрификации [10].
Так быстро, как только можно — жизнь в «стекле»
Витрификацию можно рассматривать как фазовый переход, в котором переохлажденный раствор при охлаждении ниже температуры стеклования (Tg), оставаясь аморфным, приобретает структуру стекла и свойства, аналогичные кристаллическим твердым телам. Удивительно, но и живые клетки, и даже целые эмбрионы можно таким образом превратить в «стекло». Стеклоподобное состояние жидкости при витрификации достигается за счет ее очень быстрого охлаждения — когда энтропия жидкости понижается быстрее, чем энтропия соответствующего кристаллического состояния. То есть, жидкость просто не успевает замерзать, когда ее энтропия приближается к энтропии кристалла. Однако, чтобы витрифицировать живую клетку, необходимо достижение скорости падения температур ≈10 8 °C/мин, что на практике является неосуществимой задачей, так как используемые криогенные жидкости имеют недостаточную для этого температуру, и невозможно использование объема витрифицируемого раствора меньше, чем объем ооцита или эмбриона.
Бругеллер и Майер показали, что добавление в среду для замораживания криопротекторов позволяет резко снизить скорость замораживания. Так, уже при концентрации 10% этиленгликоля и пропиленгликоля скорость замораживания можно снизить на порядок, при концентрации 40% этих веществ витрификация становится возможной при скорости охлаждения 10 3 °C/мин, а при концентрации 60% возможно ее снижение до 50 °С/мин. Но с увеличением концентрации криопротекторов, вносимых в среду, увеличивается и их негативное влияние на клетки, подвергаемые замораживанию. Медленное замораживание, по сути, также приводит к накоплению переохлажденной воды в биологическом объекте с последующей витрификацией внутриклеточного компонента, только достигается это состояние за счет сильной дегидратации клеток при образовании внеклеточного льда (рис. 4).
Рисунок 4. Быстро или медленно? Сравнение стратегий медленного замораживания, где необходимая концентрация криопротекторов достигается при постепенно контролируемом падении температуры среды с эмбрионами и ультрабыстрого снижения температуры при изначально высоком содержании в среде криопротекторов, приводящее к витрификации образца. То, как быстро изображенные на фото пингвины окажутся в водах океана, наглядно характеризует время, в течение которого криоконсервируемый образец подвергается охлаждению.
Таким образом, при достижении такого стеклоподобного состояния останавливаются процессы химической и физической деградации объекта [11]. Несмотря на достаточно сложный физический механизм процесса витрификации, вещества в таком состоянии зачастую встречаются и в нашей повседневной жизни — это собственно стекло, сладкая вата, некоторые виды силикона и множество других.
Другим способом резкого понижения температуры образца является возможность охлаждения гамет и эмбрионов при температурах более низких, чем температура жидкого азота. Самый холодный газ в жидком состоянии — это гелий (его температура кипения всего 4,2 К), и, естественно, охлаждение в нем будет наиболее эффективным. Но такие газы чрезвычайно трудно поддерживать в сжиженном состоянии, а сверхтекучесть гелия и его практически полная прозрачность делают любые манипуляции в нем практически невозможными. Поэтому был разработан метод криоконсервирования в не кипящем жидком азоте, температуру которого удается понизить до −220 °C. Этот эффект достижим при понижении давления, что приводит к понижению температуры кипения жидкости. При возвращении нормального давления непосредственно перед витрификацией материала азот не успевает нагреться и закипеть, что создает возможность замораживания в переохлажденном жидком азоте, — то есть, с большей скоростью охлаждения.
Однако определить необходимое количество криопротектора, которое нужно добавить в среду для эффективной витрификации эмбрионов, оказалось непростой задачей. Так как все процессы заморозки и оттаивания образца при витрификации происходят с очень большими скоростями за чрезвычайно малые промежутки времени и в объемах среды, не превышающих 3 мкл, отсутствуют возможность наблюдения за температурой образца или среды при помощи термометров и визуальный контроль изменения агрегатного состояния раствора. Поэтому описать кинетику процесса витрификации эмбрионов возможно лишь математически. Мазур вывел системы уравнений, которые позволяют высчитывать оптимальные схемы заморозки живых клеток, предотвращающие формирование кристаллов льда. Также данные уравнения позволяют оценить вероятность образования внутриклеточного льда при замораживании при температуре выше точки равновесия. Согласно этим теоретическим данным, маленькие объекты (такие как сперматозоиды или соматические клетки) могут быть витрифицированы вообще без добавления криопротекторов в объемах сред до 3 мкл с использованием открытых систем витрификации, где замораживаемый образец непосредственно контактирует с жидким азотом, или же витрифицированы в достаточно больших объемах среды с 10% содержанием криопротекторов и сравнительно низкими скоростями охлаждения (
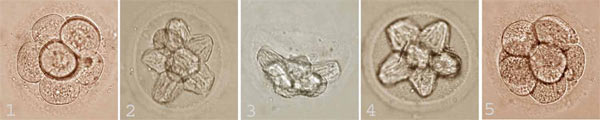
Рисунок 5. Фотографии эмбрионов человека, полученные на различных этапах витрификации. 1 — эмбрион до криоконсервации; 2 — криопротекторы почти полностью заместили собой воду в эмбрионе, что видно по его клеткам, сжавшимся в гипертооническом растворе; 3 — так выглядит эмбрион при температуре жидкого азота (−196 °C) — его клетки еще сильнее обезвожены, но живы: концентрация криопротекторов максимальна; 4 — восстановление объема клеток при оттаивании эмбриона в среде для отмывки без криопротекторов; 5 — восстановление размера клеток эмбриона за счет полного выхода из них криопротекторов.
Таким образом, процесс витрификации реально достижим для эмбрионов и гамет. Конечно, существует множество нюансов в витрификации эмбрионов на различных этапах развития in vitro в условиях ЭКО-лаборатории, но, что необходимо понимать прежде всего, — это то, что витрификация не является абсолютно новым методом криоконсервации биологического материала, а представляет собой лишь последний этап традиционного медленного замораживания. Благодаря трудам множества исследователей и клиницистов центров ВРТ, стало возможно осуществлять витрификацию не слепым методом с применением дорогостоящего программируемого замораживателя, а с использованием простейших приспособлений под полным контролем оператора, что позволяет значительно упростить методику и вместе с этим повысить ее результативность.
Однако, несмотря на значительные успехи в криоконсервации преимплантационных эмбрионов, все еще невозможна реализация идеи адекватного хранения органов или значительных объемов ткани при сверхнизких температурах. Вне зависимости от используемых методов и скоростей замораживания так же невозможно криоконсервировать, а затем вернуть к жизни целый организм человека, и поэтому следует относиться скептически к организациям, заявляющим о возможности «продления» жизни при помощи крионики. Понимание физических основ витрификации, очень кратко описанных в данной статье, полностью противоречит рекламным компаниям предприятий, заявляющих о применении крионики к человеку, а также позволит развеять ряд мифов и избежать предрассудков как в планировании экспериментальных работ, связанных с криобиологией, так и в клинической практике центров ЭКО.