Что такое висцеральный криз в онкологии
Новые возможности эндокринной терапии при распространенном раке молочной железы
—>
Обзор современных рекомендаций
Распространенный рак молочной железы (РМЖ) поддается лечению, но по-прежнему остается слабо курабельным заболеванием, основными целями терапии которого являются увеличение продолжительности и улучшение качества жизни пациентов. Несмотря на успехи последних лет, достигнутые в терапии HER2-позитивного и люминального подтипов РМЖ, медиана общей выживаемости среди всех пациентов с распространенными стадиями заболевания составляет 2-3 года, хотя диапазон в пределах группы достаточно велик.
Несмотря на бесспорные результаты в применении таргетной терапии при РМЖ, эндокринная терапия (ЭТ) ингибиторами ароматазы III поколения (летрозолом, анастрозолом и экземестаном) при гормонположительном распространенном РМЖ позволяет улучшить общую выживаемость больных и является стандартом лечения первой линии для женщин в постменопаузе. В то же время первичная и приобретенная резистентность заметно ограничивают успех этой терапевтической стратегии. На сегодняшний день предложены конкретные опции для назначения и переключения ЭТ при лечении гормонположительного и HER2-негативного РМЖ, основанные на последних данных клинических исследований, что позволяет увеличить показатели общей и безрецидивной выживаемости.
В настоящее время существует ряд признанных терапевтических стандартов для лечения РМЖ. В 2005 г. была создана целевая группа онкологов для разработки международных рекомендаций и поиска новых стратегий контроля распространенного РМЖ, которые могут быть применены по всему миру, а также выявления областей, в которых необходимы дальнейшие исследования. Первая Международная конференция по созданию рекомендаций по диагностике и лечению распространенного РМЖ (АВС1) состоялась в ноябре 2011 г. и была ориентирована на создание четких рекомендаций. Вторая Международная конференция (ABC2) состоялась в ноябре 2013 г. и была направлена на обновление существующих рекомендаций.
В рекомендациях АВС1 (2011) были представлены убедительные доказательства того, что ЭТ является предпочтительным вариантом для гормонположительного РМЖ даже при наличии висцеральных метастазов, а также в случаях, когда отсутствуют признаки резистентности к ЭТ или когда заболевание быстро прогрессирует, что требует быстрой терапевтической реакции. Для женщин в пременопаузе подавление функции яичников или их удаление в сочетании с дополнительной ЭТ является терапией первого выбора.
В 2011 г. было предложено применять ингибитор ароматазы (ИА) в качестве первой линии ЭТ у пациенток в постменопаузе. В то же время тамоксифен был представлен как возможный вариант первой линии терапии у ряда пациенток в странах с низким и средним уровнем доходов, а также при отсутствии резистентности к тамоксифену.
После рецидива на терапию ИА в качестве возможных вариантов были представлены различные препараты ЭТ с разными механизмами действия (фулвестрант, мегестрол ацетат).
В последние годы возникла необходимость в пересмотре и модернизации существующих рекомендаций, что было вызвано накоплением результатов исследований, посвященных изучению сочетания эверолимуса и ИА при лечении HER2-негативного и гормонположительного РМЖ у пациенток с приобретенной устойчивостью ЭТ. Также требовалось введение ряда новых определений, которые отсутствовали в рекомендациях АВС1.
В рекомендации ABC2 (2014) были включены определения, касающиеся таких понятий, как «висцеральный криз» и «резистентность к ЭТ». Висцеральный криз – тяжелая дисфункция внутренних органов, определяемая по симптомам и результатам лабораторных исследований, а также быстрое прогрессирование заболевания. Висцеральный криз подразумевает под собой не просто наличие висцеральных метастазов, но и «висцеральное ухудшение», то есть клиническое показание для более быстрой, агрессивной, терапии.
Первичная резистентность к ЭТ – это развитие рецидива в течение первых 2 лет адъювантной ЭТ или прогрессирование заболевания в течение первых 6 мес первой линии ЭТ при метастатическом РМЖ.
Вторичная (приобретенная) резистентность к ЭТ – развитие рецидива во время адъювантной ЭT после первых 2 лет лечения или в течение 12 мес после завершения адъювантной ЭТ, или прогрессирование заболевания после 6 мес после проводимой ЭТ у пациенток с метастатическим РМЖ.
Как и ранее, в рекомендациях АВС2 было отмечено, что ЭT является предпочтительным вариантом для гормонположительного и HER2-негативного РМЖ даже при наличии висцеральных метастазов. В качестве первой линии ЭТ у пациенток в постменопаузе применяются ИА или тамоксифен, в зависимости от типа и продолжительности адъювантной ЭТ. Схема с использованием высоких доз (500 мг) фулвестранта в данном случае может быть как вариант терапии.
Комбинация эверолимуса в ИА является допустимым вариантом для пациенток в постменопаузе при наличии прогрессирования заболевания после использования нестероидных ИА. Данное решение было основано на представленных результатах исследования BOLERO-2.
Напомним, что в рандомизированном плацебо-контролируемом исследовании III фазы BOLERO-2 было показано, что эверолимус (mTOR-ингибитор) расширяет возможности лечения для женщин в постменопаузе с гормонположительным, HER2-негативным распространенным РМЖ, который прогрессирует на фоне терапии нестероидным ИА. Эверолимус при добавлении к экземестану обеспечивает значительное продление выживаемости без прогрессирования (около 5 мес). Данные, представленные консенсусом ABC2, продемонстрировали также увеличение общей медианы выживаемости на 4 мес, однако оно не было статистически достоверным.
Кроме того, в пользу включения терапии эверолимусом в рекомендации АВС2 свидетельствуют результаты исследования TAMRAD, в котором сравнивали лечение комбинацией эверолимуса с тамоксифеном с монотерапией тамоксифеном у пациентов с резистентностью к ИА. В исследовании TAMRAD было показано продление общей выживаемости на фоне комбинированного лечения.
В рекомендации АВС2 вошло положение, что добавление эверолимуса к ингибиторам ароматазы является допустимым вариантом для пациенток в постменопаузе с прогрессированием заболевания после терапии нестероидным ИА, поскольку приводит к значительному продлению выживаемости без прогрессирования. При принятии решения о назначении комбинированного лечения нужно учитывать токсичность, связанную с применением данной комбинации, и основываться на специфике конкретного клинического случая. Преимущества, достигаемые при применении комбинированной терапии, должны быть оценены с учетом развития токсических эффектов, таких как стоматит, пневмония, явления гипергликемии. Назначение комбинированного лечения эверолимуса с экземестаном должно производиться врачами, имеющими опыт в управлении побочными эффектами, которые развиваются при применении этих препаратов.
Таким образом, согласно рекомендациям ABC2 оптимальный режим терапии после ИА на сегодняшний день не определен. Доступные варианты лечения включают (но не ограничиваются таковыми) тамоксифен, ИА с другим механизмом действия (фулвестрант, мегестрола ацетат) и эверолимус в сочетании с ИА.
Эверолимус используется перорально, что оптимально для пациента. Кроме того, использование комбинации с экземестаном характеризуется оптимальным профилем безопасности, что расширяет возможности терапии для пациентов с прогрессирующим гормонположительным и HER2-негативным распространенным РМЖ после ИА.
Рис. 2. Терапевтический алгоритм после адъювантной терапии ИА
Источники
1. AGO Recommendations for Diagnosis and Treatment of Patients with Advanced and Metastatic Breast Cancer: Update 2013.
2. ESO-ESMO 2-nd international consensus guidelines for advanced breast cancer, ABC2, 2014.
Подготовила Катерина Котенко
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Із розвитком імуноцитологічних, імуногістохімічних та інших методів молекулярної діагностики значно розширилися терапевтичні можливості лікування онкологічної та онкогематологічної патології, у тому числі хронічної лімфоцитарної лейкемії (ХЛЛ). Визначення деяких факторів ризику дозволяє оптимізувати терапію та обрати ту терапевтичну опцію, яка матиме найбільшу користь для конкретного пацієнта.
Уже вдруге щорічний конгрес Європейського товариства медичної онкології (ESMO) відбувається у віртуальному просторі (формальним його господарем 21-25 вересня був Париж). Звичайно ж, через такий формат ці дуже важливі зустрічі онкологів багато втрачають, але всупереч складним умовам на конгресі ESMO-2021 оприлюднено результати низки важливих досліджень, які невдовзі змінять стандарти лікування. Традиційно про найголовніші досягнення повідомляється на президентських симпозіумах (їх було кілька). Особливо виділимо три повідомлення: про роль імунотерапії при занедбаному раку шийки матки, а також при ранній стадії меланоми і недрібноклітинного раку легені (НДРЛ).
4 вересня відбулася національна науково-практична конференція з міжнародною участю «Досягнення в клінічній онкології в 2021 році: прорив в терапії раку яєчників». На заході обговорювали сучасні підходи до діагностики раку яєчника (РЯ), застосування патоморфологічного та молекулярно-генетичного досліджень, BRCA-тестування, важливість хірургічного втручання з подальшою хіміотерапією (ХТ), а також необхідність індивідуалізованого підходу до ведення кожної хворої з застосуванням таргетної терапії при поширених формах епітеліального РЯ та його рецидивах.
Что такое висцеральный криз в онкологии
Л.Ю. Владимирова, И.Л. Попова, Н.А. Абрамова, А.Э. Сторожакова, Н.М. Тихановская, К.А. Новоселова, А.А. Льянова, Л.А. Рядинская, М.О. Ежова, М.А. Теплякова
Ростовский научно-исследовательский онкологический институт, Ростов-на-Дону, Россия
Обоснование. Метастатический РМЖ (мРМЖ) – неизлечимое заболевание, однако современные лечебные подходы позволяют достигать клинически значимых результатов. Методы. Были проанализированы данные об эффективности и безопасности препарата трастузумаб эмтанзин в лечении 14 пациенток с мРМЖ с висцеральными поражениями во второй линии терапии. Результаты. Общий ответ на лечение составил 71,4% (10 пациенток), из них у 1 – полная ремиссия, частичная ремиссия у 2 (14,3%), стабилизация процесса у 7 (50%), прогрессирование процесса у 4 (28,6%) пациенток. Медиана безрецидивной выживаемости не была достигнута в связи с небольшим сроком наблюдения. Общая безрецидивная выживаемость составила 58%, медиана общей выживаемости – 9 месяцев. Общая годичная выживаемость составила около 71,4%. Из токсических явлений терапии отмечены астения, тошнота, рвота, диарея, анемия, тромбоцитопения, лейкопения. Описание клинического случая. Представлен результат применения препарата в первой линии терапии HER2-положительного РМЖ в отношении пациентки 62 лет с прогрессированием во время проведения адъювантной терапии препаратом трастузумаб. Заключение. Препарат обладает высокой эффективностью для пациенток с HER-2-положительным мРМЖ при достаточно благоприятном профиле токсичности.
Для цитирования: Владимирова Л.Ю., Попова И.Л., Абрамова Н.А., Сторожакова А.Э., Тихановская Н.М., Новоселова К.А., Льянова А.А., Рядинская Л.А., Ежова М.О., Теплякова М.А. Трастузумаб эмтанзин в терапии HER2-положительного метастатического рака молочной железы у пациенток с висцеральным кризом. Фарматека. 2019;26(7):58–63. DOI: https://dx.doi.org/10.18565/pharmateca.2019.7.58-63
Актуальность
В развитых странах в структуре онкологической заболеваемости женщин рак молочной железы (РМЖ) занимает 1-е или 2-е место (20–25 % всех случаев рака). Более чем у половины больных РМЖ на том или ином этапе заболевания развиваются отдаленные метастазы. Метастатический РМЖ (мРМЖ) – неизлечимое заболевание, однако современные лечебные подходы позволяют достигать клинически значимых результатов. Выявление все новых и новых молекулярно-генетических и иммуногистохимических маркеров и их корреляций позволяет индивидуализировать тактику лечения больных [1]
К наиболее значимым факторам неблагоприятного прогноза при мРМЖ относится избыточная экспрессия HER2 – трансмембранного рецептора с активностью тирозинкиназы, что служит результатом амплификации гена HER2 в 17-й хромосоме [2, 3]. Исследования показали, что HER2-положительный подтип чаще встречается среди молодых женщин с распространенными стадиями болезни, характеризуется высокой агрессией и быстрой диссеминацией опухолевого процесса, не зависит от размеров опухоли. Даже при минимальных размерах карцином и в отсутствие поражения регионарных лимфоузлов гиперэкспрессия HER2 ассоциирована с неблагоприятным течением заболевания [3, 4]. Сегодня определение HER2-статуса при РМЖ обязательно для всех стадий заболевания, необходимо для оценки прогноза и выработки оптимального лечебного алгоритма. Определение HER2-статуса в опухоли стандартизировано и выполняется на парафиновых блоках опухоли с помощью иммуногистохимического анализа и при сомнительном результате анализа (HER2-2+) дополняется определением амплификации гена методом гибридизации in situ (ISH) [5–7].
Анти-HER2-терапия в настоящее время является стандартным подходом к лечению больных раком молочной железы (РМЖ) с гиперэкспрессией HER2 или амплификацией гена HER2 и обычно дополняет химио- или гормонотерапию [8].
Трастузумаб эмтанзин (T-DM1) представляет собой конъюгат антитела и химиопрепарата (ADC), доставляющий последний непосредственно в HER2-положительные раковые клетки, благодаря чему ограничивается повреждение здоровых тканей [8, 9].
Механизм противоопухолевого действия T-DM1 складывается из эффектов трастузумаба и DM1 и является многоступенчатым: на I этапе трастузумаб связываясь с HER2-рецептором, осуществляет весь спектр своего противоопухолевого воздействия, а именно вызывает блокаду сигнальных путей HER2, активирующих рост опухоли, и маркирует опухолевую клетку для иммунной системы. Далее образовавшиеся комплексы поступают внутрь клетки посредством обычного эндоцитоза, где при участии внутриклеточных ферментов происходит разрушение линкера и высвобождение химиопрепарата DM1, который вызывает гибель клетки за счет нарушения полимеризации микротрубочек и остановки клеточного цикла [8, 9].
Применение трастузумаба эмтанзина в монотерапии во второй линии лечения метастатического HER2-позитивного РМЖ позволяет добиваться существенного увеличения общей выживаемости до 2,5 лет и увеличить медиану времени до прогрессирования заболевания на 50% по сравнению со стандартной комбинацией лапатиниба и капецитабина (по данным исследования EMILIA) [10–12]. Представленные данные крупных рандомизированных исследований говорят о том, что современная терапия HER2-положительного РМЖ позволила перевести фатальное течение заболевания в длительно контролируемую форму [11, 12].
Задачей нашего исследования стала оценка эффективности и связанной с ним токсичности препарата трастузумаб эмтанзин (T-DM1) при лечении метастатического РМЖ у пациенток с висцеральным кризом.
Методы
В исследование включены пациентки с HER-2 положительным статусом мРМЖ, у которых имело место прогрессирование после адъювантной химио- или гормонотерапии с трастузумабом либо прогрессирование на 1-й линии химиотерапии (ХТ) и трастузумаба с развитием висцерального криза, ECOG≤2, с адекватной функцией печени, почек, костного мозга. Т-DM1 применялась в качестве 2-й линий лечения мРМЖ. Препарат назначался в дозе 3,6 мг/кг 1 раз 3 недели. Оценку эффекта проводили каждые 2–3 курса, согласно критериям RECIST 1.0, по результатам спиральной компьютерной томографии или магнитно-резонансной томографии.
Оценивали непосредственный противоопухолевый эффект. Токсичность проведенного лечения оценивалась согласно критериям CTCAE 4, анализ общей и безрецидивной выживаемости – по Каплану–Майеру. Статистическая обработка данных проводилась с помощью пакета программ Statistica 10.0.
В исследование были включены 14 пациенток в возрасте 30–49 лет, средний возраст составил 44 года (табл. 1).
По рецептурному статусу женщины распределялись следующим образом: ER+ и/или PR+ – 6 (42,9%), ER- и/или PR – 8 (57,1%).
Все больные мРМЖ исходно имели различные стадии заболевания, представленные в табл. 2.
У 71,42% пациенток исходно имела место III стадия процесса. Независимо от исходной стадии болезни к началу терапии у всех пациенток был метастатический распространенный опухолевый процесс.
У 7 (50%) пациенток отмечено прогрессирование заболевания на фоне адъювантной терапии трастузумабом, у 2 (14,3%) – на фоне гормонотерапии и трастузумаба, у 5(35,7%) – на фоне таксанов и трастузумаба.
В табл. 3 представлено распределение висцеральных метастазов: в процесс было вовлечено более трех органов и систем 4 (28,6%) пациенток: кости, печень, легкие. Метастатическое поражение одного органа у 5 (35,7%) пациенток было представлено поражением легких, сочетанное поражение легких и головного мозга у 5 (35,7%). Терапию трастузумабом эмтанзином начинали при относительно удовлетворительном состоянии пациентов (ECOG-1–2), удовлетворительных гематологических и биохимических показателях крови.
Проведено от 3 до 8 курсов лечения препаратом Т-DM1, терапию продолжали до достижения максимального эффекта или прогрессирования заболевания, или неприемлемой токсичности.
Таким образом, 3 (21,4%) больным проведено 8 курсов; 5 (35,7%) – 3 курса и в связи с прогрессированием процесса пациентки подверглись другому лечению. Остальные 6 (42,8%) пациенток получили по 6 курсов противоопухолевой терапии.
Результаты
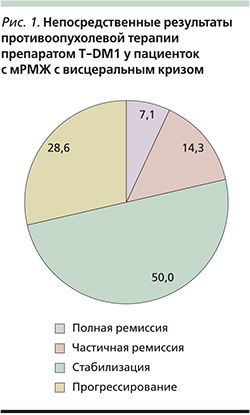
Результаты проведенного лечения представлены на рис. 1.
Общий ответ составил 71,4% (10 пациенток), из них у 1 (7,1%) наблюдалась полная ремиссия (ПР), у 2 (14,3%) – частичная (ЧР), у 7 (50%) пациенток – стабилизация процесса. Прогрессирование процесса отмечено у 4 (28,6%) пациенток.
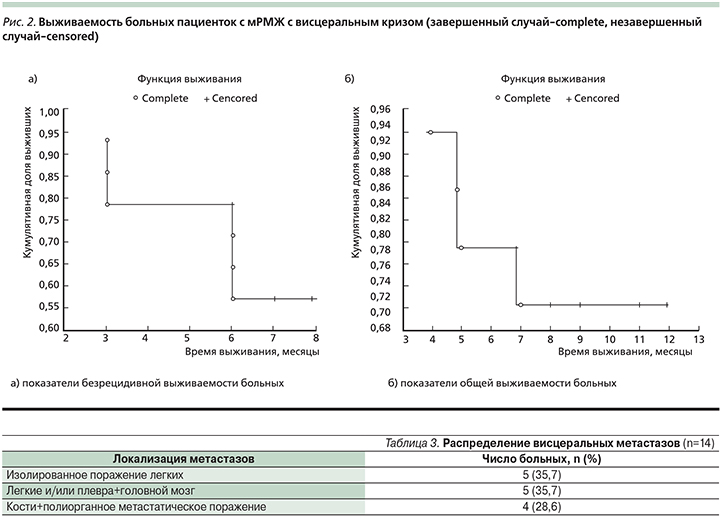
Медиана безрецидивной выживаемости не достигнута из-за небольшого срока наблюдения. Общая безрецидивная выживаемость составила 58%, медиана общей выживаемости – 9 месяцев. Общая годичная выживаемость составила около 71,4% (рис. 2).
Полученные данные по безрецидивной и общей выживаемости подтверждают мнение многих авторов об эффективности применения препарата трастузумаб эмтанзин в группе больных, ранее получавших лечение таксанами и трастузумабом, а продолжительность изучаемых показателей соответствовала литературным данным [3, 10].
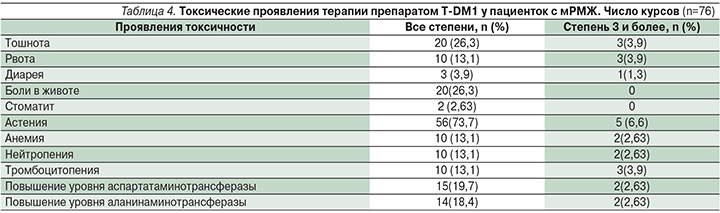
При изучении токсичности проводимой химиотерапии, согласно CTC AE 4.0, нами было проанализировано 76 курсов ХТ. Согласно публикациям, к наиболее частым серьезным побочным эффектам относятся астения, тромбоцитопения, рвота, боли в животе. Из негематологических осложнений в нашей группе больных преобладали гастроинтестинальные (72%). Из них (гастроинтестинальных осложнений) чаще наблюдались тошнота – в 26,3%, боли в животе – 26,3%.
Спектр и выраженность токсических проявлений терапии препарата Т-DM1 представлены в табл. 4.
В целом следует отметить удовлетворительную переносимость препарата, несмотря на перечисленные возможные побочные эффекты, следует обратить внимание на астению 1–2-й степеней – 73,7%. Побочные эффекты в основном были слабо выражены, при появлении 3-й степени и более адекватно поддавались лекарственной коррекции.
Имея собственный опыт применения препарата Т-DM1, хотелось бы продемонстрировать наиболее впечатливший нас результат применения препарата первой линии терапии метастатического HER2-положительного РМЖ при прогрессировании во время проведения адъювантной терапии препаратом трастузумаб.
Клинический случай
Пациентка Д. 62 лет находилась на обследовании и лечении в ФГБУ РНИОИ МЗ РФ с 07.12.2016.
Образование в железе обнаружила в ноябре 2016 г., самостоятельно обратилась в РНИОИ. Обследована, выполнена трепанбиопсия опухоли правой молочной железы 07.12.2016. Верификация процесса ГА № 102350-351: карцинома. При иммуногистохимическом исследовании опухоли левой молочной железы выявлено отсутствие экспрессии рецепторов прогестерона и эстрогена (ER-и PR-, Ki-67 80%). Реакция антител с рецепторами HER2/neu 3+. Спиральная рентгеновская компьютерная томография (СРКТ) головного мозга от 07.12.2016: без очагов.
СРКТ органов шеи, грудной клетки (ОГК), брюшной полости (ОБП) и органов малого таза (ОМТ) от 07.12.2016: легкие без очагов, печень без очагов, внутригрудные, забрюшинные лимфоузлы не увеличены, патологических объемных образований в полости малого таза не выявлено.
В костях без деструкции. Остеохондроз L5–S1. В правой молочной железе опухоль 3,4×3 см, аксиллярные л/у справа до 4 см.
В результате проведенного обследования пациентке установлен диагноз «рак правой молочной железы T4N2Mo, St IIIB, нелюминальный HER-2-позитивный, кл. гр. т2».
С 12.12.2016 проведено комплексное лечение: 4 курса препаратами доксорубицин, эндоксан (циклофосфамид), далее 4 курса пертузумаб, трастузумаб, доцетаксел.
На этапах выполнялось контрольное обследование: СРКТ головы, шеи, ОГК, ОБП и малого таза от 09.06.2017: без онкопатологии.
22.06.2017 выполнена радикальная мастэктомия справа. ГА № 55368-78/17 инфильтрирующая карцинома неспецифического типа, склероз, лечебный патоморфоз 2-й степени, № 55368-78/17, в оставшейся молочной железе, клетчатках и лимфоузлах опухолtq нет.
С 13.07 по 09.08.2017 проведен курс лучевой терапии на послеоперационный рубец СОД 50 гр, на подключичную зону справа СОД 44 гр. Затем таргетная адъювантная терапия трастузумабом в течение года.
В январе 2018 г. на фоне таргетной адъювантной терапии трастузумабом появились жалобы на кашель, одышку, головокружение, головные боли.
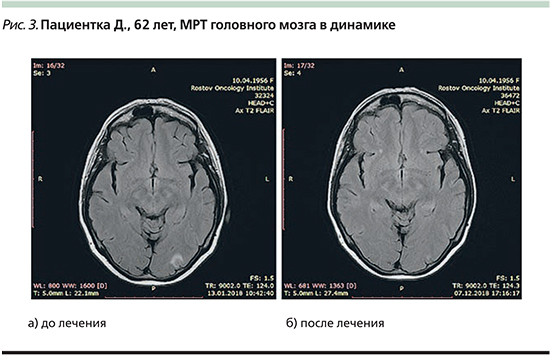
Магнитно-резонансная томография головного мозга с внутривенным контрастированием от 13.01.2018. Заключение: МР-картина солитарного опухолевого поражения левой затылочной доли 7×7 мм интракортикально с наличием перифокального отека до 11×11 мм. Кортикальная атрофия, лейкодистрофия (рис. 3а).
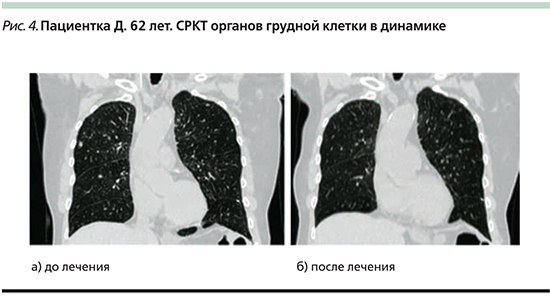
При дообследовании СРКТ органов шеи, грудной клетки, брюшной полости, малого таза от 13.01.2018: с обеих сторон множественные метастатические очаги до 1,3 см, увеличение предаортальных лимфоузлов 1,2 см (рис. 4а).
Принято решение о назначении пациентке препарата трастузумаб эмтанзин в дозе 3,6 мг/кг внутривенно 1 раз в 21-й день. На текущий момент проведено 18 циклов терапии препаратом, достигнут полного ответа.
МРТ головного мозга с внутривенным контрастированием от 07.12.2018. Заключение: МР-картина незначительной диффузной кортикальной атрофии мультифокальных супратенториальных очагов глиоза сосудистого генеза. Метастатическое поражение не определяется (рис. 3б).
СРКТ органов шеи, грудной клетки, брюшной полости, малого таза от 07.12.2018: данных за метастатическое поражение легочной ткани не выявлено (рис. 4б). Пациентка ведет активный образ жизни, работает. Из побочных эффектов, связанных с терапией, тошнота 1–2-й степеней. Планируется продолжение терапии препаратом трастузумаб эмтанзин.
Заключение
Проведенный нами анализ применения препарата Т-DM1 показал, что препарат обладает достаточно высокой эффективностью для пациенток с HER-2-положительным мРМЖ при достаточно благоприятном профиле токсичности.
Литература
1. Кит О.И., Шатова Ю.С., Новикова И.А. и др. Экспрессия р53 и BCL2 при различных подтипах рака молочной железы. Фундаментальные исследования. 2014;10:85–8.
2. Саманева Н.Ю., Владимирова Л.Ю., Новикова И.А. и др. Опыт определения HER2 статуса циркулирующих опухолевых клеток в периферической крови у больных с местно-распространенным раком молочной железы приHER2-негативном подтипе опухоли. Медицинский вестник Северного Кавказа. 2018;13(4):634–37. Doi: https://doi.org/10.14300/mnnc.2018.13124.
3. Сидорова С.С., Панферова Е.В., Пономаренко Д.М. и др. Применение T-DM1 (Кадсила) при метастатическом HER2-позитивном раке молочной железы. Эффективная фармакотерапия. 2018;31:16–8.
4. Белохвостова А.С., Рагулин Ю.А. Возможности терапии Her-2-позитивного местно-распространенного рака молочной железы. Опухоли женской репродуктивной системы. 2015;11(1):43–47. Doi: https://doi.org/10.17650/1994-4098-2015-1-43-47.
5. Стенина М.Б. Персонализированный подход к терапии распространенного HER2-положительного рака молочной железы. Современная онкология. 2014;03:21–6.
6. Колядина И.В., Поддубная И.В. Современные возможности терапии HER2-положительного рака молочной железы (по материалам клинических исследований).Современная онкология. 2014;04:10–20.
7. Семиглазова Т.Ю., Дашян Г.А., Семиглазов В.В.и др. Качество жизни – принципиальный критерий эффективности таргетной терапии метастатического HER2-положительного рака молочной железы. Современная онкология. 2015;01:19–24.
8. Стенина М.Б. Нer-2 как мишень современной противоопухолевой терапии рака молочной железы. Эффективная фармакотерапия. 2015;10:24–31.
9. Сакаева Д.Д. Клинический случай успешного применения препарата кадсила при метастатическом her2-положительном раке молочной железы. Медицинский совет. 2017;14:56–8. Doi: 10.21518/2079-701X-2017-14-56-58.
10. Krop I.E., Lin N.U., Blackwell K., et al. Trastuzumab emtansine (T-DM1) versus lapatinib plus capecitabine in patients with HER2-positive metastatic breast cancer and central nervous system metastases: a retrospective, exploratory analysis in EMILIA. Ann Oncol. 2015;26(1):113–19. Doi: 10.1093/annonc/mdu486.
11. Ross J.S., Fletcher J.A. The HER-2/neu oncogene in breast cancer: prognostic factor, predictive factor, and target for therapy. Oncologist. 1998;3(4):237–52.
12. Verma S., Miles D., Gianni L., et al., for EMILIA Study Group. Trastuzumab Emtansine for HER2-Positive Advanced Breast Cancer. N Engl J Med. 2012;367(19):1784–91. Doi: 10.1056/NEJMoa1209124.