Что такое виллизиев круг головного мозга
Узи сосудов головного мозга
Стоимость дуплексного сканирования сосудов основания головного мозга 450 гривен. В стоимость входит исследование артериальных сосудов основания головного мозга бассейна внутренней сонной и позвоночных артерий с проведением функциональных проб. Также в стоимость входит исследование путей венозного оттока от глубоких и поверхностных вен головного мозга с проведением функциональных проб. Исследование потей коллатерального кровоснабжения. Подробный отчет об исследовании, печать снимков и запись на электронный носитель.
Узи сосудов головного мозга проводят через три доступа: глазничный, транстемпоральный (через тонкую часть височной кости) и затылочный. При помощи глазничного доступа оценивают кровоток в глазной и надблоковой артериях. Это узи сосудов головного мозга позволяет выявить аномальное поступление крови в головной мозг при закупорке внутримозговых артерий.
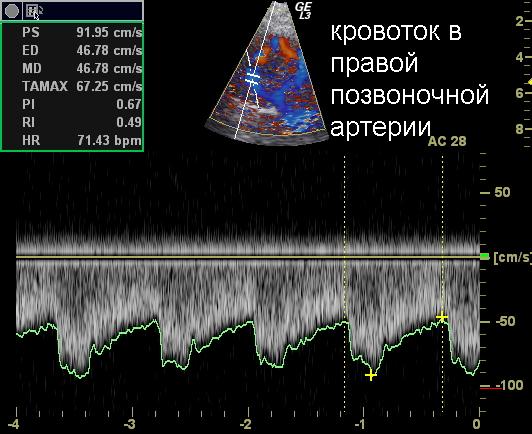
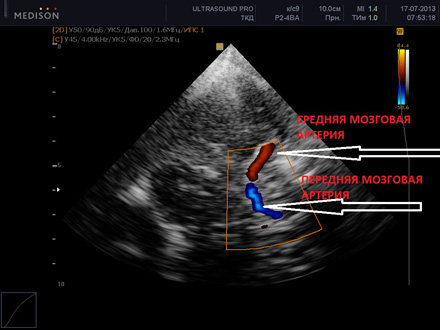
Через височную кость проводят узи сосудов основания головного мозга: средней, передней и задней мозговой артерий, а также вен Галена, прямого синуса и вены Розенталя. Узи сосудов головного мозга через большое затылочное отверстие используют для исследования внутричерепных отделов позвоночной и основной артерий, а также для исследования прямого синуса и вены Галена.
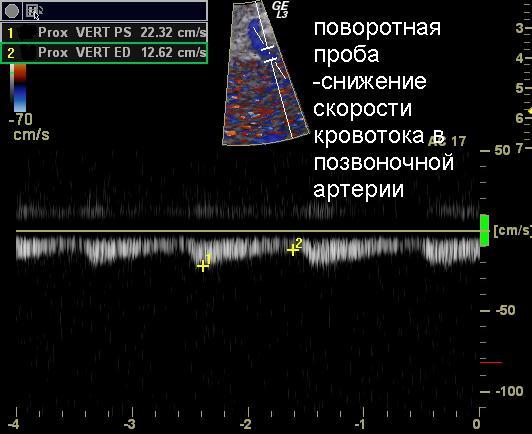
Во время проведения узи сосудов головного мозга применяют компрессионные пробы для оценки состоятельности Виллизиева круга. Виллизиев круг – это совокупность сосудов основания головного мозга, соединенная между собой коммуникантными артериями. Кровоснабжение головного мозга осуществляется 4 артериями: правой и левой внутренней сонной и правой и левой позвоночной. Позвоночные дают начало задним мозговым артериям, а сонные – передней и средней мозговой артерии. Если происходит нарушение кровоснабжения по одной из этих артерий, поток крови распределяется таким образом, что пораженная зона все равно обеспечивается всем необходимым за счет других сосудов. У некоторых людей Виллизиев круг не замкнут и компенсаторные возможности сосудистой системы головного мозга ограничены.
При помощи узи сосудов головного мозга исследуются также скоростные характеристики венозного оттока по главным венам черепа: венам Галена и Розенталя, а также в прямом синусе. При повышении внутричерепного давления скорость кровотока по ним увеличивается.
При узи сосудов головного мозга для оценки способности сосудов адекватно расширяться и сужаться производят пробы с задержкой дыхания, с открыванием и закрыванием глаз, с усиленным дыханием, с приемом нитроглицерина.
Таким образом проведение функциональных проб во время узи сосудов головного мозга является очень ценным диагностическим методом, незаменимым при оценке нарушений мозгового кровообращения.
Узи сосудов головного мозга не требует от пациента дополнительной подготовки. Желательно в день исследования не принимать препаратов, влияющих на артериальное давление и не курить до исследования.
Диагностика повышения внутричерепного давления
Диагностика повышения внутричерепного давления при помощи узи сосудов головы.
Узи сосудов головы не может измерить давление ликвора в полости черепа, но может дать качественную оценку давления в венах головного мозга. Давление во внутричерепных венах коррелирует с давлением ликвора. Существует несколько методик. В нашей клинике во время исследования мы используем их во время каждого узи сосудов головы.
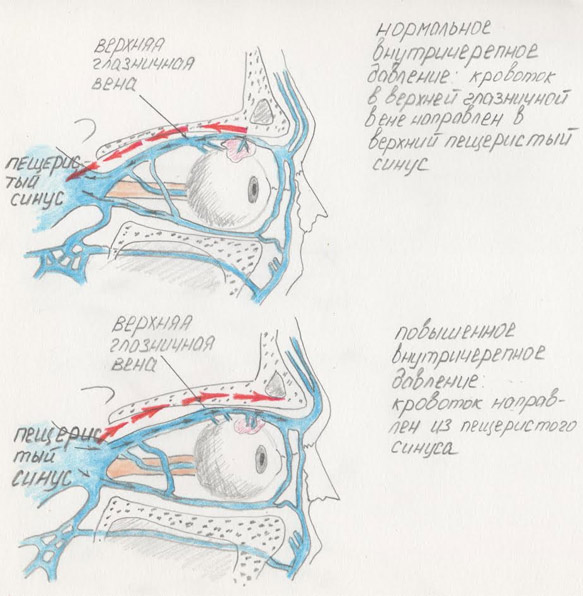
Наиболее точным критерием, который показывает повышение давления в венах головного мозга при узи сосудов головы является определение направления и скорости кровотока в верхней глазничной вене. При этом пациент закрывает глаза, а датчик располагается на верхнем веке. При дуплексном сканировании оценивается направление и скорость движения крови по верхней глазничной вене. Предпосылкой для такого исследования является знание о том, что верхняя глазничная вена впадает в верхний пещеристый синус (лежащий в полости черепа) через щель в глазнице. То есть движение крови в ней направлено из глазницы в полость черепа. Любой человек, знакомый с школьным курсом физики, понимает, что направление движения жидкости всегда происходит от высокого давления к низкому. Иными словами, если кровь из глазницы благополучно выходит в верхний пещеристый синус – значит в нем и в полости черепа давление меньше, чем в глазнице. Если же при исследовании сосудов головы мы обнаруживаем, что кровь направляется из пещеристого синуса в глазницу, становится очевидным, что имеется повышение внутричерепного венозного давления.
Заключение «повышение внутричерепного венозного давления» в нашей клинике дается только после проведения вышеперечисленных исследований.
Особенности применения транскраниального дуплексного сканирования
Наиболее частая причина обращения пациентов для проведения исследования сосудов головного мозга – головная боль. Приходя на узи сосудов головы многие люди ожидают, что причины головной боли будут раскрыты и врач сразу же во время исследования даст ответ на вопрос, как облегчить боль или избавиться от нее раз и навсегда. Медицинская же статистика говорит о том, что эффективными и полезными для решения данной проблемы являются лишь от 9 до 10% исследований различных модальностей: КТ, МРТ, дуплексное сканирование (узи сосудов головного мозга) или даже ПЭТ. То есть, только у менее, чем 10% пациентов с головной болью, состояние вызвано органическими нарушениями сосудов или других внутричерепных структур. Поэтому правильнее было бы описать роль дуплексного сканирования сосудов головного мозга не как диагностическую процедуру, способную обнаружить причину головной боли, а как инструмент исключения серьезных структурных патологий: артериовенозных мальформаций, тромбов, атеросклеротических поражений, объемных внутричерепных новообразований и повышения внутричерепного давления (последнее при помощи дуплексного сканирования определяется не совсем точно).
Что такое виллизиев круг головного мозга
Информация о работе и расписание
Госпитальная высококвалифицированная медицинская помощь
Услуги центра по восстановительной медицине
Восстановление после спортивных травм
Современная диагностика – шанс предупредить болезнь
Он-лайн консультации для врачей по сложным практическим случаям
Трудоустройство в ФГАУ ЛРЦ
Стандарты и порядки оказания медицинской помощи
Проведение этической экспертизы клинических исследований, медицинских испытаний
Статьи и презентации
Аневризмы
Слово «аневризма» происходит от латинского «aneurysma», что означает расширение. Аневризма – это абнормальное локальное расширение стенки кровеносного сосуда, обычно – артерии из-за дефекта, заболевания или травмы.
Аневризма могут быть истинными и ложными. Ложная аневризма – это полость, заполненная кровяным сгустком. Различают два вида истинных внутричерепных аневризм: мешотчатые и фузиформные (веретенообразные).
Этиология
Большинство мешотчатых внутричерепных аневризм ранее представлялись результатом постепенного выпячивания в области врожденного дефекта сосудистой стенки, которое развивается в течение жизни.
Текущие исследования обнаружили доказательства врожденных, приобретенных и наследственных дефектов артериальной стенки. Несмотря на существование генетических синдромов, сопровождающихся образованием аневризм, большинство из них, скорее всего, развиваются из-за гемодинамических и дегенеративных повреждений сосудистой стенки. Распространенность, рост, наличие тромбов в полостях и даже разрыв аневризм могут быть объяснены с помощью гемодинамической теории.
Менее частыми причинами мешотчатых аневризм являются травма, опухоли, наркотики (кокаин).
Сопутствующие заболевания
Врожденные аномалии интракраниальных сосудов, такие как фенестрация вертебро-базилярного сочленения или наличие персистирующей тройничной артерии сочетаются с повышенной встречаемостью мешотчатых аневризм. Аневризмы в сочетании с фенестрацией были обнаружены как на стороне фенестрации, так и на противоположной.
Васкулопатии, такие как фибромускулярная дисплазия, заболевания соединительной ткани и спонтанная расслойка артерий также сочетаются с повышенным риском образования аневризм.
Заболевания, при которых существует повышенный риск аневризм головного мозга:
Возраст начала заболевания
Аневризмы обычно проявляются симптоматически у людей в возрасте 40-60 лет, с пиком заболеваемости САК (субарахноидальными кровоизлияниями) в возрасте 55-60 лет. У детей внутричерепные аневризмы – редкость и насчитывают не более 2% всех случаев. Аневризмы в педиатрии чаще всего встречаются после травм или перенесенных микозов, и несколько чаще у мальчиков. Аневризмы, обнаруживаемые в детском возрасте также несколько крупнее, чем аневризмы, обнаруживаемые у взрослых, их средний диаметр составляет 17 мм.
Клинические признаки
Большинство аневризм не вызывают клинических симптомов до из разрыва, который сопряжен с высоким риском летального исхода.
Диагностика аневризм
Три основных методики используются, чтобы определить размер, локализацию и морфологию внутричерепных аневризм: компьютерная томография с использованием контрастного вещества (КТ-ангиография), МРТ, и церебральная пункционная ангиография. Предпочтительными методами для скриннинговой диагностики неразорвавшихся аневризм являются МРТ и КТ-агниография, тогда как пункционная ангиография является методом выбора у больных, перенесших САК.
Пункционная ангиография 
Роль церебральной ангиографии у пациентов с нетравматическими САК заключается в идентификации любых аневризм, определении ее взаимоотношений с несущим сосудом и прилежащими артериями, выявлении сосудистого спазма и что более важно, определить, какой вариант лечения наиболее подходит пациенту.
Технически правильно проведенная церебральная ангиография считается важнейшим и наиболее точным методом диагностики САК, однако многие авторы сообщают об успешном использовании КТ-ангиографии.
Компьютерная томография
Аневризмы, достаточно большие по размеру (обычно более 10 мм) или аневризмы, содержащие в своей полости кальцинаты, могут быть визуализированы при проведении бесконтрастной КТ. Во время исследования могут быть обнаружены эрозии костей основания черепа в месте прилежания больших аневризм.
При проведении бесконтрастной КТ типичные нетромбированные аневризмы видны как хорошо ограниченные изоденсные или слегка гиперденсные образования, локализованные в супраселлярном арахноидальном пространстве или в области Сильвиевой щели. Аневризмы хорошо контрастируются после введения контрастного вещества. Изображения сосудов головного мозга, напоминающие ангиографические снимки, могут быть получены при быстром введении контраста с одновременным выполнением тонко-срезовой КТ (так называемая КТ-ангиография). Различные 3D техники обработки изображений позволяют получать достаточно четкие и детальные снимки. Подобные исследования позволяют решать многие задачи, включая детальную оценку взаимоотношения аневризмы и окружающих структур.
Точность КТ ангиографии высокого разрешения в диагностике аневризм диаметром 3 мм и более достигает 97%.
Магнитная резонансная томография (МРТ) 
Аневризмы могут давать сигнал как высокой интенсивности, так и низкой при проведении рутинной МРТ, в зависимости от перечисленных характеристик и используемой пульсовой последовательности. Типичные аневризмы с быстрым кровотоком в них видны как хорошо ограниченные образования, демонстрирующие потерю высокоскоростного сигнала на T1- and T2-взвешенных изображениях. Некоторая гетерогенность сигнала может быть обусловлена наличием турбулентных потоков в полости аневризмы. Внутривенное введение контрастного вещества обычно не приводит к его накоплению в полости аневризм с высокой скоростью кровотока, однако может наблюдаться его накопление в стенках аневризмы.
Макроскопическое движение спинов в движущейся крови одновременно с подавлением сигнала от неподвижных тканей может быть использовано для получения изображения сосудов головного мозга. Эти изображения могут быть оценены индивидуально или в виде МР – ангиограмм.
Лечение аневризм головного мозга
1. Хирургическое клипирование
Задачей хирургического вмешательства обычно является наложение специального клипса на шейку аневризмы для исключения аневризмы из кровотока без окклюзии нормального сосуда. Когда аневризма не может быть клипирована из-за ее особенностей или тяжелого состояния пациента, могут быть произведены следующие альтернативные вмешательства:
Окутывание: несмотря на то, что окутывание никогда не должно быть целью хирургического вмешательства, обстоятельства могут вынудить хирурга прибегнуть к этому методу (например, при фузиформных аневризмах основной артерии). Пластичная резина может быть лучше в этой ситуации, чем мышца или марля. Окутывание может быть проведено с помощью шелка или муслина, с помощью мышцы или с пластиком или другим полимером. Некоторые исследование демонстрируют лучшие результаты при применении пластика, однако другие указывают на отсутствие различий при использовании натуральных тканей.
2. Эндоваскулярное лечение
Методика эндоваскулярного лечения аневризм получила широкое распространение за последние 15 лет. Изначально метод заключался в эмболизации питающего сосуда баллоном. Вскоре процедура была заменена на прямую облитерацию просвета аневризмы сначала отделяемым баллоном, а затем микроспиралями. Отделение обычно происходит через 2-10 минут после удовлетворительной установки катетера в шейке аневризмы.


Эндоваскулярное лечение аневризм (А – схема, В – контрастирующаяся аневризма развилки основной артерии, С – после введения в полость аневризмы 6 спиралей аневризма выключена из кровотока)
Облитерация аневризмы спиралями становится предпочтительной методикой лечения аневризм во многих центрах. Если изначально эмболизация использовалась только для аневризм, недоступных для прямого хирургического вмешательства, то сейчас эта техника применима для большинства аневризм.
Артериовенозные мальформации головного мозга

Частота встречаемости
По мировым данным частота встречаемости АВМ составляет от 0.89 до 1.24 на 100 000 населения в год, согласно сообщениям из Австралии, Швеции и Шотландии. В Шотландии частота встречаемости АВМ достигает 18 на 100 000 населения в год.
В США распространенность АВМ, согласно данным проспективного исследования, составила 1.34 на 100 000 населения в год.
1) Кровоизлияние. В популяционном исследовании 38-70% всех АВМ проявляются кровоизлиянием. Общий риск развития кровоизлияния у пациентов с выявленными АВМ составляет примерно 2-4% в год. Пациенты со свершившимся кровоизлиянием находятся в группе повышенного риска по развитию повторных геморрагий, особенно в течение первого года после первого перенесенного эпизода. Частота геморрагических осложнений прогрессивно растет после первого года от начала заболевания. Клинические и ангиографические признаки, ассоциированные с высоким риском повторных кровоизлияний, включают в себя мужской пол пациента, маленький размер АВМ, локализацию в базальных ганглиях мозга и задней черепной ямке, дренирование в глубокие вены мозга, одна или малое количество дренирующих вен, высокое давление в питающих артериях, измеряемое при ангиографии.
Таблица 1. Риск кровоизлияний из АВМ
РОЛЬ ВИЛЛИЗИЕВА КРУГА ПРИ ОККЛЮЗИИ ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ
РОЛЬ ВИЛЛИЗИЕВА КРУГА ПРИ ОККЛЮЗИИ ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ (клинический случай)
Ласкаржевская М.А., Хомутова Ж.В.,
ООО «Центр Исследования Сосудов», г. Воронеж
Цель: показать роль Виллизиева круга (ВК) при динамическом наблюдении пациента с острой окклюзией внутренней сонной артерии (ВСА).
Материалы и методы: анкетирование пациента (жалобы, анамнез), осмотр методом УЗДГ и УЗДС с ЦДК БЦС и ТКДГ.
Пациент был госпитализирован по скорой помощи с диагнозом: «Транзиторная ишемическая атака в бассейне правой ВСА. Окклюзия левой ВСА». РКТ от 12.11.14 показала картину незначительной выраженной смешанной гидроцефалии. По данным РКТ сосудов головного мозга – данных за наличии аневризм не получино, ВК замкнут. КТ-признаков зон патологического изменения плотности вещества мозга не выявлено. Осмотр нейрохирурга от 21.11.14: больному показана операция ЭИКМА слева. От проведения операции пациент отказался. Проведенное консервативное лечение стабилизировало состояние пациента.
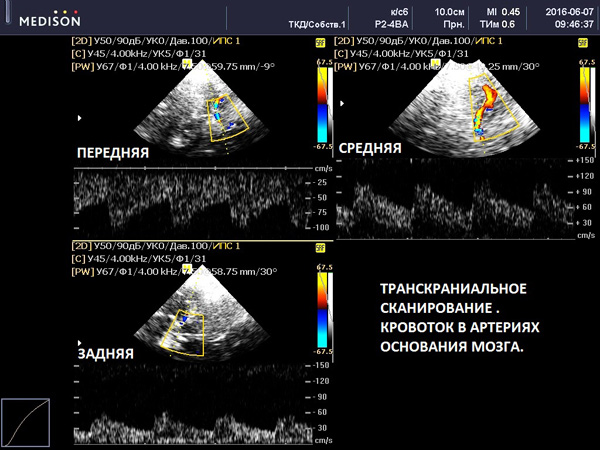
Спустя 16 месяцев на 13.02.16 состояние больного удовлетворительное. При динамическом исследовании отмечались: нормализация направления кровотока по НбА с ЛСК в пределах референсного диапазона, нормализация сЛСК по СМА справа и умеренным снижением слева на фоне норморезистивности (60 см/с и 48 см/с соответственно), КА 25%. По ПА слева отмечалось компенсаторное усиление с ЛСК до 50 см/с, достаточный кровоток справа (35 см/с), КА 43%.
Выводы: Гемодинамический дефицит первично компенсировался преимущественно за счет гомолатеральной НСА, контрлатеральной ВСА через ПСА с последующим адекватным компенсаторным перераспределением кровотока по системе коллатералей и включением заднего отдела ВК. Таким образом, замкнутый ВК с адекватно функционирующей ПСА, сыграл главную роль в компенсации внутримозгового кровообращения, и на фоне адекватного лечения позволил стабилизировать состояние пациента и избежать оперативного вмешательства.
МРТ-признаки аномалий головного мозга у больных приступообразной шизофренией: новые данные с использованием ангиографии
Михайлова Ирина Иосифовна — врач-психиатр, к.м.н., с.н.с., ФГБУ «НЦПЗ» РАМН.
Орлова Вера Александровна — д.м.н., г.н.с. ФГБУ «НЦПЗ» РАМН, Обнинск.
Березовская Татьяна Павловна — д.м.н., ФГБУ «Медицинский радиологический научный центр» Минздрава РФ, Обнинск.
Шавладзе Николай Зурабович — аспирант, ФГБУ «Медицинский радиологический научный центр» Минздрава РФ, Обнинск.
Минутко Виталий Леонидович — д.м.н., профессор, руководитель клиники «Психическое здоровье», Москва.
«Вестник РНЦРР МЗ РФ» N13, 30.03.2013 г.
Введение
Методами прижизненной визуализации мозга накоплены многочисленные данные об аномалиях целого ряда церебральных структур при шизофрении (желудочков мозга, лобной и височной коры, таламуса и др.) [2, 4, 16, 17, 20]. Вместе с тем, вопрос о природе выявляемых изменений остается не вполне ясным и продолжает широко дискутироваться в аспектах концепций шизофрении как нарушения развития мозга, либо текущего нейродегенеративного процесса, взаимосвязей с наследственными и средовыми факторами [4, 5, 13, 14, 15, 18, 19].
Цель исследования
Целью исследования являлось уточнение ряда морфологических аномалий мозга при шизофрении и выявление патогенетических факторов их развития.
Материал и методы исследования
Было проведено исследование больных приступообразной шизофренией методом МРТ с использованием сосудистого режима. Все больные проходили стационарное лечение в клинике «Психическое здоровье» в 2009 – 2011 гг. Клиническая диагностика шизофрении осуществлялась по критериям систематики психических расстройств, принятой в НЦПЗ РАМН и по МКБ-10. Из 62 обследованных больных у 30 (1-я группа) была установлена приступообразно-прогредиентная (шубообразная) форма течения заболевания (F20.01, F20.02) со стабильным или нарастающим дефектом и сохранением остаточных галлюцинаторно-бредовых расстройств в ремиссиях.
У 32 пациентов (2 группа) была выявлена рекуррентная (F20.03) форма с ремиссиями без остаточной психотической симптоматики и дефицитарных расстройств. Возраст больных варьировал от 18 до 58 лет, преобладали пациенты в возрасте от 18 до 39 лет (57 чел.). Средняя продолжительность заболевания от момента его манифестных проявлений в большинстве случаев (47) не превышала 9-ти лет и в 1-ой и 2-ой группах пациентов составляла соответственно 8,9 лет и 4,9 года. 18 пациентов поступили в психиатрический стационар впервые и практически не принимали психотропных средств. 33 человека в межприступные периоды принимали психотропные препараты нерегулярно, а перед поступлением в больницу от их приема отказывались. Синдромальная психопатологическая оценка состояния пациентов 1-й и 2-ой групп на момент обследования отражена в табл. 1. Ни у кого из изученных больных не было выявлено тяжелых соматических заболеваний, органических заболеваний ЦНС, а также алкогольной и наркотической зависимости.
Таблица 1. Характеристика обследованной выборки больных шизофренией.
Формы шизофрении
шубообразная
рекуррентная
Всего
Количество обследованных больных
Распределение по полу
Возрастной диапазон
на момент обследования
Средний возраст на момент обследования
Средняя длительность болезни
Ведущий синдром
Тяжесть состояния в исследованных группах больных шизофренией практически не различалась. При обеих формах больные госпитализировались в связи с быстрым нарастанием психотической симптоматики, достигающим сходной степени выраженности (среднее значение по краткой психиатрической шкале BPRS при приступообразно-прогредиентной форме – 40,5 ± 6,8 баллов, а при рекуррентной – 40,7 ± 6,3 баллов). Межгрупповые различия отмечались лишь в синдромальной структуре психоза: при приступообразно-прогредиентной форме больший, чем при рекуррентной, удельный вес имели кататоно-параноидные и галлюцинаторные расстройства, при сходной выраженности аффективных (табл.1).
МРТ-обследование проводилось на 1,5Т томографе фирмы Siemens (Германия) с использованием сосудистого режима без контраста. Томограммы оценивались опытным нейрорадиологом. Проводился подсчет частоты выявляемых в процессе обследования аномалий состояния желудочков мозга (боковых, 3-го), субарахноидальных пространств, борозд, а также состояния периваскулярных пространств, венозных синусов, включая сигмовидные и поперечные, нарушения венозной циркуляции в целом, аномалии строения артерий. Достоверность межгрупповых различий вычислялась угловым преобразованием Фишера. Межгрупповое различие считалось достоверным при значении Фи расчетного более 1,64.
Результаты исследований и их обсуждение
Анализ томографических изображений выявил какие-либо МРТ-признаки аномалий головного мозга практически у всех больных изученной выборки (таблица 2).
Таблица 2. Частота встречаемости МРТ-признаков аномалий головного мозга в исследованных группах больных шизофренией
Патология, выявляемая МРТ
Форма шизофрении
Число больных
Расширение субарахноидальных пространств:
-лобные и теменные доли
Расширение борозд коры
-лобные и теменные доли
— теменные доли
Патология системы желудочков суммарно
-расширение передних рогов боковых желудочков*
-сужение передних рогов боковых желудочков
-расширение центральной части боковых желудочков*
-расширение нижних рогов боковых желудочков
-расширение задних рогов боковых желудочков*
-расширение 3 желудочка
— асимметрия боковых желудочков
Расширение периваскулярных пространств
-граница теменной и затылочной зоны, белое вещество
-субкортикальное пространство (белое и серое вещество)
-субкортикальное пространство (белое вещество)
-ствол (белое и серое вещество)
Периваскулярные кисты
Очаги дистрофии*
— диффузные в белом веществе полушарий
— белое вещество полушарий
— белое вещество субкортикально и базальные ядра
— белое вещество субкортикально
Аномалии строения артерий*
— задняя трифуркация правой или левой внутренних сонных артерий
— передняя трифуркация правой или левой внутренних сонных артерий
— разомкнутый виллизиев круг
— гипоплазия правой или левой позвоночных артерий
Нарушение циркуляции крови в венах
Патология венозных синусов, отражающая изменение скорости кровотока
-ослабление сигнала поперечных и сигмовидных синусов
-асимметрия сигнала сигмовидных синусов
Асимметрия диаметра артерий
—асимметрия задних соединительных артерий
—асимметрия передних мозговых артерий
Аномалии развития мозга (киста Верги, киста кармана Ратке, mega cisterna magna, «пустое турецкое седло», арахноидальная киста в области вырезки намета мозжечка)
*достоверные различия при межгрупповых сравнениях (значение Фи расчетного более 1,64).
Примечание. Жирным шрифтом выделены названия групп аномалий. Проценты считались от общего количества больных данной диагностической группы. Обычным шрифтом обозначены МРТ-признаки, входящие в данную группу. Проценты считались от общего количества больных, имеющих какой-либо МРТ-признак данной группы.
Из приведенной таблицы видно, что наиболее часто встречающейся патологией у изученных больных шизофренией явились как хорошо известные расширения желудочковой системы мозга(50,8% случаев) и субарахноидальных пространств (57,4 % случаев), отражающие гидроцефалию, так и впервые выявленные в данном исследовании аномалии сосудистой системы, являющиеся более распространенными. Не имели МРТ-признаков сосудистых нарушений лишь 5 человек с рекуррентной формой шизофрении (16,7%), и 7 чел.(22,6%) – с приступообразно-прогредиентной (шубообразной). Отсутствие упомянутых нарушений не зависело от пола, возраста, длительности заболевания и лечения.
Выявленные сосудистые расстройства проявлялись расширением периваскулярных пространств, формированием сосудистых кист, признаками нарушений венозной циркуляции (включая патологию венозных синусов) и врожденными аномалиями строения артерий (преимущественно в виде передней и задней трифуркации внутренних сонных артерий). Полученные данные свидетельствуют о нарушениях ликвородинамики, сопряженной с патологией мозгового кровообращения. Томографическая картина нарушения венозного оттока наряду с расширением периваскулярных пространств и образованием периваскулярных кист свидетельствуют о выраженном в той или иной степени отеке мозговой ткани. Рассматриваемая патология обсуждается как связанная с развитием психопатологической симптоматики различной степени выраженности [11]. С другой стороны, явления своеобразного отека мозга при шизофрении хорошо известны в прозекторской практике [6].
Обращает на себя внимание, что у исследованных больных, наряду со случаями распространенной патологии с диффузным расширением периваскулярных пространств, наблюдались случаи с локализацией данной патологии в области ствола и подкорковых структур, участвующих в формировании системы желудочков мозга, патология которых считается наиболее часто встречающейся при шизофрении. Важной является и выявленная локализация на границе теменной и затылочной зон (37,5 % случаев), имеющая отношение к морфофункциональным «зонам перекрытия», связанным с переработкой информации и интегративной деятельностью мозга. В 21,3% случаев выявлялись очаговые изменения преимущественно в белом веществе подкорковых структур и полушарий. По данным ультрамикроскопических исследований на посмертном материале, поражение белого вещества является характерным для шизофрении [9].
Следует отметить, что в 10% случаев были выявлены аномалии развития мозга (киста Верге, киста кармана Ратке и др. – см. табл. 2), связанные с дисфункциями ствола, мозжечка и гипофиза, а также нарушением ликворо- и гемодинамики в соответствующих областях мозга.
Таким образом, выявленные с использованием МРТ структурные изменения головного мозга отражают как связанные с болезнью дистрофические и дегенеративные процессы нервной ткани, сочетающиеся с нарушениями ликвородинамики и всех компонентов мозгового кровообращения (система коллекторов, крупные сосуды и капиллярная сеть), так и дизонтогенетические стигмы в области основания головного мозга. Эти данные подтверждают результаты наших предшествующих исследований, показавших, что МРТ-признаки аномалий головного мозга при шизофрении носят как связанный с текущим болезненным процессом, так и врожденный характер [2, 4, 5].
Приведенные данные выявляют заметные количественные и качественные межгрупповые различия в частоте встречаемости тех или иных МРТ-признаков аномалий головного мозга в двух исследованных группах больных. В группе больных шубообразной шизофренией в целом МРТ- признаки патологии были более распространены. Такие признаки нейродегенерации, как расширение субарахноидальных пространств, за исключением лобно-теменной области, и расширение борозд коры в указанной группе по сравнению с группой больных рекуррентной шизофренией встречалось чаще (65,5% и 51,6%, 23,3% и 9,7% соответственно), хотя это различие не достигало статистической значимости. Среди аномалий желудочковой системы у этих больных достоверно чаще отмечались расширения передних и задних рогов и центральной части боковых желудочков, что может говорить в пользу большей выраженности дегенеративных процессов в области мозолистого тела, передней спайки и хвостатого ядра – зон, источниками кровоснабжения которых являются ветви внутренних сонных артерий, преимущественно передняя мозговая артерия.
Интересно, что в этой же группе достоверно чаще отмечались случаи трифуркации внутренних сонных артерий (Рис. 1).
Рисунок 1. Больная Б., 20 лет. Задняя трифуркация правой ВСА. МР ангиограмма.
Учитывая, что указанная патология изменяет территорию васкуляризации мозговой ткани и существенно снижает возможность развития сосудистых коллатералей и обеспечение мозга кислородом [8], она может рассматриваться как патогенетический фактор, утяжеляющий течение болезни, и гипотетически как один из факторов риска ее развития.
Значимо чаще, чем в группе больных рекуррентной шизофренией, в указанной группе встречались и нарушения венозной циркуляции, включая патологию венозных синусов, а также расширение периваскулярных пространств и формирование периваскулярных кист.
Таким образом, у больных приступообразной шизофренией (шубообразной, рекуррентной) наряду с редукцией мозговой ткани выявляются достаточно ярко выраженные признаки сосудистой патологии, которая может выступать в качестве патогенетического звена формирования нейродеструктивных процессов. Кроме того, учитывая данные о вкладе генетических факторов в вариабельность МРТ-параметров мозга при шизофрении [4], описанные нарушения могут указывать на наличие единого этиологического фактора, искажающего онтогенез на внутриутробном этапе и способствующего формированию шизофренического процесса.
При рекуррентной форме шизофрении достоверно чаще отмечается расширение периваскулярных пространств в базальных ядрах и наличие очаговых изменений, преимущественно в белом веществе мозга (почти в 1/3 случаев), и недостоверно чаще – связанное с отеком сужение передних рогов боковых желудочков, что отражает обусловленность патологии преимущественно расстройствами микроциркуляции.
Рисунок 2. Больной К., 32 года. Асимметрия тел боковых желудочков. МР томограмма в режиме Т2.
Таблица 3. Частота встречаемости лево- и правосторонних асимметрий МРТ-признаков в исследованных группах больных шизофренией.