Что такое видовая специфичность белков
Что такое видовая специфичность белков
Видовая и тканевая специфичность белков
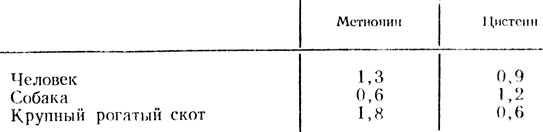
Таблица 2. Содержание метионина и цистеина в гемоглобине в процентах
Различия обнаружены при изучении состава инсулина и ряда других белков. Наряду с этим существуют определенные различия в составе белков в зависимости от возраста. Так, у плода человека в крови обнаружен специфический вид гемоглобина, который называется фетальным. Этот вид гемоглобина после рождения практически исчезает. При изучении его структуры также были выявлены определенные изменения аминокислотного состава по сравнению с гемоглобином взрослого человека.
Эти данные свидетельствуют о том, что структура белка внутри одного вида строится по вполне определенному плану, специфичному именно для представителей данного вида.
Важно отметить, что внутри одного и того же вида имеются и индивидуальные различия в составе белка. Показано, что одни особи обладают только одним видом гемоглобина и β-лактоглобулином молока, у других встречается смесь двух различных видов этих белков. Существуют и наследственные различия в составе белков, что в ряде случаев является причиной тяжелых наследственных заболеваний.
Приведенные примеры касались в основном гемоглобина как наиболее изученного белка, но все сказанное в полной мере относится и к другим белкам.
Параграф 57 белки первичная структура
Автор текста – Анисимова Елена Сергеевна. Авторские права защищены. Продавать текст нельзя.
Курсив можно не зубрить. Замечания можно присылать по почте: exam_bch@mail.ru
ПАРАГРАФ 57:
«Белки: первичная структура».
57.1. Белки: первичная структура.
Аминокислотные остатки (аминоацилы; это аминокислоты без ОН атомов карбоксильных групп около ;-углеродного атома) способны соединяться пептидными связями, образуя полимеры и олигомеры.
Соединение из менее сотни аминоацилов считается пептидом, а из более сотни – белком. Но это условно – например, инсулин, состоящий из 51 аминоацила, формально является пептидом, а по сути – молекулой белка. По другим данным, более 40 аминоацилов – это уже белок, а не полипептид.
Таким образом, белок – это полимер, состоящий из аминоацилов (в качестве мономеров), соединённых пептидными связями. Умейте писать формулы пептидов и соединять аминоацилы пептидными связями!!
Очень важно, в каком порядке какие аминокислоты соединены. – Замена единственной аминокислоты или другое расположение аминокислот дают уже совсем другой белок.
То, в каком порядке какие аминокислотные остатки соединены (пептидными связями) – это и есть ПЕРВИЧНАЯ СТРУКТУРА белка.
Определение. Первичная структура белка – это цепочка аминокислотных остатков (аминоацилов), соединённых пептидными связями и расположенных в строго определённом порядке. Часто эту цепочку аминоацилов называют полипептидной цепью.
57.2. Видовая специфичность белков.
Белок организма определённого биологического вида живых организмов характерен только для данного вида, то их есть специфичен для него. У других видов могут быть похожие по строению и функциям белки, но их аминокислотные последовательности (первичные структуры) всё же отличаются от аминокислотных последовательностей похожих белков других видов.
Есть белки, которые отличаются и внутри вида. Например, белки главного комплекса гистосовместимости у всех людей разные (одинаковые только у однояйцевых близнецов).
Причина того, что у разных видов и особей белки разные – то, что у всех разные гены, от которых и зависит, какие белки есть у данного организма.
57.3. Первичные (наследственные) протеинопатии и их лечение.
Определение. –патия – это болезнь, протеин – это белок, протеинопатия – это болезнь, связанная с дефектом белка.
Первичная протеинопатия – это болезнь, связанная с ДЕФЕКТОМ белка, причиной которого является изменение гена (мутация).
Наследственными первичные протеинопатии называются потому, что могут передаваться потомкам «в наследство».
Не путать с врождёнными болезнями – ребёнок может родиться с патологией не из-за плохих генов, а из-за повреждений во время эмбриогенеза.
Дефект белка отводит к болезни потому, что приводит или к повышенной активности белка (как при подагре или конститутивных рецепторах), или к сниженной активности белка (как при гемофилии и др.).
ПРИМЕРЫ
первичных протеинопатий – это многие известные Вам примеры наследственных, генетических болезней. – Гемофилия, серповидно-клеточная анемия, фенилкетонурия (точнее, фенил/пировиноградная олигофрения), синдром Леша-Нихана, синдром врождённого комбинированного иммунодефицита (СВИД), гликогеноз и агликогеноз, альбинизм, первичные энзимопатии (см. п.8 о первичных энзимопатиях), болезни из-за конститутивных рецепторов, подагра и т.д.
Для ЛЕЧЕНИЯ
первичных протеинопатий нужно исправлять гены, то есть нужна генотерапия. Этот метод лечения применён при СВИДе. Но метод дорог и пока редко применяется, а для многих болезней не разработаны методики.
В некоторых случаях предотвратить развитие симптомов болезни (последствий дефекта белка) можно без генотерапии – например, при фенилкутонурии развитие слабоумия можно предотвратить, убрав из пищи новорожденного фенилаланин (субстрат фермента, у которого снижена активность).
При дефиците лактазы из питания убирают молоко (лактОзу), при дефиците сахарАзы – сахарОзу.
При альбинизме повреждение кожи ультрафиолетом предотвращают, закрывая кожу от солнца.
При гликогенозах и агликогенозах нужно более частое питание.
При протеинопатиях, связанных с повышенной активностью белков, лечить можно с помощью веществ, которые подавляют активность этих белков (они называются ингибиторами или блокаторами – например, ингибиторы тирозинкиназы при биологический терапии онкологических заболеваний).
Низкую активность ферментов иногда можно скорректировать с помощью назначения повышенных количеств субстратов этих ферментов – тогда образуется нужно количество продуктов ферментов.
Тяжесть проявлений протеинопатии зависит от того, какая мутация в гене, кодирующем белок.
Некоторые мутации не сильно меняют активность белка, а некоторые сильно меняют.
Тяжёлые протеинопатии приводят к ярко выраженным наследственным заболеваниям. Менее тяжёлые – к предрасположенности человека к определённым заболеваниям.
Чем качественнее белки организма – тем меньше болезней, лучше самочувствие, дольше продолжительность жизни, лучше иммунитет, интеллект и т.д.
Многие лекарств лечат именно потому, что меняют активность белков – или снижают избыточную (ингибиторы и блокаторы), или повышают недостаточную.
57.4. Биологические функции белков. См. также п.89.
1. ФЕРМЕНТАТИВНАЯ:
белки являются основными катализаторами химических реакций. Такие белки, осуществляющие катализ, называются ферментами и энзимами. Например, пепсин, амилАЗА, липАЗА и т.д.
Кроме белков, катализировать реакции способны некоторые РНК, которые называют рибозимами.
3. ЗАЩИТНАЯ:
1 – АНТИТЕЛА участвуют в защите организма ОТ ИНФЕКЦИЙ (распознают антигены),
2 – белки свёртывающей системы крови (например, фибриноген) защищают ОТ КРОВОПОТЕРИ при повреждении сосудов,
3 – белки противосвёртывающей системы защищают от тромбов,
4 – белковые компоненты протеогликанов обеспечивают механическую защиту клеток.
4. ТРАНСПОРТНАЯ:
1 – транспорт ряда веществ в крови осуществляется с помощью белков-переносчиков (транспортёров);
например, альбумин переносит жирные кислоты, ионы кальция и водорода (связывает часть ионов кальция и водорода), некоторые лекарства,
трансферрин переносит железо, церулоплазмин переносит медь,
белки в составе липопротеинов участвуют в переносе жира и холестерина,
специальные белки переносят ряд витаминов и гормонов (гидрофобных – стероидных, йодтиронинов) и т.д.
2 – транспорт КИСЛОРОДА от лёгких в ткани осуществляется эритроцитами с помощью ГЕМОГЛОБИНА,
3 – транспорт многих веществ через мембраны осуществляется специальными белками-переносчиками;
есть переносчики для ионов натрия, калия, кальция, для глюкозы и аминокислот и т.д.
5. СТРУКТУРНАЯ:
1 – белки образуют, формируют межклеточное вещество (основные – коллаген, эластин),
2 – белки вместе с липидами образуют мембраны клеток,
3 – белки входят в состав рибосом и цитоскелета.
6. СОКРАТИТЕЛЬНАЯ (двигательная):
белки обеспечивают сокращение мышц, изменение формы клетки или её органелл, подвижность клеток (лейкоцитов, например) и ресничек; примеры – актин, МИОЗИН, тубулин,
сокращение белков цитоскелета обеспечивает расхождение хромосом при митозе, транспорт везикул внутри клетки; движение обеспечивается сократительными белками.
7. ЗАПАСАЮЩАЯ (РЕЗЕРВНАЯ) –
белки могут использоваться в качестве резерва питательных веществ; у человека это белки мышц, печени, крови; казеин молока матери – резерв питательных веществ для младенца.
8. Другие: буферная, создание онкотического давления, поставка аминокислот для синтеза других БАВ, реализация генетической информации и т.д.
57.5. СОСТАВ БЕЛКОВ. См. параграф 4.
Есть белки, в состав которых входит только ППЦ (или несколько ППЦ при четвертичной структуре) – такие белки называются ПРОСТЫМИ.
Есть белки, в состав которых которых, кроме ППЦ, входят другие вещества (небелковой природы)– такие белки называют СЛОЖНЫМИ.
Небелковые компоненты сложных белков называются КОФАКТОРАМИ, а белковые компоненты (ППЦ) сложных белков называются АПОБЕЛКАМИ.
Комплекс апобелка и кофактора называется холобелком.
Типы кофакторов.
Соединения белков с углеводами называются ГЛИКОпротеинами, с липидами – ЛИПОпротеинами, с нуклеиновыми кислотами – НУКЛЕОпротеинами (примеры – хромосомы, рибосомы, сплайсосомы), с фосфатом – ФОСФОпротеинами, с металлами – МЕТАЛЛОпротеинами и т.д.
57.5 КЛАССИФИКАЦИИ белков.
По типу третичной структуры: глобулярные и фибриллярные, см. п.58.
По функциям: ферментативные, транспортные, структурные, защитные, сократительные, рецепторные и т.д. – см. 57.4.
По составу (простые и сложные) и по типу кофактора: см. 57.5.
Мир психологии
психология для всех и каждого
Обмен веществ и энергии в организме. Часть 3.
Обмен белков.
Строение и значение белков.
Белки определяют видовые и индивидуальные различия организмов. Они необходимы для осуществления защитных функций. Белкам присуща и энергетическая функция, так как их распад сопровождается освобождением энергии.
Молекулярная масса белков очень велика и колеблется в широких пределах: от нескольких тысяч до нескольких миллионов единиц. Форма молекул простых белков чаще всего приближается к сферической. Различают первичную, вторичную, третичную и четвертичную структуры молекулы белков. Под первичной структурой понимают последовательность аминокислот в белке. Двадцать встречающихся в живом организме аминокислот могут многократно повторяться, сочетаясь в различной последовательности, что обусловливает существование большого количества различных белков.
Аминокислоты связаны в белках посредством пептидных связей. При неполном расщеплении белка образуются соединения, состоящие из меньшего, чем белки, числа аминокислот и называемые полипептидами и пептидами. Полипептиды содержат большее число аминокислотных остатков по сравнению с пептидами. В настоящее время для нескольких десятков белков установлена последовательность расположения в них аминокислот.
Полипептидные цепи в молекуле белков не вытянуты, а свернуты в спираль, образуя вторичную структуру белка. Определенное расположение полипептидных цепей молекулы белков в пространстве называют ее третичной структурой.
Установлено, что молекула белков состоит из отдельных субъединиц. Их пространственное расположение определяет ее четвертичную структуру.
Специфичность белков.
При наличии такой сложной структуры, какой обладают белковые молекулы, возможно бесчисленное множество вариаций их строения. Отличия могут наблюдаться в одной, в нескольких или во всех структурах белковой молекулы (от первичной до четвертичной). Наличием огромного числа различных видов белков, отличающихся по своему строению, определяется их видовая, индивидуальная и органная специфичность. Видовая специфичность проявляется в том, что структура белков животных, относящихся к разным видам, неодинакова. Отличается также, хотя и в меньшей степени, структура белков отдельных индивидуумов, относящихся к одному и тому же виду. При введении в организм чужеродного белка возникают различные иммунные реакции, направленные на его удаление. Это служит серьезным препятствием для пересадки органов и тканей и может служить причиной возникновения тяжелых нарушений в организме пр переливании несовместимых групп крови, при искусственной иммунизации.
Органная специфичность белков характеризуется тем, что беки одного и того же организма, но разных органов различны по структуре, а следовательно, и свойствам.
Все виды специфичности белков сохраняются на протяжении всей жизни организма. Это возможно благодаря тому, что наряду с постоянным расходованием запасов белков происходит их синтез, причем каждая клетка синтезирует только определенные виды белков.
Азотистое равновесие.
О количестве белка, получаемого с пищей или выделяемого из организма, можно судить по количеству потребленного или выделенного азота. Из питательных веществ только белки содержат азот. Известно, что его количество в белке составляет 16%. Отсюда легко вычислить, что 1 г азота содержится в 6,25 г белка (100:16). Отсюда, зная количество выделенного или потребленного азота, легко рассчитать соответствующее количество белка.
Понятие «азотистый баланс» означает разницу в количестве азота, введенного в организм с пищей и выведенного с мочой, калом и потом. Для здорового взрослого человека характерно азотистое равновесие, при котором азотистый баланс равен 0, т.е. выводится азота столько же, сколько его поступает с пищей. Когда из организма выводится азота меньше, чем поступает, говорят о положительном азотистом балансе. Это всегда наблюдается у беременных и в растущем организме.
В некоторых случаях, как например, при голодании, количество выводимого азота превышает количество поступающего. В этом случае в организме имеет место отрицательный азотистый баланс.
Биологическая ценность белков.
Особенно ценны для организма те аминокислоты, которые не образуются в животном организме. Таким аминокислот 10. Их называют незаменимыми (метионин, лизин, триптофан и др.). 10 аминокислот являются заменимыми, так как могут синтезироваться в организме. Каждая из аминокислот несет в организме специфическую функцию, и поэтому недостаток поступления ее может вызвать те или иные расстройства его деятельности. Например, при недостатке валина отмечается расстройство функций нервной системы.
Превращения белков в организме.
В живом организме постоянно происходят синтез и распад белков. Синтез белка осуществляется при участии аминокислот, имеющих разное происхождение. Необходимым постоянным источником аминокислот являются белки пищи. В пищеварительном тракте они подвергаются распаду до аминокислот, которые всасываются в кровь. Пройдя через сосуды печени, аминокислоты приносятся ко всем органам, в клетках которых вновь синтезируется белок, но уже специфичный для каждого из них. Для синтеза белка используются также аминокислоты, пептиды и нуклеотидпептиды, образующиеся в процессе распада клеточных белков. Нуклеотидпептидом называют продукт неполного распада белка, состоящий из пептидов и нуклеотидной группировки. Для синтеза белка используются также аминокислоты, которые синтезируются в организме. В организме из продуктов распада белков одного вида могут синтезироваться белки другого вида.
Конечными продуктами обмена нуклеопротеидов являются мочевина, мочевая кислота, углекислых газ и вода.
Наследственные протеинопатии: серповидно-клеточная анемия, другие примеры
Первичная структура белков.
Аминокислоты – амфотерные соединения, соединяющиеся друг с другом в молекуле белка с помощью пептидных связей.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей
по отношению друг к другу пептидные группы располагаются под углом.
Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка
Видовая специфичность белков
Индивидуальность белковых молекул определяется порядком чередования АК в белке. Однако многие белки, выполняя одну и ту же функцию, несколько отличаются по строению у разных представителей одного и того же вида. Примером могут служить белки групп крови у человека. Такое разнообразие белков обусловливает индивидуальную специфичность организмов.
Наследственные изменения первичной структуры. Полиморфизм белков
первичная структура белков, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению структуры синтезируемого белка. Если изменение последовательности аАКносит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. это полиморфизм белков. примерами полиморфизма : гемоглобин человека( эмбриональный, фетальный, и А гемоглобин взрослого человека
Наследственные протеинопатии: серповидно-клеточная анемия, другие примеры.
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате,а значит и в белках
анемию с обнаружением в его крови, похожих на полумесяц, эритроцитов. Заболевание получило название «серповидно-клеточной анемии, оно вызвано изменением первичной структуры НЬА.
В молекуле гемоглобина S мутантными оказались 2 β-цепи, в которых глутамат, в положении 6 была заменена валином, содержащим гидрофобный радикал. «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию.
2. Конформация белковых молекул (вторичная и третичная структуры)
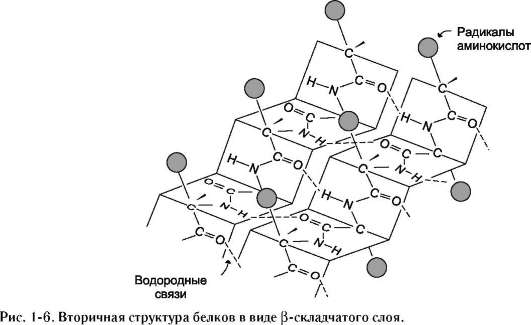
Вторичная структурабелка – это способ укладки полипептидной цепи, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. 
α-Спираль является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп.
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя (
Мир психологии
психология для всех и каждого
Обмен веществ и энергии в организме. Часть 3.
Обмен белков.
Строение и значение белков.
Белки определяют видовые и индивидуальные различия организмов. Они необходимы для осуществления защитных функций. Белкам присуща и энергетическая функция, так как их распад сопровождается освобождением энергии.
Молекулярная масса белков очень велика и колеблется в широких пределах: от нескольких тысяч до нескольких миллионов единиц. Форма молекул простых белков чаще всего приближается к сферической. Различают первичную, вторичную, третичную и четвертичную структуры молекулы белков. Под первичной структурой понимают последовательность аминокислот в белке. Двадцать встречающихся в живом организме аминокислот могут многократно повторяться, сочетаясь в различной последовательности, что обусловливает существование большого количества различных белков.
Аминокислоты связаны в белках посредством пептидных связей. При неполном расщеплении белка образуются соединения, состоящие из меньшего, чем белки, числа аминокислот и называемые полипептидами и пептидами. Полипептиды содержат большее число аминокислотных остатков по сравнению с пептидами. В настоящее время для нескольких десятков белков установлена последовательность расположения в них аминокислот.
Полипептидные цепи в молекуле белков не вытянуты, а свернуты в спираль, образуя вторичную структуру белка. Определенное расположение полипептидных цепей молекулы белков в пространстве называют ее третичной структурой.
Установлено, что молекула белков состоит из отдельных субъединиц. Их пространственное расположение определяет ее четвертичную структуру.
Специфичность белков.
При наличии такой сложной структуры, какой обладают белковые молекулы, возможно бесчисленное множество вариаций их строения. Отличия могут наблюдаться в одной, в нескольких или во всех структурах белковой молекулы (от первичной до четвертичной). Наличием огромного числа различных видов белков, отличающихся по своему строению, определяется их видовая, индивидуальная и органная специфичность. Видовая специфичность проявляется в том, что структура белков животных, относящихся к разным видам, неодинакова. Отличается также, хотя и в меньшей степени, структура белков отдельных индивидуумов, относящихся к одному и тому же виду. При введении в организм чужеродного белка возникают различные иммунные реакции, направленные на его удаление. Это служит серьезным препятствием для пересадки органов и тканей и может служить причиной возникновения тяжелых нарушений в организме пр переливании несовместимых групп крови, при искусственной иммунизации.
Органная специфичность белков характеризуется тем, что беки одного и того же организма, но разных органов различны по структуре, а следовательно, и свойствам.
Все виды специфичности белков сохраняются на протяжении всей жизни организма. Это возможно благодаря тому, что наряду с постоянным расходованием запасов белков происходит их синтез, причем каждая клетка синтезирует только определенные виды белков.
Азотистое равновесие.
О количестве белка, получаемого с пищей или выделяемого из организма, можно судить по количеству потребленного или выделенного азота. Из питательных веществ только белки содержат азот. Известно, что его количество в белке составляет 16%. Отсюда легко вычислить, что 1 г азота содержится в 6,25 г белка (100:16). Отсюда, зная количество выделенного или потребленного азота, легко рассчитать соответствующее количество белка.
Понятие «азотистый баланс» означает разницу в количестве азота, введенного в организм с пищей и выведенного с мочой, калом и потом. Для здорового взрослого человека характерно азотистое равновесие, при котором азотистый баланс равен 0, т.е. выводится азота столько же, сколько его поступает с пищей. Когда из организма выводится азота меньше, чем поступает, говорят о положительном азотистом балансе. Это всегда наблюдается у беременных и в растущем организме.
В некоторых случаях, как например, при голодании, количество выводимого азота превышает количество поступающего. В этом случае в организме имеет место отрицательный азотистый баланс.
Биологическая ценность белков.
Особенно ценны для организма те аминокислоты, которые не образуются в животном организме. Таким аминокислот 10. Их называют незаменимыми (метионин, лизин, триптофан и др.). 10 аминокислот являются заменимыми, так как могут синтезироваться в организме. Каждая из аминокислот несет в организме специфическую функцию, и поэтому недостаток поступления ее может вызвать те или иные расстройства его деятельности. Например, при недостатке валина отмечается расстройство функций нервной системы.
Превращения белков в организме.
В живом организме постоянно происходят синтез и распад белков. Синтез белка осуществляется при участии аминокислот, имеющих разное происхождение. Необходимым постоянным источником аминокислот являются белки пищи. В пищеварительном тракте они подвергаются распаду до аминокислот, которые всасываются в кровь. Пройдя через сосуды печени, аминокислоты приносятся ко всем органам, в клетках которых вновь синтезируется белок, но уже специфичный для каждого из них. Для синтеза белка используются также аминокислоты, пептиды и нуклеотидпептиды, образующиеся в процессе распада клеточных белков. Нуклеотидпептидом называют продукт неполного распада белка, состоящий из пептидов и нуклеотидной группировки. Для синтеза белка используются также аминокислоты, которые синтезируются в организме. В организме из продуктов распада белков одного вида могут синтезироваться белки другого вида.
Конечными продуктами обмена нуклеопротеидов являются мочевина, мочевая кислота, углекислых газ и вода.