Что такое валентные электроны в химии 8 класс
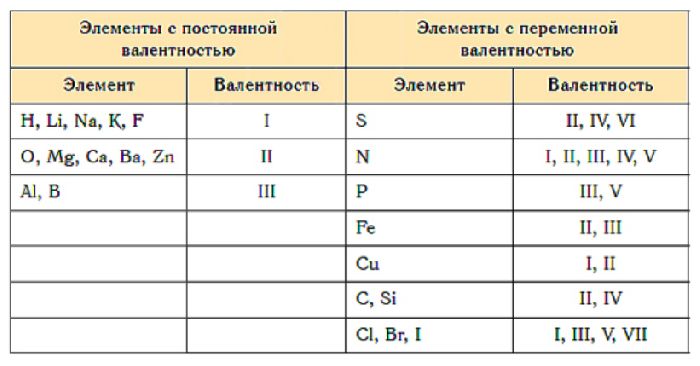
Таблица валентности химических элементов

Всего получено оценок: 656.
Всего получено оценок: 656.
Валентность простых веществ можно определить по таблице Менделеева или таблице валентности химических элементов. Что такое валентность и как определить валентность элемента – на эти вопросы отвечает наша статья.
Что такое валентность
Валентность – способность атома элемента образовывать связь с другими атомами за счёт электронов, находящихся на внешнем энергетическом уровне.
Любой элемент состоит из атома, в центре которого находится положительно заряженное ядро. Заряд ядра соответствует порядковому номеру элемента в периодической таблице. Он всегда положителен, так как количество протонов превышает количество нейтронов.
Вокруг ядра движутся на разном расстоянии от ядра отрицательно заряженные электроны. Их количество также соответствует порядковому номеру элемента. Самый последний уровень занимают валентные электроны. Из-за большого расстояния от ядра они теряют с ним связь и легко спариваются с внешними электронами другого атома. За счёт образовавшейся ковалентной связи формируется новое вещество, состоящее из нескольких атомов.
Количество электронов на внешнем уровне определяет валентность элемента и, соответственно, количество возможных химических связей.
Валентность элементов
Все элементы можно разделить на три группы:
Постоянная валентность химических элементов не меняется:
Переменная валентность характерна остальным элементам. Атомы этих элементов содержат d-подуровень, который может принимать электроны с s- и p-подуровней. В результате спаренные электроны распариваются и образуют дополнительные связи. Один элемент может проявлять I-VII валентности.
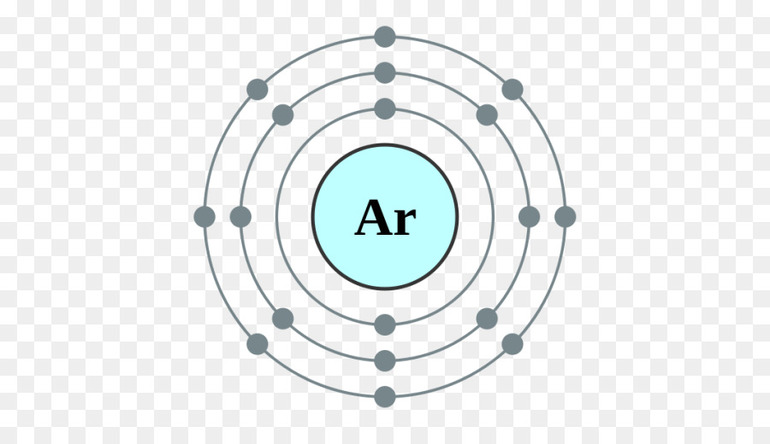
Так называемую нулевую валентность имеют инертные или благородные газы. На внешнем энергетическом уровне могут содержать до восьми электронов. Однако эти элементы химически неактивны и не образуют связи с другими атомами.
Валентность показывает, сколько атомов элементов находится в веществе. Индексы элементов высчитываются как кратное валентностей, поочерёдно поделённое на значение валентности элементов. Например, валентность Na – I, O – II, общее кратное – 2 (1 ∙ 2). Поделив 2 сначала на I, затем на II, получаем формулу соединения Na2O.
Как определить
Запоминать валентность каждого элемента необязательно. Достаточно посмотреть в таблицу Менделеева или использовать специальную таблицу валентности. В периодической таблице высшей валентности соответствует номер группы. Низшую валентность можно узнать, отняв от восьми номер группы.
Однако могут быть исключения. Например, кремний находится в IV группе, его высшая валентность – IV. Воспользовавшись формулой вычисления высшей валентности, можно прийти к выводу, что низшей валентности у кремния нет, она всегда равна IV. Однако это не так. Низшая валентность кремния – II. Другой пример: высшая валентность азота – V. Но элемент эту валентность проявляет редко, гораздо чаще – II и III.
По формуле вещества можно определить переменную валентность одного из элементов. Для этого известную (постоянную) валентность одного элемента умножают на соответствующий ему индекс. Получившееся число делят на индекс определяемого элемента. Например, вычисление валентности фосфора в соединении P2O5: 2 ∙ 5 / 2 = 5 (V).
Что мы узнали?
Из урока 8 класса узнали, что такое валентность элементов. Выяснить значение валентности можно из периодической (соответствует номеру группы) или специальной таблицы валентности. Большинство элементов проявляет переменную валентность, которая обуславливается наличием в атомах таких элементов d-подуровня. Постоянную валентность имеют металл I-II групп, кислород, фтор, алюминий. Знать валентность необходимо для составления формул сложных веществ.
Урок 5 Бесплатно Валентность. Степень окисления. Количество вещества
Валентность
Атомы соединяются в молекулы в определенных соотношениях.
Приведем пример широко распространённых соединений водорода.
Это связано с количеством электронов на внешнем электронном уровне атома (подробнее про электронные уровни в одном из следующих уроков).
Эти электроны часто называют валентными электронами.
Это значение легко узнать из периодической системы химических элементов: число валентных электронов равно номеру группы, в которой находится химический элемент.
Элементы третьего периода системы химических элементов
Номер группы и число валентных электронов обозначены цифрой в центре клетки.
Суть химического взаимодействия между двумя атомами состоит в том, чтобы в итоге внешний электронный уровень атома оказался полностью завершенным.
Такое положение похоже на состояние атомов VIII группы – инертных газов (гелий, неон, аргон, криптон, ксенон).
Атомы этих элементов «самодостаточны», т.е. «не желают» вступать в химические реакции.
Поэтому их ещё называют благородными.
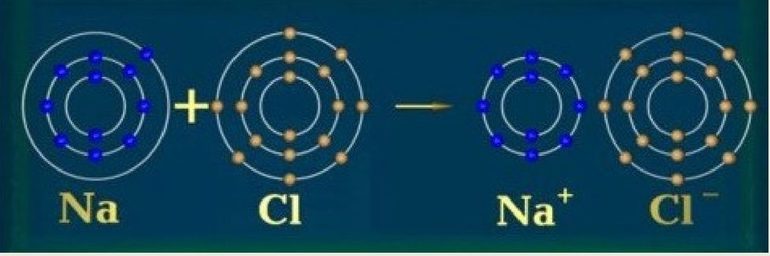
Чтобы получить полностью завершенную внешнюю электронную оболочку, атомы объединяются в таких соотношениях, что получают друг от друга необходимое количество электронов.
Недостающие электроны, которые атом как бы «получает» или «отдаёт», в составе молекулы для обоих атомов являются общими.
То количество электронов, которое атом получает или отдаёт в процессе химической реакции, а следовательно, количество других атомов, которые способен присоединить наш атом, и называется валентностью этого атома.
У некоторых элементов валентность постоянная, но у большинства есть по несколько значений валентности.
Один и тот же элемент в разных соединениях проявляет разную валентность.
Элементов, валентность которых всегда постоянна, немного, и их нужно просто запомнить.
Химический элемент
или группа элементов
Валентность
Литий, натрий, калий, рубидий, цезий (все щелочные металлы);
Водород, фтор, серебро
Бериллий, магний, кальций, стронций, барий (все щелочно-земельные металлы);
Бор, алюминий, галлий
Углерод, кремний, германий
Атомы проявляют валентность только в химических соединениях!
Пройти тест и получить оценку можно после входа или регистрации
Степень окисления
Валентность показывает, сколько электронов «отдал» или «приобрел» атом, но не показывает, отдал атом эти электроны или приобрёл.
Разные элементы обладают разной степенью активности, и в зависимости от этого при реакциях электроны, хотя и являются общими для двух атомов, являются как бы «сдвинутыми» в сторону какого-то одного из них.
Степень окисления – это условный заряд атома в составе молекулы, если предположить, что принятый электрон полностью принадлежит атому, а отданный полностью не принадлежит.
Рассмотрим степени окисления атомов азотной кислоты HNO3
Известно, что в химических формулах количество атомов в 1 единицу не пишут, но для наглядности мы это сделаем. Получилось H1N1O3
Азотная кислота в природе существует в виде устойчивого соединения, это значит, что сумма всех степеней окисления составляющих ее атомов равна нулю.
Азотная кислота состоит из 1 атома водорода, 1 атома азота и 3-х атомов кислорода.
Водород имеет степень окисления +1
Посмотрим на алгоритм определения степени окисления:
Вам придется часто определять степени окисления веществ в составе молекул.
Это просто. Главное надо знать степени окисления атомов, там, где вариантов немного или всего один.
Зная, что сумма всех произведений степеней окисления в одной молекуле равна нулю, мы сможем очень легко определить неизвестную степень окисления.
Рассмотрим алгоритм определения степени окисления азота в молекуле азотистой кислоты.
Часто степень окисления и валентность совпадают. Но это происходит не всегда. Наиболее ярко это различие проявляется в простых веществах, образованных некоторыми газами, но также проявляется и в других соединениях.
Химический элемент
Вещество
Валентность
Степень окисления
HNO3 (азотная кислота)
Главное отличие степени окисления от валентности: валентность не имеет знака, а степень окисления имеет знак.
Положительное число говорит об отдаче электрона (т.к. заряд электрона отрицательный), отрицательное – наоборот.
Высшая положительная степень окисления элемента равна номеру группы периодической системы.
Химический элемент
Номер группы в периодической системе
Высшая положительная степень окисления
Натрий
Магний
Алюминий
Кремний
Фосфор
Сера
Хлор
Большинство элементов имеют переменную степень окисления.
Например, марганец имеет степень окисления в разных его соединениях +2, +3, +4, +6, +7
В природе элементы встречаются в таких соединениях, где проявляют самую устойчивую степень окисления.
Химический элемент
Наиболее распространенное в природе вещество и степень окисления элемента в нём
Другие вещества и степени окисления элемента в них
Кварц (оксид кремния)
Пирит (сульфид железа)
Cоль (хлорид натрия)
NaCl
Пройти тест и получить оценку можно после входа или регистрации
Количество вещества
До этого речь шла об отдельных атомах и молекулах.
Но химики не работают с индивидуальными молекулами.
Например, формула поваренной соли NaCl. Содержание атомов натрия и хлора в этом веществе относятся как 1:1.
Значит ли это, что для получения соли нужно взять равные массы натрия и хлора?
Нет, потому что у этих атомов разные массы, а значит, в одном килограмме натрия и в одном килограмме хлора будет содержаться разное количество молекул.
Поэтому химики измеряют количество вещества в таких единицах, которые обозначают не массу, а количество молекул (или атомов – в тех случаях, когда речь идет о простых веществах, молекулы которых одноатомны).
Такое количество вещества химики назвали «моль» (от слова «молекула»).
Для простоты обозначений химики постановили, что моль – это количество вещества, содержащее такое число молекул, которое совпадает с числом атомов в 12 г углерода.
1 моль любого вещества имеет такую массу, которая численно равна молекулярной массе данного вещества, выраженной в атомных единицах массы. Например, относительная атомная масса меди равна 64, значит, 1 моль меди имеет массу 64 грамма. Масса вещества, взятого в количестве 1 моль, называется молярной массой и выражается единицами г/моль. Молярная масса меди равна 64 г/моль.
Из этого следует важный вывод: 1 моль любого вещества содержит одно и то же число молекул, хотя и имеет для разных веществ разную массу.
В математическом виде это обозначается так:
Таким образом, независимо от того, сколько весит вещество, 1 его моль будет содержать всегда одинаковое количество атомов, равное 6,022 · 10 23 единиц.
У меня есть дополнительная информация к этой части урока!
С именем Амедео Авогадро (1776-1856) также связан Закон Авогадро, который в определенной степени перекликается с постоянной Авогадро, но только касается газов. Авогадро предположил, что все газы при одинаковых условиях (температура и давление) в равных объемах содержат одинаковое количество молекул. Свои выводы он аргументировал тем, что молекулы газов находятся на значительном расстоянии друг от друга, поэтому их масса не играет значения в количестве самих молекул в единице объема.
1. один моль любого газа при равных условиях (температура и давление) занимает один и тот же объем.
2. один моль любого газа при нормальных условиях (t=0°С и давлении 10 5 Па= 100 кПа= 1 бар= 1 атмосфера) занимает один и тот же объем, равный 22,41 литрам (м 3 )
Величина 22,41 л/моль (22,41 м 3 /моль) называется моляным объемом газа и обозначается Vm
Закон Авогадро можно изучить на нашем уроке «Понятие о газах».
Зная количество вещества, можно судить о числе частиц в определенной его порции и брать вещества для реакций в необходимых количествах.
На картинках ниже вы увидите, какой объем занимает одинаковое количество разных веществ, равных одной моли.
Пройти тест и получить оценку можно после входа или регистрации
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
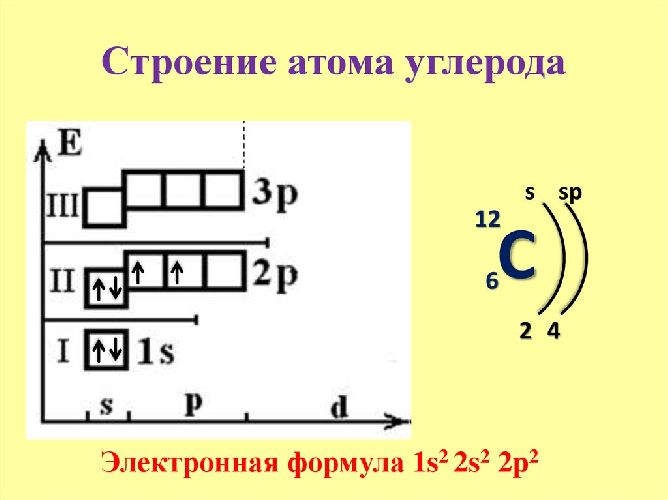
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
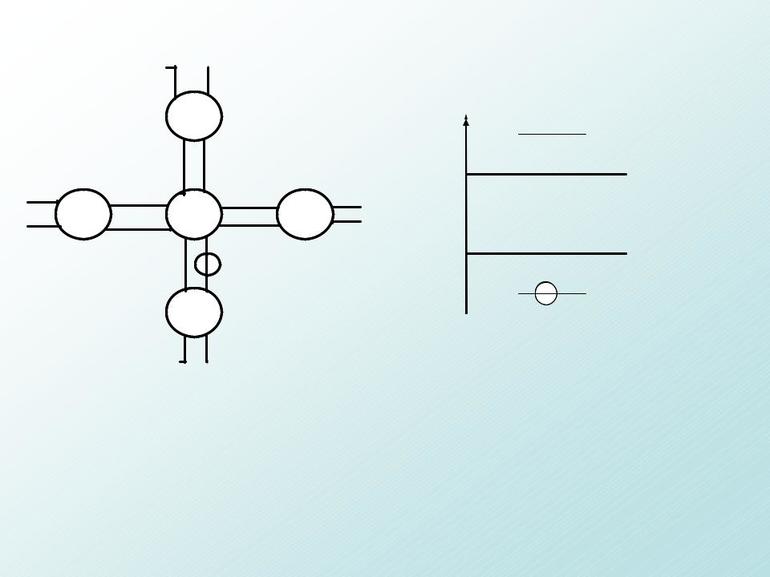
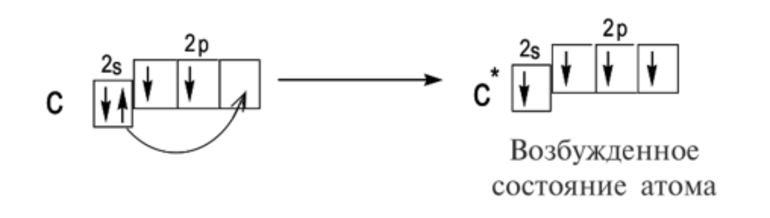
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
Согласно Льюису, ковалентная связь приводит к октетам при совместном использовании электронов, а ионная связь — при передаче электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмюру. Префикс ко— означает «вместе», то есть атомы разделяют валентность. Поэтому определение валентности по формуле соединения стало возможным.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp 3 d 2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).
Виды с одним зарядом являются одновалентными. Например, Cs + — одновалентный катион, тогда как Ca 2+ является двухвалентным, а Fe 3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.
Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
| Группа | ВЭ |
|---|---|
| 1 (I) (щелочные металлы) | 1 |
| 2 (II) (щёлочноземельные металлы) | 2 |
| 3−12 (переходные металлы) | 3−12 |
| 13 (III) (борная группа) | 3 |
| 14 (IV) (углеродная) | 4 |
| 15 (V) (группа азота) | 5 |
| 16 (VI) (кислородная группа) | 6 |
| 17 (VII) (галогены) | 7 |
| 18 (VIII или 0) (благородные газы) | 8 |
Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Химические реакции
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg 2+ ), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Вне аргоноподобного ядра, возможно, есть семь валентных электронов (4s 2 3d 5 ), это вполне согласуется с тем фактом, что, например, степень окисления марганца может достигать +7 (в перманганатном ионе MnO — 4).
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s 2 3d 8 ), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Электрическая проводимость
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.
Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.