Что такое валентность и ковалентность
Валентность
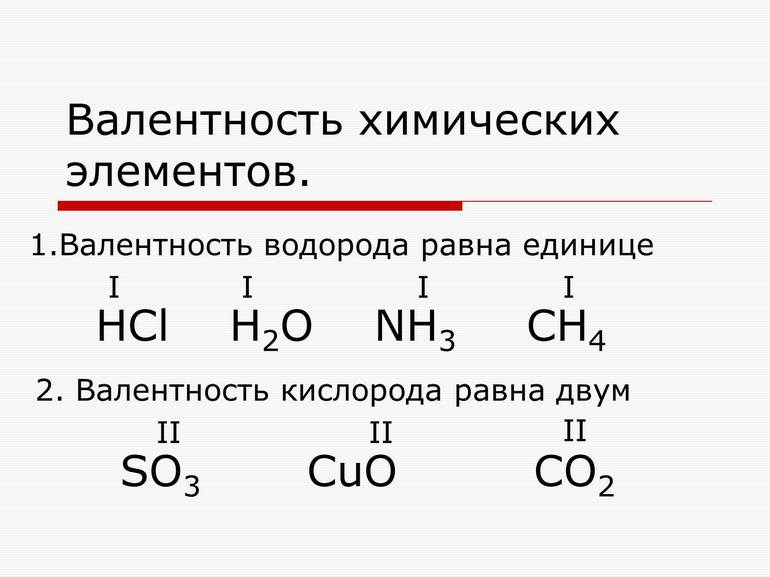
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
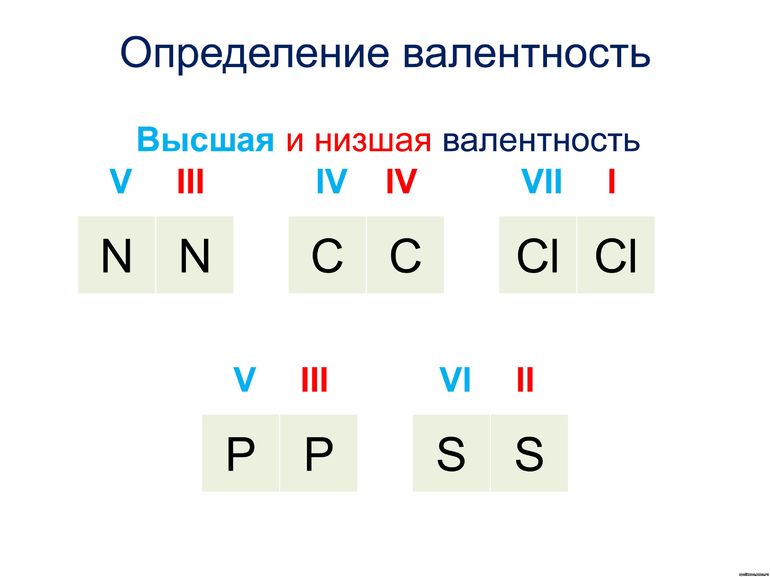
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
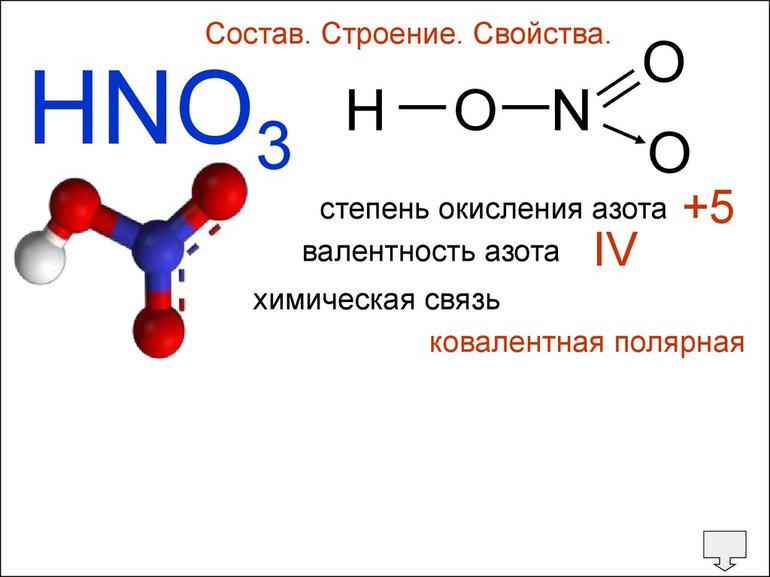
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Химические связи. Валентность и ковалентность.
Когда такой электроположительный элемент, как натрий, встречает такой электроотрицательный элемент, как хлор, атом натрия легко отдает один электрон, который атом хлора так же легко принимает. Получаются атом натрия с положительным зарядом (ион натрия), и атом хлора с отрицательным зарядом (ион хлора). Тут же возникает и мощное электрическое притяжение между этими двумя ионами, в результате чего вокруг каждого иона натрия толпится куча ионов хлора, и, соответственно, вокруг каждого иона хлора тусуется кучка ионов натрия. В результате получается сложный и очень упорядоченный строй ионов, крепко цепляющихся друг за друга. Такой вид связи называется «валентной». Иногда такую связь еще называют «ионной».
Валентность – это и есть способность атомов химических веществ образовывать электрические связи с атомами других элементов, отдавая или присоединяя электроны. Величина валентности определяется числом присоединенных или отданных электронов.
Электроны, расположенные на последней оболочке, в основном и определяют химические свойства атомов, и называются валентными. Число валентных электронов определяет валентность элемента. Так, все щелочные металлы (Li, Na, K, Rb, Cs, Fr) – одновалентны. Все щелочноземельные элементы (Mg, Ca, Sr, Ba) – двухвалентны. Атомы с целиком заполненными оболочками не имеют валентных электронов и химически неактивны. Они образуют инертные газы – гелий, неон, аргон и т.д. и составляют нулевую группу, так как их валентность равна нулю.
Химическая связь – это явление взаимодействия атомов, обусловленное перекрыванием их электронных оболочек, т.е. пересечением траекторий движения их электронов.
Если сделать температуру достаточно высокой, то энергии колебаний хватает на то, чтобы оторвать ионы друг от друга, преодолевая силу электрического притяжения. И тогда вещество начинает «плавиться», т.е., как говорят, «переходит в жидкую фазу», то есть переходит в жидкое состояние, становится жидкостью. В жидкой фазе ионы больше не удерживаются строго на своих местах и свободно путешествуют.
А что происходит, когда встречаются два электроположительных атома? Например, два атома натрия, встречаясь, попросту начинают обладать двумя электронами совместно поскольку каждый готов отдать свой электрон, и уж тем более никто не хочет захватывать дополнительный. Возникает совместное владение электронами.
Точно то же самое происходит, когда встречаются два электроотрицательных атома – например два атома фтора. Каждый из них так сильно хочет схватить лишний электрон, что они делают то же самое – передают друг другу по одному электрону в совместное пользование, и из-за этого тоже становятся связанными друг с другом. Такой вид химической связи называется «ковалентной» (возможно, буквы «ко» от слова «кооперация»).
Существуют и другие виды химической связи, например «металлическая». При этом виде связи свободные электроны, то есть не привязанные ни к какому конкретному атому, бродят между атомов, осуществляя роль цемента.
Если ковалентную связь образуют одинаковые атомы, например как в молекуле Cl2, то силы, с которой каждый атом тянет на себя общий электрон, одинаковы, и в результате электроны не смещены в сторону одного из них. Такую ковалентную связь называют «неполярной». Если же атомы разные, то один из них может сильно перетянуть общие электроны в свою сторону, и тогда на стороне более сильного атома возникнет избыточный отрицательный заряд, а на стороне другого – равный ему избыточный положительный, и молекула станет полярной. Такой вид ковалентной связи называют «полярной».
Разница между электровалентностью и ковалентностью
Ключевое различие между электровалентностью и ковалентностью заключается в том, что электровалентность — это число электронов, которое атом либо получает, либо теряет при образовании иона, тогда как ковалентность — это количество электронов, которое атом может разделить с другим атомом.
Хотя термины электровалентность и ковалентность звучат одинаково, они отличаются друг от друга согласно своим определениям. Преимущественно, электровалентность объясняет образование иона, тогда как ковалентность объясняет образование ковалентной связи.
Содержание
Что такое электровалентность?
Электровалентность — это число электронов, полученных или потерянных при образовании иона из этого атома. Так как, термин электровалентность относится к числу электронов, которые атом либо получает, либо теряет при образовании электовалентной связи, то это называется ионной связью.Следовательно на ионе, появляется чистый электрический заряд. Более того, если атом теряет электроны при образовании ионной связи, это указывает на положительную электровалентность, а если атом приобретает электроны при образовании ионной связи, это указывает на то, что атом имеет отрицательную электровалентность. Соединения с атомами, имеющими электровалентность, являются ионными соединениями.
Например, давайте рассмотрим образование хлорида натрия (NaCl). Там атом натрия теряет один электрон, таким образом, он имеет положительную электровалентность. Атом хлора получает этот электрон. Таким образом, он имеет отрицательную электровалентность. Однако, поскольку число электронов, которые либо теряются, либо приобретаются, равно одному, электровалентность натрия (или хлора) равна единице. Мы должны указать электровалентность с соответствующим знаком, чтобы указать, является ли она положительной или отрицательной электровалентностью.
Что такое ковалентность?
Ковалентность — это максимальное количество электронов, которое может быть разделено с другим атомом. Следовательно, ковалентность указывает максимальное количество ковалентных связей, которые атом может образовать, используя свои пустые орбитали. Значение этого параметра зависит от числа валентных электронов атома и числа пустых орбиталей, присутствующих в атоме.
Например, атом водорода имеет только один электрон, таким образом, он может делить один электрон с другим атомом. Следовательно, ковалентность водорода равна 1. В отличие от электровалентности, тут не используются знаки плюс или минус, потому что нет потери или усиления электронов, только электроны делятся друг с другом.
В чем разница между электровалентностью и ковалентностью?
Электровалентность — это число электронов, полученных или потерянных при образовании иона из этого атома. Это объясняет образование ионной связи. Более того, соединения, имеющие атомы с этим параметром, являются ионными соединениями. С другой стороны, ковалентность — это максимальное количество электронов, которое может быть разделено с другим атомом. Это объясняет образование ковалентной связи. Кроме того, соединения, имеющие атомы с ковалентностью, являются ковалентными соединениями.
Заключение — Электровалентность против Ковалентности
Хотя термины электровалентность и ковалентность звучат достаточно похоже, они имеют отличия, четкие определения и характеристики. Разница между электровалентностью и ковалентностью заключается в том, что электровалентность — это число электронов, которое атом либо получает, либо теряет при образовании иона, тогда как ковалентность — это количество электронов, которое атом может разделить с другим атомом.
Валентность
Полезное
Смотреть что такое «Валентность» в других словарях:
ВАЛЕНТНОСТЬ — ВАЛЕНТНОСТЬ, мера «соединительной способности» химического элемента, равная числу индивидуальных ХИМИЧЕСКИХ СВЯЗЕЙ, которые может образовать один АТОМ. Валентность атома определяется числом ЭЛЕКТРОНОВ на самом верхнем (валентном) уровне (внешней… … Научно-технический энциклопедический словарь
ВАЛЕНТНОСТЬ — (от лат. valere иметь значение), или атомность, число атомов водорода или эквивалентных ему атомов или радикалов, к рое может присоединить данный атом или радикал. В. является одной из основ распределения элементов в периодической системе Д. И.… … Большая медицинская энциклопедия
Валентность — * валентнасць * valence термин происходит от лат. имеющий силу. 1. В химии это способность атомов химических элементов образовывать определенное число химических связей с атомами др. элементов. В свете строения атома В. это способность атомов… … Генетика. Энциклопедический словарь
ВАЛЕНТНОСТЬ — (от лат. valentia сила) в физике число, показывающее, со сколькими атомами водорода может соединяться данный атом или замещать их. В психологии валентность есть идущее из Англии обозначение для побуждающей способности. Философский… … Философская энциклопедия
валентность — атомность Словарь русских синонимов. валентность сущ., кол во синонимов: 1 • атомность (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
ВАЛЕНТНОСТЬ — (от лат. valentia – крепкий, прочный, влиятельный). Способность слова к грамматическому сочетанию с другими словами в предложении (например, у глаголов валентность определяет способность сочетаться с подлежащим, прямым или косвенным дополнением) … Новый словарь методических терминов и понятий (теория и практика обучения языкам)
ВАЛЕНТНОСТЬ — (от латинского valentia сила), способность атома химического элемента присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи … Современная энциклопедия
ВАЛЕНТНОСТЬ — (от лат. valentia сила) способность атома химического элемента (или атомной группы) образовывать определенное число химических связей с другими атомами (или атомными группами). Вместо валентности часто пользуются более узкими понятиями, напр.… … Большой Энциклопедический словарь
ВАЛЕНТНОСТЬ — ВАЛЕНТНОСТЬ, валентности, мн. нет, жен. (от лат. valens имеющий ценность, значение) (хим.). То же, что атомность. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ВАЛЕНТНОСТЬ — ВАЛЕНТНОСТЬ, и, жен. (спец.). Способность атома (или атомной группы) образовывать химические связи с другими атомами (или атомными группами). | прил. валентный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ВАЛЕНТНОСТЬ — (от лат. valentia сила), способность атомов элементов к образованию химических связей; количественно характеризуется числом. В. можно рассматривать как способность атома отдавать или присоединять определ. число эл нов внеш. электронных оболочек… … Физическая энциклопедия
Валентность химических элементов
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
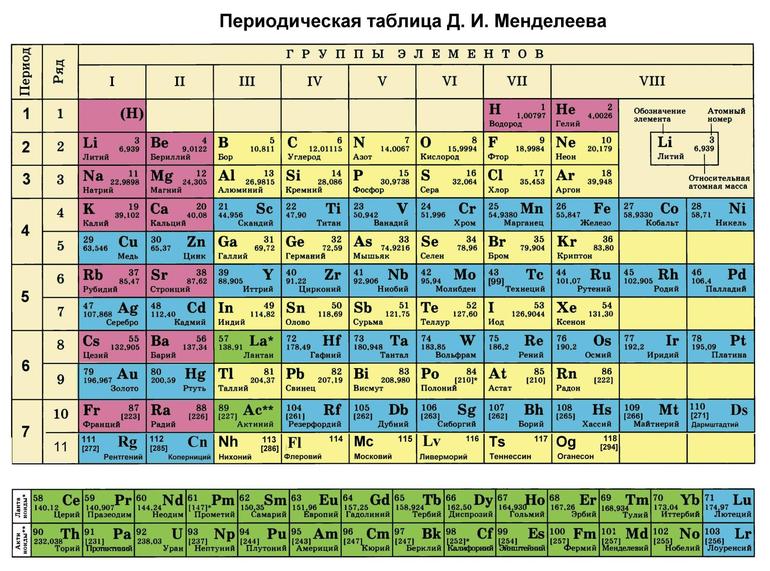
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи NH3 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: CH4.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
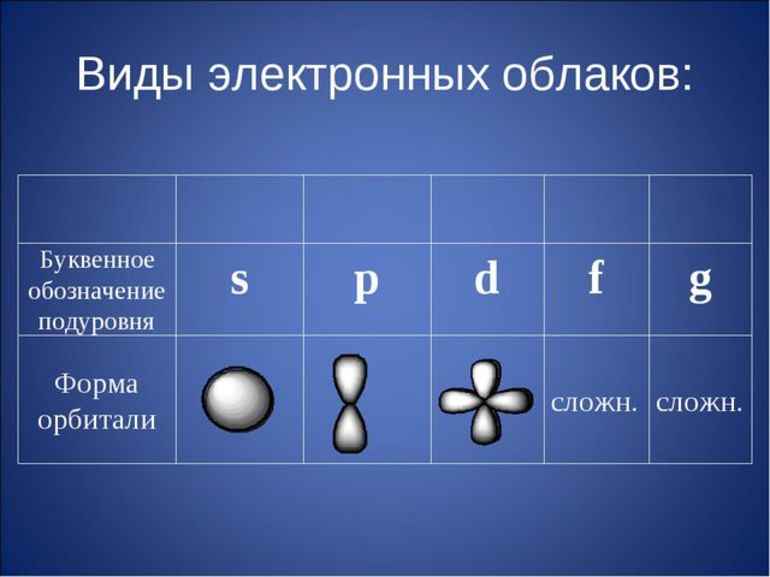
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
Основанием для образования соединений является прием электронов.
Виды электронов:
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.