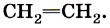Что такое валентное состояние атома углерода
Валентные состояния атома углерода
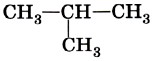
В молекуле пропана СН3—СН2—СН3 при центральном атоме углерода находятся два атома водорода и два атома углерода. Такой атом называют вторичным.
Атом углерода, связанный с тремя углеродными атомами, называется третичным.
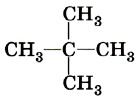
Углерод, при котором находятся четыре соседних атома углерода, называется четвертичным.
Второе валентное состояние атома углерода рассмотрим на примере молекулы этилена С2Н4. В ней между атомами углерода двойная связь, которая отражается в структурной формуле двумя одинаковыми чёрточками:
Презентация «Валентные состояния атома углерода»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Валентные состояния атома углерода
гибридная орбиталь Гибридизация орбиталей – процесс выравнивания их по форме и энергии. s-орбиталь р-орбиталь
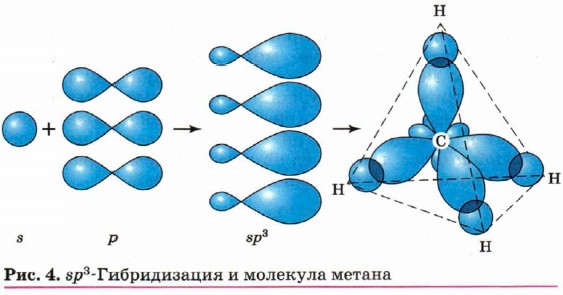
Первое валентное состояние атома углерода В процесс гибридизации вступают одна s-орбиталь и три р-орбитали
Строение молекулы метана Первое валентное состояние атома углерода Атом углерода в sp3-гибридизации
Образование молекулы этана
Второе валентное состояние атома углерода В процесс гибридизации вступают одна s-орбиталь и две р-орбитали
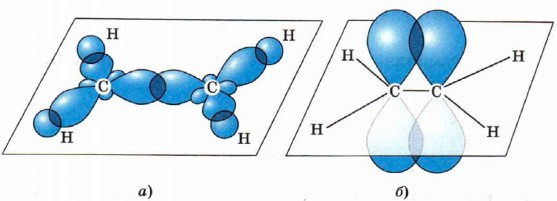
Строение молекулы этилена Второе валентное состояние атома углерода Образование двойной связи
Третье валентное состояние атома углерода В процесс гибридизации вступают одна s-орбиталь и одна р-орбиталь
Третье валентное состояние атома углерода Строение молекулы ацетилена
СН3 – СН2 – СН = СН2 СН ≡ С – СН2 – СН3 СН2 = СН – СН = СН2 СН3 – СН = С = СН2 СН3 – СН = СН – СН2 – С ≡ С – СН3 СН2 = С = СН – СН = СН2 Определить тип гибридизации атомов углерода
Типы углеродных атомов Первичный атом углерода – атом углерода, при котором находятся три атома водорода и один атом углерода. Вторичный атом углерода – атом углерода, при котором находятся два атома водорода и два атома углерода. Третичный атом углерода – атом углерода, связанный с тремя углеродными атомами. Четвертичный атом углерода – атом углерода, связанный с четырьмя углеродными атомами.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДВ-397327
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
Во Франции планируют ввести уголовное наказание за буллинг в школе
Время чтения: 1 минута
В Оренбурге школьников переведут на дистанционное обучение с 9 декабря
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Учителям истории предлагают предоставить право бесплатно посещать музеи
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Строение атома углерода. Валентные состояния атома углерода
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Валентность углерода в соединениях
Углерод — шестой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во IVA группе. В ядре атома углерода содержится 6 протонов и 6 нейтронов (массовое число равно 12). В атоме углерода есть два энергетических уровня, на которых находятся 6 электронов (рис. 1).
Рис. 1. Строения атома углерода.
Электронная формула атома углерода в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что углерод проявляет валентность II в своих соединения (C II O).
В атоме углерода есть 1 вакантная орбиталь 2p-подуровня. За счет её наличия электроны 2s-подуровня могут распариваться и один из них совершает переход и занимает свободную 2p-орбиталь, т.е. для углерода характерно возбужденное состояние.
Наличие четырех неспаренных электронов свидетельствует о том, что углерод в своих соединениях (C IV O2, C IV H4, H2C IV O3 и др.) проявляет валентность равную IV.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Валентные состояния атома углерода
Валентные состояния атома углерода
Представление о том, что химические связи могут быть результатом владения парой электронов двумя атомами, было выдвинуто Льюисом (1916) и развито Гейтлером и Лондоном (1927). В дальнейшем Лайнус Полинг ввел чрезвычайно важные понятия направленной валентности и гибридизации орбитали.
Согласно понятию направленной валентности, связь атомов осуществляется в том направлении, при котором обеспечивается максимальное перекрывание орбиталей. Чем лучше перекрывание, тем прочнее должна быть связь, и только при максимальном перекрывании достигается минимум энергии системы.
Атом углерода в основном состоянии имеет электронное строение 1s22s22p2. Посмотрим внимательно на распределение электронов по орбиталям в атоме углерода:
Два неспаренных электрона могут образовывать только две химические связи с другими атомами, то есть в соответствии с этой схемой атом углерода должен быть двух валентным. Но в органической химии атом углерода всегда имеет валентность, равную четырем.
Для образования четырех ковалентных связей атом углерода должен иметь четыре неспаренных электрона.
Как же объяснить четырехвалентность углерода?
Атом может изменять свое валентное состояние, когда, спареные электроны распариваются и переходят на другие атомные орбитали. В нашем случае один электрон с s-орбитали переходит на свободную р-орбиталь.

При этом получаются гибридные атомные орбитали, электроны
на которых обладают усредненной энергией.


Молекула этана СН3 – СН3, соответственно будет иметь следующее пространственное строение:
С sp2-гибридизацией мы встречаемся в соединениях с двойной связью, атомы образующие двойную связь и будет находиться в sp2-гибридизации.
Рассмотрим пространственное строение молекулы этена СН2 = СН2, в которой атомы углерода находятся в состоянии sp2-гибридизации. Волнистой линией на рисунке показано перекрывание негибридных р-орбиталей (π-связь).

Итак, атомы углерода участвующие в образовании простых, одинарных σ-связей находятся в состоянии sp3-гибридизации, атомы углерода участвующие в образовании двойных связей находятся в состоянии sp2-гибридизации, атомы углерода участвующие в образовании тройных связей находятся в состоянии sp-гибридизации. Любая кратная связь всегда будет иметь одну σ-связь, все остальные будут π-связями. Например, в молекуле СН2 = СН2, между атомами углерода, одна связь σ-, другая π-связь. В молекуле СН≡СН между атомами углерода, одна связь σ-, и две π-связи.
Проверьте себя, как Вы поняли тему, для этого выполните тестовое задание:
2.Сколько атомов углерода в молекуле пентина-2 (СН3 – С ≡ С – СН2 – СН3) находится в состоянии sp3 гибридизации:
а) все 5 атомов углерода, б) 2, в) 1, г) 3.
3.Какова ожидаемая равновесная конфигурация молекулы СН2 = СН2:
а) линейная, б) угловая, в) плоский равносторонний треугольник, г) тетраэдр.
4. Выберите соединения, для которых характерна ковалентная полярная связь:
5.Определите тип гибридизации атомных орбиталей по следующим данным:
Что такое валентное состояние атома углерода
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СТРОЕНИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, которая состоит из следующих основных положений.
Теория Бутлерова дает принципиальную возможность познания геометрии молекулы (микроскопических свойств) через познание химических свойств (макроскопических свойств). Основные положения теории строение сохраняют свое значение до сих пор.
Электронное строение органических соединений изображают с помощью электронных формул Льюиса. В них с помощью точек указывают положение всех валентных электронов: электронов химических связей и неподеленных пар электронов. При этом считают, что неподеленные пары электронов составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи, являются частью внешней оболочки обоих атомов. Например, в приведенной ниже формуле Льюиса для тетрахлорметана все атомы имеют октет электронов.
Современные теории ковалентной связи основаны на представлениях квантовой механики. Согласно принципам квантовой механики состояние электрона в атоме определяется волновой функцией, которую называют атомной орбиталью. Образование химической связи между атомами рассматривается как результат взаимодействия двух орбиталей, на каждой из которых находится по одному электрону. При этом происходит образование молекулярных орбиталей (МО). Из двух атомных орбиталей образуются две молекулярные орбитали, одна из которых (связывающая) имеет более низкую энергию, а другая (разрыхляющая) – более высокую энергию, чем исходные АО.
Электроны связи занимают более низкую по энергии связывающую орбиталь, таким образом, взаимодействие орбиталей приводит к выигрышу в энергии.
В зависимости от типа комбинирующихся атомных орбиталей образуются разные типы МО. Определяющую роль в этом играют симметрия и узловые свойства орбиталей. Атомные s-орбитали имеют симметрию шара и не имеют узловых поверхностей, проходящих через центр атома. Атомные p-орбитали имеют цилиндрическую симметрию и три состояния px , py и pz. Каждая p-орбиталь имеет узловую плоскость, проходящую через центр атома и перпендикулярную соответственно оси x, y или z.
Узловая поверхность – это место, где вероятность нахождения электрона равна нулю, а волновая функция меняет знак. Чем больше узлов, тем выше энергия орбитали. Таким образом, p-орбиталь состоит из двух частей, в которых знаки волновых функций противоположны.
При рассмотрении электронного строения многоатомных молекул необходимо использовать такой набор орбиталей, при котором достигается их максимальное перекрывание. В связи с этим водится понятие гибридизации орбиталей. Атом углерода в возбужденном состоянии содержит четыре неспаренных электрона на внешнем энергетическом уровне и способен образовать четыре ковалентных связи.
В образовании связей участвуют гибридные орбитали.
Таблица 3.1. Зависимость структуры соединений от типа гибридизации углерода.