Что такое so2 химия
Что такое so2 химия
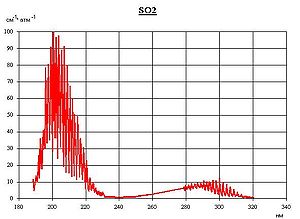
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
Последняя реакция является качественной реакцией на сульфит-ион SO3 2- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Полезное
Смотреть что такое «SO2» в других словарях:
SO2 — ist: die Summenformel von Schwefeldioxid die Abkürzung von Sauerstoffsättigung Diese Seite ist eine Begriffsklärung zur Unterscheidung mehrerer mit demselben Wort bezeichneter Begriffe … Deutsch Wikipedia
SO2 — SO2: Symbol für Schwefeldioxid … Universal-Lexikon
SO2 — Dioxyde de soufre Dioxyde de soufre En bleu les domaines de gravitation des électrons liants (liaisons σ). En rose les domaines de gravitation des doublets non liants ou hybridations. En vert … Wikipédia en Français
SO2 — Sulphuryl Sul phur*yl, n. [Sulphur + yl.] (Chem.) The hypothetical radical
SO2 — Sulphur Sul phur, n. [L., better sulfur: cf. F. soufre.] 1. (Chem.) A nonmetallic element occurring naturally in large quantities, either combined as in the sulphides (as pyrites) and sulphates (as gypsum), or native in volcanic regions, in vast… … The Collaborative International Dictionary of English
SO2 — Sulfur Dioxide (Governmental » Transportation) * Fingerprint Bureau (Governmental » Police) … Abbreviations dictionary
SO2 — oxygen saturation … Medical dictionary
SO2 — abbr. med. oxygen saturation – сатуpация кислорода … Dictionary of English abbreviation
SO2 — See Sulfur Dioxide. U.S. Dept. of Energy, Energy Information Administration s Energy Glossary … Energy terms
SO2 — • oxygen saturation … Dictionary of medical acronyms & abbreviations
Оксид серы(IV)
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы (IV) |
| Химическая формула | SO2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Плотность | 0,002927 г/см³ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7446-09-5] |
Окси́д се́ры (IV) (диокси́д се́ры, се́рнистый газ, се́рнистый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой се́рнистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:

Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:


Последняя реакция является качественной реакцией на сульфит-ион SO3 2− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
Физиологическое действие
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Диоксид серы
Диоксид серы
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Химическая формула | SO2 |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Физические свойства | |
| Плотность вещества | 2,927 г/л г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| номер CAS | [7446-09-5] |
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
Последняя реакция является качественной реакцией на сульфит-ион SO3 2- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Полезное
Смотреть что такое «Диоксид серы» в других словарях:
ДИОКСИД СЕРЫ — (Д.с.) SO2, бесцветный газ с резким запахом, один из главных загрязнителей атмосферы. Д.с. образуется при сжигании ископаемого топлива на предприятиях топливно энергетического комплекса и в двигателях внутреннего сгорания, а также на предприятиях … Экологический словарь
диоксид серы — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN sulphur dioxide Emissions of the gas given off during the burning of fossil fuels in power stations and other boilers. Sulphur dioxide is created because sulphur is an impurity … Справочник технического переводчика
Диоксид серы — см. Сернистый ангидрид … Российская энциклопедия по охране труда
с повышенной спосбностью абсорбировать диоксид серы из дымовых газов ТЭС — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Energy and Environmental Research Corporation … Справочник технического переводчика
Диоксид селена — Диоксид селена … Википедия
Диоксид титана — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
серы диоксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы двуокись — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы(IV) оксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
Оксид серы (IV)
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
4. Обработка концентрированной серной кислотой неактивных металлов.
Химические свойства оксида серы (IV)
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
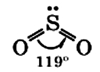
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе