Что такое pkb в химии
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.
Разница между pKa и pKb
Содержание:
Что такое pKa?
Чем ниже pKa vlaue, тем сильнее кислота. Аналогично, чем выше значение pKa, тем слабее кислота. Глядя на значения pKa различных кислот, можно сравнить относительные силы кислот. Вместо использования значений Ka обычно используются значения pKa, поскольку это упрощает работу с очень большими или очень маленькими числами с маленькими десятичными знаками.
Помимо сравнения силы кислоты, значения pKa также используются для выбора подходящих буферов. Согласно уравнению Хендерсона-Хассельбаха существует взаимосвязь между pH и pKa системы.
pH = pKа + журнал10([A – ] / [AH])
для диссоциации ГК кислоты. Это уравнение можно переписать, как показано ниже.
Kа/[ЧАС + ] = [A – ] / [AH]
Что такое pKb?
«P» в pKb означает «отрицательный логарифм». Поскольку большинство значений Kb очень большие или очень маленькие, для упрощения работы используются отрицательные логарифмы этих значений. Следовательно, большое значение Kb можно охарактеризовать небольшим значением pKb с маленькими десятичными знаками.
Какая связь между pKa и pKb?
Отношения между Ka и Kb приведены ниже.
Kw = Ka.Kb
Тогда связь между pKa и pKb определяется как, (при 25 о C)
рКа + рКб = 14
В чем разница между pKa и pKb?
pKa против pKb
Скачать PDF-файл pKa vs pKb
Вы можете загрузить PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечанием к цитированию. Пожалуйста, скачайте PDF-версию здесь: Разница между pKa и pKb
Определение pKb в химии
pK b — отрицательный десятичный логарифм базовой константы диссоциации (K b ) раствора. Он используется для определения концентрации щелочного или щелочного раствора.
который получается из химического уравнения:
BH + + OH — ⇌ B + H 2 O
Нахождение pKb из pKa или Ka
Константа диссоциации основания связана с константой диссоциации кислоты, поэтому, если вы знаете один, вы можете найти другое значение. Для водного раствора концентрация гидроксид-иона [OH — следует соотношению концентрации иона водорода [H + ] «K w = [H + ] [OH —
Помещая это соотношение в уравнении K b дает: K b = [HB + K w /([B] [H]) = K w /K a
При той же ионной силе и температуре:
Для водных растворов при 25 ° C, pK w = 13,9965 (или около 14), поэтому:
Пример расчета pKb
Сначала рассчитайте концентрацию ионов водорода и гидроксида в решение для получения значений для вставки в формулу.
K w = [H + (aq) ] [OH — (aq) ] = 1 x 10 –14 моль 2 dm –6
[OH — ( aq) ] = K w / [H + (aq) ] = 1 x 10 –14 /3,16 x 10 –10 = 3,16 x 10 –5 mol dm –3
Теперь у вас есть необходимая информация для решения базовая константа диссоциации:
K b = [OH — (aq) ] 2 / [B (aq) ] = (3,16 x 10 –5 ) 2 /0,50 = 2,00 x 10 –9 моль-дм –3
pK b = –log (2. 00 x 10 –9 ) = 8,70
Ионные равновесия в водных растворах. Количественное определение кислотности водных растворов. Понятие pH и pK. Гидролиз солей. Буферные растворы. Произведение растворимости.
Благодаря теории электролитической диссоциации удалось определить, что такое кислота и что такое основание, а также количественно рассчитать степень кислотности растворов.
HClO3 + H2O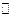
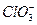
Отсюда следует, что в зависимости от того, что преобладает в растворе ионы гидроксония или ионы гидроксила раствор будет кислотой или щелочью соответственно.
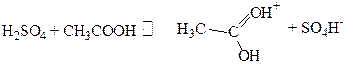
Из реакции (5.в) очевидна относительность понятия кислоты и основания. В реакции (5.в) CH3 COOHявляется основанием, а при взаимодействии с водой CH3COOHбудет кислотой.
Из вышеизложенного видно, что необходима количественная характеристика силы кислоты и основания. Для получения этих характеристик рассмотрим для примера только водные растворы.
Запишем реакцию диссоциации воды:
Применяя к этому уравнению закон действующих масс, можно записать:
Kd= 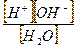
Константа Kив носит название ионное произведение воды.
Считая, что 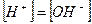
В 1920 г. Я. Соренсен ввёл понятие pH
Учитывая уравнения (5.2) и (5.3), получаем при равенстве концентраций ионов водорода и гидроксила, что pH = 7.
Аналогично pH можно ввести понятие pOH:
Тогда очевидно, что:
Для кислой среды pH 7, а в нейтральной среде pH = 7.
Для диссоциации кислоты можно записать аналогичное соотношение. Запишем его в общем виде:
Для данного уравнения запишем закон действующих масс:
Ka= 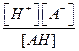
где Ка– константа диссоциации кислоты.
Значения pKа некоторых кислот
Рассмотрим поведение слабых кислот 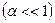



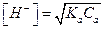
Из (5.8) следует, что кислотность слабых кислот связана с константами их диссоциации. Учитывая уравнение (5.3), можно записать, что для слабой кислоты:
аналогично для слабого основания с учетом (5.5):
Kа, Kb, Ca, Cb – константы диссоциации и концентрации кислот и оснований соответственно.
Гидролиз солей.
Рассмотрим вначале процесс гидролиза хлорида аммония. При этом учтём, что все соли диссоциируют полностью, а вода является слабым электролитом.
NH4Cl 
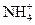
NH4Cl + H2O 
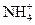
H2O 
CH3 COO Na + H2O 
(малодиссоциирующее соединение) (избыток ионов гидроксила)
То есть соль слабой кислоты и сильного основания всегда будет давать при растворении щелочную реакцию.
Соль же сильной кислоты и сильного основания, слабой кислоты и слабого основания при своём растворении будет давать среду, зависящую от соотношения силы кислоты и силы основания.
pH при гидролизе можно рассчитать для:
соли сильной кислоты и слабого основания
соли слабой кислоты и сильного основания
соли слабой кислоты и слабого основания
где Cab концентрация растворенной соли.
Согласно (5.13) pHпри гидролизе соли слабой кислоты и слабого основания зависит только от константы диссоциации (ионизации) кислоты и основания, и не зависит от концентрации соли.
Буферные растворы.
Рассмотрим смесь слабой кислоты и ее соли, образованной сильным основанием. Например, смесь водных растворов уксусной кислотыи ацетата натрия. Запишем реакцию диссоциации кислоты:
Тогда 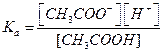
откуда 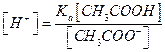
Обозначим: 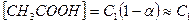
Дата добавления: 2017-01-29 ; просмотров: 2723 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
13 лучших примеров слабых оснований и их использование
Конъюгированная кислота слабого основания всегда является слабой кислотой, а сопряженное основание слабой кислоты всегда является слабым основанием.
Как определить слабое основание?
Кроме того, слабые основания имеют более низкую константу диссоциации основания (K b). Она аналогична константе диссоциации кислоты и представляет собой относительную силу основания. По мере того как основания становятся слабее, их значения Kb становятся меньше.
В этой статье мы использовали значения pK b для обозначения основности соединения. Это просто отрицательный десятичный логарифм Kb раствора.
Теперь, когда у вас есть общее представление о значениях pH и K b, давайте рассмотрим некоторые из наиболее распространенных примеров слабого основания и их важность.
13. Гидроксиламин
Формула: NH2OH
Основность (pK b): 8.05
Гидроксиламин также является промежуточным продуктом в процессе биологической нитрификации микробами, например, бактериями. В полупроводниковой промышленности он часто используется для удаления фоторезистов после литографии.
Поскольку гидроксиламин представляет опасность возгорания при воздействии сильного тепла, его потенциальное использование должно быть тщательно оценено. Природа взрывоопасности до сих пор недостаточно хорошо изучена.
12. Триметиламин
Формула: N(CH3)3
Основность (pK b): 4,20
Триметиламин является газом при комнатной температуре, но хорошо растворяется в воде. Обычно он продается в виде 40% раствора в воде. При более низких концентрациях пахнет гниющей рыбой. При более высоких концентрациях пахнет аммиаком. Кратковременное вдыхание высоких концентраций или длительное вдыхание низких концентраций может вызвать серьезные проблемы со здоровьем.
11. Гидразин
Формула: N2H4
Основность (pK b): 8.1
Гидразин представляет собой соединение, содержащее два атома азота с одинарной связью и четыре периферийных атома водорода. Его водный раствор (концентрация более 37%) бесцветен, вызывает коррозию и токсичен при проглатывании и абсорбции через кожу.
Когда гидразин смешивается с водой, он образует более плотный моногидрат (1,032 г/см3), чем безводное вещество.
Как и аммиак, гидразин обладает основными (щелочными) химическими свойствами. Это высокореакционная основа и восстановитель, используемый в широком спектре медицинских и промышленных применений.
Ежегодно во всем мире производится около 100,00 метрических тонн гидразина. В основном он используется как пенообразователь для производства пенопласта.
10. Гидроксид алюминия
Формула: Al(OH)3
Основность (pK b): 7,5
В чистом виде гидроксид алюминия представляет собой белые гранулы или порошок плотностью около 2,4 г/мл. Хотя он не растворяется в воде, он быстро растворяется в сильных основаниях и кислотах.
Гидроксид алюминия обладает двумя уникальными свойствами:
Гидроксид алюминия обычно используется в качестве дополнительного ингредиента в антацидных препаратах. Доказано, что он эффективен при лечении изжоги, кислотного расстройства желудка и расстройства желудка. Он также используется в обрабатывающей промышленности и в качестве огнезащитного наполнителя для полимеров.
9. Гидроксид цинка
Формула: Zn(OH)2
Основность (pK b): 8.15
Гидроксид цинка выглядит как белое твердое вещество и имеет плотность 3,05 г / см3. Он встречается в природе в трех редких минералах, а именно ашоверите, сладките и вульфингите. Его также синтезируют в лаборатории путем смешивания раствора гидроксида натрия с раствором любой соли цинка.
Подобно гидроксидам других металлов, таких как хром, олово, бериллий, свинец и алюминий, гидроксид цинка является амфотерным. Это означает, что он может реагировать и как кислота, и как основание. Он легко растворяется в растворе сильного основания (например, гидроксида натрия), а также в растворе сильной кислоты (например, соляной кислоты).
Гидроксид цинка в основном используется в качестве абсорбирующего агента в хирургических повязках. Он также используется в качестве промежуточного продукта при производстве пестицидов и пигментов.
8. Гидрокарбонат натрия
Формула: NaHCO3
Основность (pKb): 3.67
Соединение гидролизуется в воде с образованием катиона натрия и гидроксид-иона. Присутствие гидроксид-ионов делает соединение слегка основным.
Он в основном используется в выпечке как разрыхлитель. При смешивании с водой он действует как антацид, который довольно эффективен при лечении кислотного расстройства желудка и изжоги.
Бикарбонат натрия быстро реагирует с кислотами, образуя углекислый газ. Вот почему он широко используется для нейтрализации разливов кислоты и нежелательных кислотных растворов в химических лабораториях.
7. Пиридин
Формула: C5H5N
Основность (pKb): 8,75
Структура пиридина очень похожа на структуру бензола, но одна метиновая группа заменена атомом азота. Наличие азота (и его одинокой пары) в бензольном кольце делает пиридин уникальным соединением в химии.
Пиридин является значительно более слабым основанием, чем алкиламины и типичные алифатические третичные амины. Это водорастворимая и легковоспламеняющаяся жидкость с неприятным «рыбоподобным» запахом. Хотя чистый пиридин не имеет цвета, нечистые или старые образцы могут казаться желтыми.
Это основание в основном используется для растворения других соединений и изготовления различных продуктов, включая красители, краски, инсектициды, лекарства, пищевые ароматизаторы, витамины, клеи и резиновые изделия. Оно также содержится во многих природных материалах в окружающей среде.
6. Этиламин
Формула: C2H5NH2
Основность (pKb): 3,35
Равновесие устанавливается между неионизированными молекулами этиламина и двумя ионами, которые образуются в результате его ионизации.
Как и другие первичные амины, этиламин является отличным растворителем для металлического лития. Эти растворы используются для восстановления ненасыщенных органических веществ, таких как алкины и нафталины.
Кроме того, этиламин образует токсичные оксиды азота при сгорании. Обычно его хранят в закрытом контейнере; однако длительное воздействие высоких температур может привести к его резкому разрыву.
5. Пропиламин
Формула: C3H7NH2
Основность (pKb): 3,45
Пропиламин относится к классу органических соединений, называемых моноалкиламинами. Эти соединения содержат первичную алифатическую аминную группу.
Пропиламин растворим в воде и имеет меньшую плотность, чем вода. Это бесцветная летучая жидкость, а его пары тяжелее воздуха. При сгорании он образует токсичные оксиды азота.
Пропиламин обычно содержится в меньшей концентрации в нескольких различных продуктах питания, таких как зеленый болгарский перец, оранжевый болгарский перец, и в наибольшей концентрации в красном болгарском перце и желтом болгарском перце. Исследователи также обнаружили его в диком сельдерее и обычном винограде.
В лаборатории гидрохлорид пропиламина получают путем смешивания хлорида аммония с 1-пропанолом при высоком давлении и температуре с использованием катализатора кислоты Льюиса, например, хлорида железа.
Пропиламин в основном используется для синтеза и анализа других химических веществ.
4. Гидроксид аммония
Формула: NH4OH
Основность (pKb): 4,75
Хотя гидроксид аммония является соединением природного происхождения, он также производится человеком по ряду причин. Он изготавливается путем растворения аммиака в воде. Полученная жидкость бесцветна и имеет резкий запах.
Раствор содержит значительное количество воды и аммиака и меньшее количество иона аммония и гидроксид-иона. Поскольку гидроксид аммония не полностью диссоциирован на ионы, он является слабым основанием. Его pH колеблется между 7 и 10.
У этого соединения есть несколько применений. Например, в продуктах питания гидроксид аммония используется в концентрации 0,7%, тогда как бытовые чистящие средства производятся с концентрацией 5-10%. Он также используется в обычном качественном неорганическом анализе в качестве комплексообразователя и основания.
3. Метиламин
Формула: CH3NH2
Основность (pKb): 3,34
Как видно из формулы, основное различие между аммиаком и метиламином заключается в наличии у последнего группы CH3. Поскольку алкильная группа отталкивает электроны от себя, на атоме азота накапливается небольшой отрицательный заряд, что делает его одинокую пару еще более привлекательной для ионов водорода.
А поскольку аммиак не имеет электронодонорной группы, он является более слабым основанием, чем метиламин (в котором азот имеет более отрицательный заряд, поэтому он охотнее принимает H+).
Как и аммиак, метиламин представляет собой бесцветный газ или жидкость с резким запахом. Он может легко загореться. При длительном воздействии высоких температур емкости с метиламином могут разорваться. Поэтому обращаться с ним нужно осторожно.
Метиламин продается в основном в виде раствора в тетрагидрофуране, этаноле, метаноле или в виде безводного газа в контейнерах под давлением. Он широко используется для производства пестицидов, поверхностно-активных веществ, фармацевтических препаратов, растворителей краски и химических веществ для резины.
2. Анилин
Формула: C6H5NH2
Основность (pKb): 9,13
Более конкретно, одинокая пара над атомом азота в группе NH2 находится в сопряжении с электроном Pi бензольного кольца. Поэтому анилин не может легко потерять электронную пару, что делает его слабым основанием.
Он хорошо растворим в спирте и эфире и слабо растворим в воде. При реакции с сильными кислотами он образует ионы анилиния.
Анилин токсичен в природе. Он быстро всасывается в кожу, легкие и желудочно-кишечный тракт подопытных животных. Однако он широко используется для синтеза химических веществ, особенно сельскохозяйственных, фотохимикатов и красителей.
1. Аммиак
Формула: NH3
Основность (pKb): 4,75
Аммиак обладает большой способностью образовывать водородные связи. Когда он растворяется в воде, он получает ионы водорода из воды, образуя ионы аммония и гидроксида.
Эта реакция протекает в обоих направлениях, что означает ее обратимость. В любой момент реакции почти 99% вещества все еще остается в виде молекул аммиака, и только 1% действительно производит гидроксид-ионы. Поскольку лишь небольшая часть аммиака превращается в гидроксид-ионы в растворе, он является слабым основанием.