Что такое гомологическая разность в химии
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
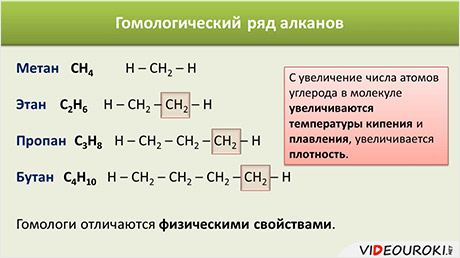
Гомологический ряд алканов в таблице
Алканы обладают следующими свойствами:
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
нерастворимы в воде, но могут растворяться в неполярных растворителях;
Алканы могут вступать в следующие реакции:
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены обладают следующими свойствами:
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
имеют очень высокую температуру плавления и кипения;
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
Алкены участвуют в следующих химических реакциях:
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
Гомологический ряд альдегидов
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
низшие представители класса имеют резкий запах;
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Что такое гомологическая разность в химии
Алена Игоревна Титаренко
Шпаргалка по органической химии
1. Предмет органической химии
Органические вещества в своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет предмет органической химии.
Вещества органические и неорганические.
Наряду с углеродом в состав органических веществ чаще всего входят водород, кислород и азот, сравнительно реже – сера, фосфор, галогены и другие элементы. Известно несколько миллионов органических соединений, неорганических же веществ значительно меньше. Из всех химических элементов только углерод образует такое большое число органических соединений.
С органическими веществами мы встречаемся на каждом шагу. Они содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарств, красителей, средств защиты урожая и т. д.
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии.
С органическими веществами человек знаком с давних времен. Наши далекие предки применяли природные красители для окраски тканей, использовали в качестве продуктов питания растительные масла, животные жиры, тростниковый сахар, получали уксус брожением спиртовых жидкостей.
В настоящее время синтезированы многие органические вещества, не только имеющиеся в природе, но и не встречающиеся в ней: многочисленные пластмассы, различные виды каучуков, всевозможные красители, взрывчатые вещества, лекарственные препараты.
Синтетически полученных веществ сейчас известно даже больше, чем найденных в природе, и число их быстро растет. Осуществляются синтезы самых сложных органических веществ – белков.
Название науки «органическая химия», утратив первоначальный смысл, приобрело в связи с этим более широкое толкование.
Можно сказать, что такое название получило и новое подтверждение, так как ведущей познавательной задачей современной органической химии является глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение тех тонких механизмов, которые составляют материальную основу явлений жизни.
Изучение химии органических веществ, таким образом, расширяет наши знания о природе.
2. Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в органической химии при изучении веществ необходимо опираться на теорию химического строения.
Основные особенности предпосылок химического строения:
1) теория химического строения в своей основе была создана в 60-е гг. XIX в.;
2) основная задача органической химии того времени состояла в изучении состава и свойств природных соединений;
3) также основная задача состояла в разработке способов рационального использования состава и свойств природных соединений для практических нужд;
4) в связи с развитием промышленности, торговли, ростом городов к органической химии стали предъявляться большие требования;
5) текстильная промышленность нуждалась в разнообразных красителях;
6) для развития пищевой промышленности требовались более совершенные методы переработки сельскохозяйственных продуктов;
7) необходимо было решить проблему освещения растущих городов на основе использования природных материалов;
8) нужно было также удовлетворить потребность населения в лекарственных веществах и т. д.
Дальнейшее развитие органической химии стало замедляться из-за отставания в ней теоретических представлений.
Новые теоретические воззрения:
1) открывшиеся в процессе исследования веществ новые явления требовали систематизации и объяснения их с единой точки зрения, но теория того времени оказывалась для этого недостаточной;
2) органическая химия должна была создавать новые вещества, но теоретические знания не могли указать пути их целенаправленного синтеза;
3) необходимость новых теоретических воззрений в органической химии становится более понятной, если знать некоторые известные факторы.
При изучении курса неорганической химии становится известно, что:
а) углерод образует с водородом большое число соединений, так называемых углеводородов;
б) в состав горючего природного газа, например, наряду с простейшим углеводородом метаном СН4, входят этан С2Н6, пропан С3Н8, бутан С4H10 и др.;
в) при термическом разложении каменного угля образуется бензол С6Н6, толуол С7Н8 и т. д.;
г) много различных углеводородов содержится в нефти;
4) углерод, который содержится в природном газе, является четырехвалентным элементом, но только в метане он сохраняет эту валентность;
5) в этане С2Н6 углерод должен быть трехвалентным, а в пропане С3Н8 иметь даже дробную валентность.
3. Особенности органических соединений
В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
1) атомы углерода способны соединяться друг с другом;
2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
Если ионные (неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие простые (одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Особенности атома углерода объясняются его строением:
1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Гомологи
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
| Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. |
| Гомологи – это вещества, которые входят в один и тот же гомологический ряд. |
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
 |  |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Гомологи. Гомологический ряд
Урок 5. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гомологи. Гомологический ряд»
Гомологи – это вещества близкие по строению и свойствам, которые отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для каждого класса органических соединений можно составить их гомологический ряд.
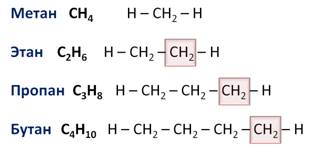
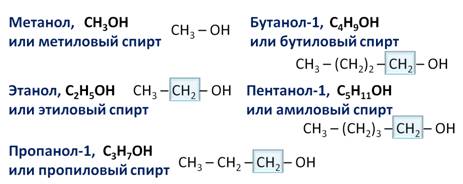
Например, алканы имеют общую формулу CnH2n+2, где n – число атомов углерода, причём каждый член гомологического ряда будет отличаться от предыдущего на группу – СН2. Такая последовательность соединений называется гомологическим рядом (от греческого homolog – «сходный»), отдельные члены этого ряда называются гомологами, а группа атомов, на которую отличаются соседние гомологи (группа – СН2) – гомологической разностью.
Понятно, что гомологи отличаются молярной массой, а значит физическими свойствами. Как правило, с увеличение числа атомов углерода в молекуле увеличиваются температуры кипения и плавления, увеличивается плотность.
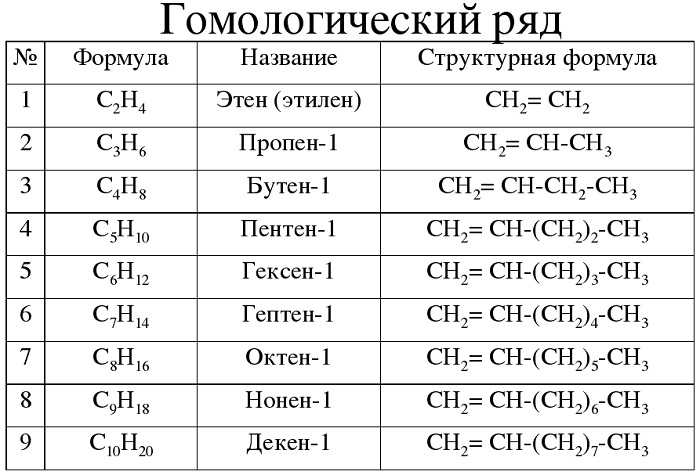
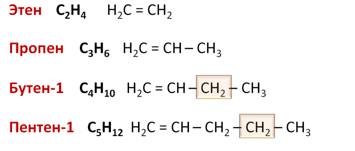
Для алкенов характерна общая формула СnH2n. Первый член гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов – пропен – С3Н6, третий – бутен-1,четвёртый – пентен-1. И так далее, то есть в данном гомологическом ряду также каждый последующий член гомологического ряда отличается от предыдущего на группу – СН2.
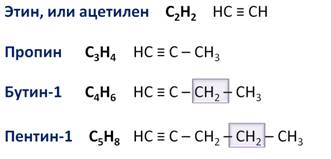
Для алкинов также можно составить гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым представителем этого ряда будет этин, али ацетилен – С2Н2, вторым членом ряда является пропин – С3Н4, третим – бутин-1 – С4Н6, четвёртым – пентин-1 – С5Н8.
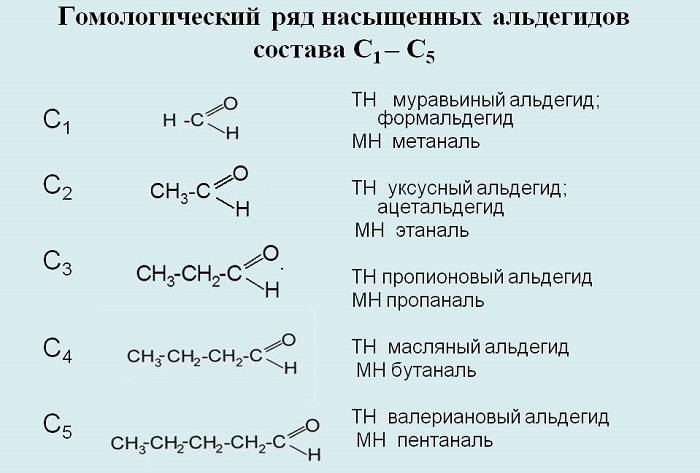
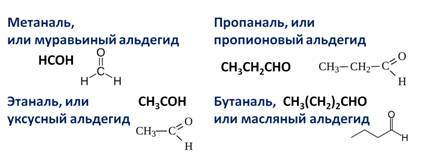
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов СnH2n+1CHO, то первым представителем данного гомологического ряда будет метаналь, или муравьиный альдегид – НСОН, вторым членом ряда – этаналь, или уксусный альдегид – СН3СНО, третьим – пропаналь, или пропионовый альдегид – СН3СН2СНО, четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО и так далее.
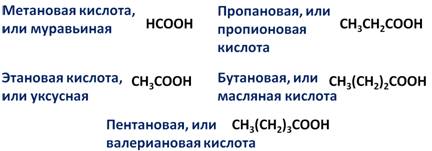
Аналогично и для карбоновых кислот. Так, общая формула насыщенных одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым представителем данного гомологического ряда является метановая кислота, или муравьиная – НСООН, вторым – этановая кислота, или уксусная – СН3СООН, третьим – пропановая, или пропионовая кислота – СН3СН2СООН, четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН, пятым – пентановая, или валериановая кислота – СН3СН2СН2СН2СООН.
Таким образом, для каждого класса органических соединений можно составить гомологический ряд, учитывая общую формулу данного класса. Каждый последующий член гомологического ряда отличается от предыдущего на группу – СН2, которую называют гомологической разность. А сами вещества этого ряда называются гомологами. Как правило, с увеличением числа атомов углерода в гомологическом ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
Гомологический ряд — определение, общая формула и примеры для разных классов соединений
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
пентин — C5H8 и т. д.
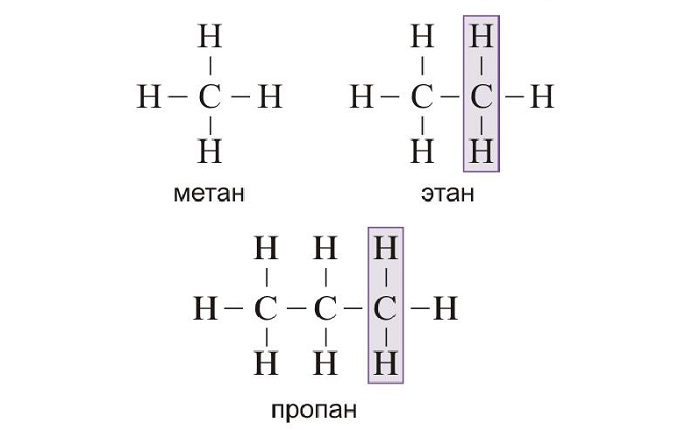
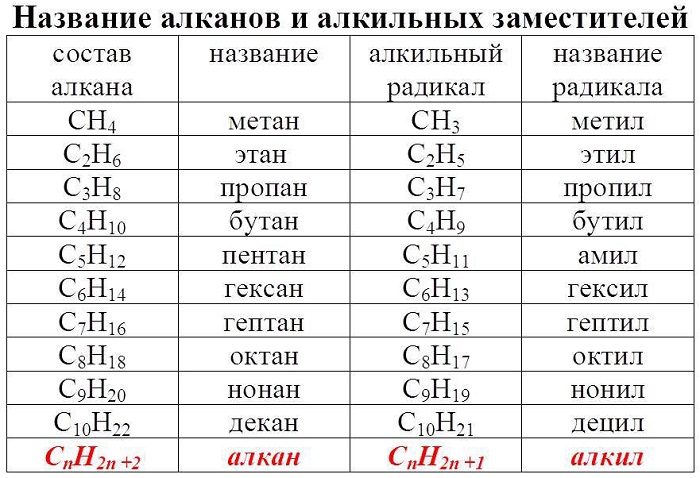
Гомологический ряд алканов в таблице
Алканы — ациклические предельные углеводороды:
всеобщая формула алканов — СnH2n+2;

Алканы обладают следующими свойствами:
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
нерастворимы в воде, но могут растворяться в неполярных растворителях;
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Алкены обладают следующими свойствами:
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
имеют очень высокую температуру плавления и кипения;
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
Алкены участвуют в следующих химических реакциях:
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
Гомологический ряд альдегидов
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
низшие представители класса имеют резкий запах;
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.