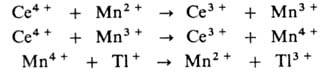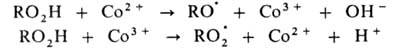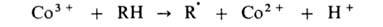Что такое гомогенный катализатор
ГОМОГЕННЫЙ КАТАЛИЗ
ускорение хим. р-ции в присутствии катализатора, к-рый находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или р-ре. При Г. к., как и при гетерогенном катализе, катализатор в р-ции не расходуется, однако является ее необходимым участником; без катализатора р-ция протекает гораздо медленнее или не идет вовсе.
затруднено из-за высокого окислит.-восстановит. потенциала пары Т1 2+ /Т1 + (для пары Т1 3+ /Т1 2+ этот потенциал значительно ниже). В присут. ионов Мп р-ция протекает по многостадийному механизму:
В радикально-цепных процессах в присут. нек-рых в-в может ускоряться образование радикалов в р-циях зарождения или разветвления цепи. Так, при окислении орг. в-ва RH в присут. ионов Со в небольшой концентрации ускоряется разветвление цепи, а при высокой концентрации этих же ионов-также и развитие цепи. Каталитич. механизм распада гидропероксида включает следующие стадии:
Развитие цепи каталитически ускоряется по схеме:
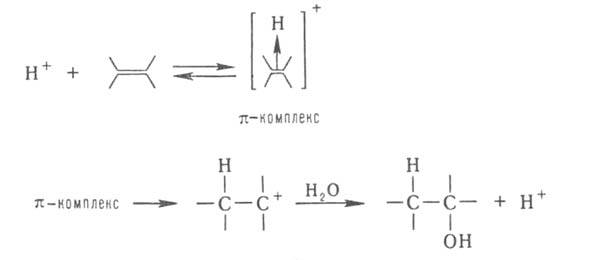
При гетеролитич. присоединении по кратным связям молекулы AD (А-акцепторная, D-донорная часть молекулы) катализатором м. б. более сильный, чем AD, акцептор (электрофил) А или донор (нуклеофил) D. Напр., при гидратировании олефинов к-та Н + служит катализатором, т. к. облегчает последующее взаимод. с водой:
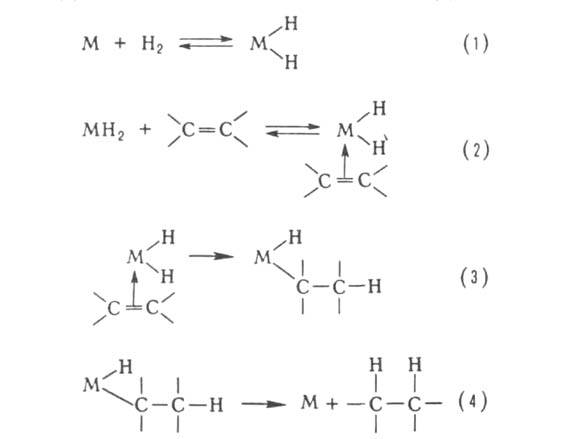
В металлокомплексном Г. к. р-ции ускоряются в присут. комплексных соед. Ti, Fe, Cu, Pt и др. переходных металлов, к-рые способны к образованию комплексов с молекулами субстратов. Каталитич. активность м. б. обусловлена след. факторами: 1) пространств. близостью молекул субстратов, входящих как лиганды в координац. сферу металла, 2) ослаблением хим. связей в молекулах субстратов и снижением энергии активации при их разрыве; 3) усилением вследствие электронных эффектов донорных или акцепторных св-в молекул субстратов, входящих в металлокомплекс; 4) снятием запретов по симметрии молекулярных орбиталей благодаря участию d-орбиталей металлов; 5) возможностью многоэлектронных р-ций с использованием d-электронов переходных металлов в некомплементарных окислит.-восстановит. р-циях с субстратами, для к-рых последовательное одноэлектронное окисление или восстановление термодинамически затруднено. Комплексы переходных металлов, кроме того, иногда облегчают образование своб. радикалов, что обеспечивает возможность катализа радикальных и радикально-цепных р-ций. Металлокомплексные соед. катализируют гидрирование, окисление, полимеризацию, карбонилирование олефинов и ацетиленов, фиксацию азота, диспропорционирование олефинов, активацию и разл. р-ции алканов и др. Типичный механизм металлокомплексного Г. к. рассмотрен на примере каталитич. гидрирования олефинов. Он включает стадии окислит. присоединения Н 2 (1), образование комплекса с олефином (2), внедрение молекулы олефина по связи МЧН (3), восстановит. отщепление алкана (4):
Т. обр., во всех типах Г. к. катализатор, как правило, обеспечивает новый хим. механизм процесса. Каталитич. р-ции происходят в неск. стадий, в одной из к-рых частица катализатора входит в каталитич. цикл, а в другой выделяется в своб. состоянии, чтобы вновь участвовать в р-ции. В этом смысле гомогенно-каталитич. р-ции подобны цепным; их принципиальное отличие заключается в том, что в цепных р-циях скорость образования продукта больше скорости образования активного центра (скорости инициирования цепи) в v раз (v- длина цепи), тогда как в каталитич. процессах скорость образования активного центра катализатора больше скорости образования продукта или этот активный центр присутствует в системе заранее.
Кинетика гомогенно-каталитич. р-ций определяется их механизмом (см. Каталитических реакций кинетика).
Лит.: Гам мет Л., Основы физической органической химии, пер. с англ., М., 1972, с. 407-45; Джен к с В., Катализ в химии и энзимологии, пер. с англ., М., 1972; Литвиненко Л. М., Олейник Н. М., Органические катализаторы и гомогенный катализ, К., 1981; Parshall G. W., Homogeneous catalysis, N.Y., 1980. А. Е. Шилов.
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
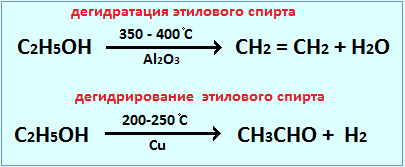
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Гомогенные и гетерогенные катализаторы.



Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. [1]
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать ‘отрицательным катализом’, поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ[править]
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ[править]
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Уравнение Шредингера. Квантовые числа. Модель атома водорода. Сравнить с моделью Бора.
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве (в общем случае, в конфигурационном пространстве) и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Уравнение Шрёдингера предназначено для частиц без спина, движущихся со скоростями много меньшими скорости света.
Квантовые числа– целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему.
Разница между гомогенным и гетерогенным катализатором
Катализаторы бывают многих типов, но в основном их можно разделить на две группы: гомогенные катализаторы и гетерогенные катализаторы. В ключевое отличие между гомогенными и гетерогенными катализатора
Содержание:
Катализаторы бывают многих типов, но в основном их можно разделить на две группы: гомогенные катализаторы и гетерогенные катализаторы. В ключевое отличие между гомогенными и гетерогенными катализаторами заключается в том, что гомогенные катализаторы всегда можно найти в жидкой фазе, тогда как гетерогенные катализаторы можно найти во всех трех фазах вещества: твердой фазе, жидкой фазе и газовой фазе.
СОДЕРЖАНИЕ
Что такое гомогенный катализатор?
Гомогенные катализаторы эффективно активны в условиях низких температур (ниже 250 ° C). Каталитическая активность этих катализаторов умеренная по сравнению с гетерогенными катализаторами. Однако селективность высока. Рециркуляция гомогенного катализатора обходится дорого, поскольку каталитическое восстановление затруднено. Но модификация катализатора проста, потому что он находится в жидкой фазе.
Коэффициент диффузии гомогенных катализаторов высок. Это связано с тем, что все реагенты и катализатор находятся в одной и той же жидкой фазе, и правильное перемешивание приводит к надлежащей диффузии катализатора по реакционной смеси. Гомогенные катализаторы обычно имеют четко определенные активные центры. Это означает, что на поверхности каталитического соединения имеется много подходящих активных центров, с которыми связаны реагенты, и реакция протекает в этих активных центрах.
Что такое гетерогенный катализатор?
Гетерогенные катализаторы представляют собой каталитические соединения, которые находятся в фазе, отличной от фазы реакционной смеси. Эти катализаторы можно найти во всех трех фазах вещества: твердой фазе, жидкой фазе или газовой фазе. Каталитическое восстановление является простым и дешевым в гетерогенных катализаторах, поскольку катализатор находится в фазе, отличной от фазы реакционной смеси. Обычными примерами гетерогенных катализаторов являются металлы, оксиды металлов и т. Д.
Термическая стабильность гетерогенных катализаторов очень хороша по сравнению с гомогенными катализаторами. Эти катализаторы эффективно действуют в условиях высоких температур, порядка 250-500 ° C. Каталитическая активность также высока по сравнению с гомогенными катализаторами. Однако селективность реагентов ниже, чем у гомогенных катализаторов. Активные центры гетерогенных катализаторов четко не определены. Это снижает избирательность.
Коэффициент диффузии гетерогенного катализатора является низким, если площадь поверхности катализатора мала, поскольку катализатор и реакционная смесь находятся в двух фазах. Но отделение катализатора обычно несложно. Тогда переработка катализатора также проста.
В чем разница между гомогенным и гетерогенным катализатором?
Гомогенный против гетерогенного катализатора
Ссылка:
1. Типы катализа, Chemguide, доступно здесь.
2. «Гомогенный катализ». Википедия, Фонд Викимедиа, 25 февраля 2018 г., доступно здесь.
3. «Гетерогенный катализ». Википедия, Фонд Викимедиа, 16 марта 2018 г., доступно здесь.
Изображение предоставлено:
КАТАЛИЗ. ГОМОГЕННЫЙ КАТАЛИЗ
Актуальность темы обусловлена распространенностью каталитических процессов в природе и широким использованием катализаторов в технологических процессах. Также роль катализа неоспоримо велика в биологических системах, поскольку все процессы, проходящие в живых организмах, являются каталитическими.
Цель работы: изучить влияния катализаторов на скорость химических реакций, рассмотреть механизм каталитических процессов в гомогенных системах.
В соответствии с целью работы были поставлены следующие задачи:
— рассмотреть основные понятия химической кинетики;
— изучить факторы, влияющие на скорость протекания химических процессов;
— рассмотреть механизм протекания гомогенных каталитических процессов;
— изучить виды гомогенного катализа;
— изучить кинетику каталитического разложения пероксида водорода.
Теоретическаячасть
Скоростью реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени. Если в момент времени τ1 и τ2 концентрация одного из веществ равны с1 и с2, то среднюю скорость ῡ в интервале времени τ1 и τ2 можно выразить так:
Факторы, влияющие на скорость химической реакции:
— давление для реакций с участием газов;
— площадь поверхности соприкосновения для реакций с участием твердых веществ;
Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции.
Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным.
Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называют гомогенными.
Механизм протекания гомогенных каталитических процессов
Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Вторая стадия для данной реакции является лимитирующей.
Распишем константy равновесия для первой стадии:
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (2) в уравнение (3), получаем
kэфф зависит от природы кислоты и от pH раствора.
В общем основном катализе роль катализатора исполняет молекула основания.
Рассмотрим процесс превращения некоторого субстрата в продукт реакции с участием основания в роли катализатора.
Вторая стадия для данной реакции является лимитирующей.
Распишем константу равновесия для первой стадии:
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (5) в уравнение (6), получаем
kэфф зависит от природы основания и от pH раствора.
Например, специфический кислотный катализ
SH + + H2O →P + H3O + (лимитирующая стадия)
Напишем константу равновесия первой стадии
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (8) в уравнение (9), получаем:
kэфф зависит только от pH раствора.
И специфический основный катализ:
Напишем константу равновесия первой стадии
Так как вторая стадия является лимитирующей, то
Подставляя уравнение (11) в уравнение (12), получаем:
kэфф зависит только от pH раствора.
Многие процессы, идущие в организме человека, катализируются ферментами, например, превращение крахмала в глюкозу, гидролиз эфиров, расщепление белков, разложение пероксида водорода, дегидратация СО2 из крови и др.
Ферменты являются полимерами (белками) или комплексами полимеров с низкомолекулярными соединениями. Размеры их значительно превышают размеры ионов и молекул в растворах, поэтому ферменты иногда называют микрогетерогенными катализаторами.
Механизм их действия имеет свою специфику, например, включает образование комплекса активный центр фермента – реагент по типу «замок – ключ».
Рассмотрим, например, ферментативный гидролиз белков. Широко используют частичный гидролиз под действием пептидаз. Среди пептидаз имеются ферменты, избирательно гидролизующие пептидные связи либо внутри белковой молекулы – эндопептидазы, либо на конце цепи – экзопептидазы, отщепляющие аминокислоту с N- или С-конца. Отдельные пептидазы расщепляют пептидные связи между определенными аминокислотными остатками. Так, трипсин гидролизует пептидные связи, образованные лизином (или аргинином) с другими аминокислотами, пепсин – пептидную связь между двумя аминокислотами с неполярными (гидрофобными) радикалами, например, между валеином и лейцином. Для осуществления полного гидролиза применяют набор ферментов.
В организме белки пищи расщепляются полностью, поскольку для жизнедеятельности используются только свободные α-аминокислоты.
Гомогенный катализ в газовой фазе
Гомогенно-каталитические реакции в газовой фазе протекают обычно по механизму цепных реакций. Примером может служить гомогенный катализ цепной реакции окисления монооксида углерода в диоксид углерода в присутствии следов водяного пара. Реакция начинается с образования атома кислорода (активного центра):
При отсутствии паров воды цепная реакция не развивается, так как активный центр Ȯ не регенерируется:
где М – инертная частица (например, стенка сосуда или примесь в газе), которой передается избыточная энергия. Могут быть и другие реакции с участием активного центра Ȯ, приводящие к обрыву цепи.
В присутствии следов водяного пара в газовой смеси активный центр О вступает в реакцию с молекулой Н2О, в связи с чем протекает разветвленная цепная реакция с регенерацией активных центров ȮН, Ḣ и Ȯ:
H + OH + M → H2O + M (и)
Практическая часть
Изучение кинетики каталитического разложения пероксида водорода
Задача экспериментальной части: определить порядок реакции разложения пероксида водорода и константу скорости реакции.
Для изучения кинетики процесса разложения пероксида водорода в настоящей работе применяется газометрический способ. Количество разложившегося к данному моменту пероксида водорода определяют по объему выделившегося кислорода.
Оборудование и посуда: установка для изучения кинетики (состоит из реакционного сосуда, бюкса, бюретки, уравнительной склянки, термостата, штатива); пипетка, вместимостью 1 мл; пипетка, вместимостью 2 мл; секундомер.
Реактивы: 3% раствор пероксида водорода (аптечный), 1 М раствор иодида калия (катализатор).
Порядок выполнения работы
В бюкс помещается 1 мл раствора иодида калия.
В реакционный сосуд помещается 2 мл раствора пероксида водорода.
Бокс помещается в реакционный сосуд и закрывается пробкой с газоотводной трубкой.
Перемещением уравнительного сосуда вдоль штатива устанавливается одинаковые уровни воды в бюретке и уравнительном сосуде.
Включается секундомер и через каждые 0,5-1,0 мин измеряется объем выделившегося кислорода; перед каждым измерением устанавливается одинаковый уровень воды в бюретке и уравнительном сосуде.
Экспериментальные данные заносятся в таблицу 1.
Ʈ, мин
V выделившегося кислорода, мл
V выделившегося кислорода (с учетом влажности воздуха), мл