Что такое гомогенная химическая реакция
Гомогенные реакции: описание и примеры
Для правильного проведения химических реакций важно знать, в каких условиях они протекают. Гомогенная среда реагентов позволяет определять скорость их взаимодействия. Существуют особые факторы, которые могут замедлять или ускорять гомогенные реакции.
Классификация
Химические взаимодействия можно разделить на разные группы, благодаря присутствию большого числа критериев.
Существуют следующие признаки:
Гомогенная среда
Это однородная система, в которой химические и физические характеристики компонентов в любой ее точке постоянны, а если они изменяются, то в непрерывном темпе, без проявления резких скачков. Все ее части не имеют поверхностного разделения. Так протекают гомогенные химические реакции.
Наличие нескольких реагентов в однородной фазе нельзя визуально определить или отделить их механическим способом. Такая особенность возможна благодаря равномерному распределению составных частиц одного компонента в другом.
К примерам однородных фаз следует отнести газовые смеси, замерзшую воду, растворы в жидкой или твердой форме.
Определение гомогенных взаимодействий
Их еще называют гомофазными реакциями. Это процессы, протекающие в области одной однородной среды, а реагирующие компоненты и получаемые продукты находятся в неизменном состоянии.
Гомогенные реакции имеют величины, которые остаются в одинаковых показателях, а если они меняются, то с непрерывной скоростью.
Когда процессы проходят в области разделения двух фаз, то их называют гетерогенными.
Если реакции многостадийные, то они могут быть смешанного типа. В них начальные этапы протекают в гомогенной среде, а конечные процессы в гетерогенной фазе. Такие взаимодействия чаще всего происходят в природе.
Гомогенные реакции, примеры уравнений
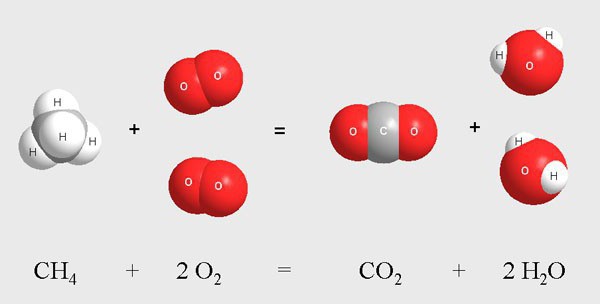
К ним относят процесс хлорирования молекул метана в газовой среде. Данная реакция протекает при высокой температуре или при воздействии ультрафиолета. В результате смешивания метана и хлора происходит поэтапное взаимодействие экзотермического типа.
Промежуточными продуктами являются газообразные вещества, к которым относят молекулы хлорметана, дихлорметана, трихлорметана, хлороводорода. Во время реакции происходит постепенное замещение атомов водорода в метане на атомы хлора. Конечным веществом служит четыреххлористый углерод.
Существуют и одноэтапные гомогенные реакции. Примеры таких взаимодействий указаны ниже.
К гомофазным процессам можно отнести:
Гомогенные реакции достаточно часто протекают в жидкой среде. К ним причисляют процессы галоидирования, расщепления всевозможных сложных соединений на более простые или на радикалы, замещение одних атомов другими по нуклеофильному или электрофильному типу, отщепление частей молекулы или их перегруппировка, удлинение цепочки за счет полимеризации, окислительное взаимодействие. В результате образуются жидкие продукты.
Скорость реакций гомогенных
Протекание того или иного процесса может занимать разные временные промежутки. Важной характеристикой такого взаимодействия является скорость гомогенной реакции. Представляет она числовую величину, которая определяет изменение концентрации любого реагента за временной промежуток.
Ее можно охарактеризовать по-другому: как значение, устанавливающее перемену количества взаимодействующего компонента в заданном объеме за определенное время. Главным условием является отсутствие изменения массы в системе.
При расчете скорости реакции в гомогенной среде (обозначают как Vi) используют убыль или прирост молярного количества реагирующего вещества (Ci) за определенное время (t). Существует специальная формула расчета:
Для химического процесса HCl + NaOH → NaCl + H2O быстроту протекания можно определить по уменьшению концентрации каждого реагента (соляной кислоты или натрия гидроксида) или по увеличению количества продуктов превращения (натрия хлорида или воды) за временной промежуток при постоянных температурных условиях.
Для определения скорости гомогенных реакций концентрацию берут в молях на литр, а время измеряют в секундах. Расчет производится следующим образом:
Vi = ± Ci / t = − [HCl] / t = − [NaOH] / t = [NaCl] / t = [H2O] / t.
Факторы, влияющие на скорость
Гомогенной является реакция, у которой быстрота протекания данного процесса прямо пропорциональна заданному веществу в единице объема. Чем больше молекул задействовано, тем быстрее осуществляется взаимодействие.
Основными факторами, влияющими на скорость процессов в однородной среде, являются концентрация реагентов и продуктов реакции, их химическая природа, температурные условия, давление в реакционном объеме, а также наличие ускорителей, катализирующих изменения.
Зависимость быстроты протекания реакций от нагревания была установлена ученым Вант-Гоффом. Согласно его утверждению, каждое температурное повышение на 10° увеличивает в гомогенных реакциях скорость в 2 или 4 раза. В более теплой среде молекулы начинают активнее двигаться, сталкиваться друг с другом, что приводит к их взаимодействию.
Гомогенные реакции со временем протекают с разной интенсивностью, поэтому их скорости могут быть истинными (в определенный момент) и средними, что следует учитывать при расчетах.
ГОМОГЕННЫЕ РЕАКЦИИ
Кинетич. особенности и механизм Г. р. определяются условиями взаимод. реагентов в данной фазе. Важный тип Г. р.-цепные реакции.
Смотреть что такое «ГОМОГЕННЫЕ РЕАКЦИИ» в других словарях:
ГОМОГЕННЫЕ РЕАКЦИИ — (от греч. «homogenes» однородный), химические реакции между веществами, находящимися в одной фазе. Параметры гомогенных реакций имеют одинаковые значения или изменяются непрерывно. Их скорость определяется изменением концентрации одного из… … Энциклопедический словарь
гомогенные реакции — – химические реакции, реализующиеся полностью в одной фазе. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Большой Энциклопедический словарь
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
реакции химические — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних в в в другие, отличные по хим. составу и (или) строению. Характеризуются стехиометрич. соотношением участвующих в них в в, степенью превращения, константами скорости и равновесия, энергией активации, тепловым эффектом. Р. х.… … Естествознание. Энциклопедический словарь
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ — (от греч. «katalysis» разрушение), гомогенные (см. ГОМОГЕННЫЕ РЕАКЦИИ) и гетерогенные (см. ГЕТЕРОГЕННЫЕ РЕАКЦИИ) химические реакции, протекающие с участием катализатора (см. КАТАЛИЗАТОРЫ). В зависимости от положительного или отрицательного… … Энциклопедический словарь
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ГОМОГЕННЫЕ РЕАКЦИИ
Смотреть что такое «ГОМОГЕННЫЕ РЕАКЦИИ» в других словарях:
гомогенные реакции — – химические реакции, реализующиеся полностью в одной фазе. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
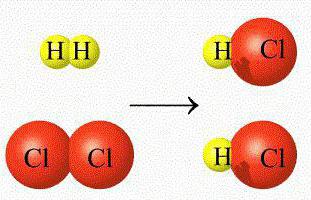
ГОМОГЕННЫЕ РЕАКЦИИ — хим. р ции, протекающие полностью в одной фазе. Примеры Г. р. в газовой фазе: термич. разложение оксида азота 2N2O5 > 4NO2 + О 2; хлорирование метана СН 4 + С12 > СН 3 С1 + НС1; горение этана 2С 2 Н б + 7О 2 > 4СО 2 + 6Н 2 О; образование озона в… … Химическая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Большой Энциклопедический словарь
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
реакции химические — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних в в в другие, отличные по хим. составу и (или) строению. Характеризуются стехиометрич. соотношением участвующих в них в в, степенью превращения, константами скорости и равновесия, энергией активации, тепловым эффектом. Р. х.… … Естествознание. Энциклопедический словарь
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ — (от греч. «katalysis» разрушение), гомогенные (см. ГОМОГЕННЫЕ РЕАКЦИИ) и гетерогенные (см. ГЕТЕРОГЕННЫЕ РЕАКЦИИ) химические реакции, протекающие с участием катализатора (см. КАТАЛИЗАТОРЫ). В зависимости от положительного или отрицательного… … Энциклопедический словарь
Скорость реакции, ее зависимость от различных факторов
Теория к заданию 20 из ЕГЭ по химии
Скорость химических реакций, ее зависимость от различных факторов
Гомогенные и гетерогенные химические реакции
Химические реакции протекают с различными скоростями: с малой скоростью — при образовании сталактитов и сталагмитов, со средней скоростью — при варке пищи, мгновенно — при взрыве. Очень быстро проходят реакции в водных растворах, практически мгновенно. Смешаем растворы хлорида бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно, горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, медленно гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики — науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например, в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции ($v_<гомог.>$) определяется как изменение количества вещества в единицу времени в единице объема:
Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
если объем системы не меняется. Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
Если при какой-либо протекающей реакции экспериментально измерять концентрацию исходного вещества в разные моменты времени, то графически можно отобразить ее изменение с помощью кинетической кривой для этого реагента.
Скорость реакции не является постоянной величиной. Мы указывали лишь некоторую среднюю скорость данной реакции в определенном интервале времени.
Представьте себе, что мы определяем скорость реакции
Изменение количества вещества, по которому определяют скорость реакции, — это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того, чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться, причем столкнуться эффективно: не разлететься, как мячики, в разные стороны, а так, чтобы в частицах разрушились или ослабли старые связи и смогли образоваться новые, а для этого частицы должны обладать достаточной энергией.
В заключение сделаем вывод: многие возможные реакции практически не идут, т.к. высока энергия активации.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Температура
Вам известно, что при повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. Х. Вант-Гофф сформулировал правило:
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля активных молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
Математически эта зависимость выражается соотношением:
Однако для увеличения скорости реакции повышение температуры не всегда применимо, т.к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества.
Концентрация реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульденбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности, и их концентрации обычно являются постоянными.
Например, для реакции горения угля
выражение скорости реакции должно быть записано так:
т. е. скорость реакции пропорциональна только концентрации кислорода.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентраций исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами (от лат. katalysis — разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), а по известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее. Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые называют селективными. Ясно, что нет необходимости сжигать аммиак и азот, зато оксид азота (II) находит применение в производстве азотной кислоты.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными количественно и качественно.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (каталитические преобразователи, превращающие оксиды азота выхлопных газов автомобиля в безвредный азот).
Различают два вида катализа.
Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Гетерогенный катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
При производстве метанола используют твердый цинкохромовый катализатор ($8ZnO·Cr_2O_3×CrO_3$):
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате реакция резко замедляется и затем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксида водорода, мономеры для предотвращения преждевременной полимеризации, соляную кислоту, чтобы была возможность ее транспортировки в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться, например, радиоактивным излучением.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала ($ 120$ кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации имеют промежуточные значения ($40–120$ кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих на поверхности веществ, т.е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
Увеличение скорости реакции объясняется, в первую очередь, увеличением поверхности соприкосновения исходных веществ, а также рядом других причин, например, разрушением структуры правильной кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на гладкой поверхности.
В промышленности для проведения гетерогенных реакций используют кипящий слой, чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью кипящего слоя проводят обжиг колчедана; в органической химии с применением кипящего слоя проводят каталитический крекинг нефтепродуктов и регенерацию (восстановление) вышедшего из строя (закоксованного) катализатора.