Что такое глюкуроновая кислота
Что такое глюкуроновая кислота
Биополимеры полисахаридной структуры – важнейший класс природных соединений, находящих практическое использование в различных областях науки и техники [10].
Сегодня микробные полисахариды находят широкое применение в самых различных сферах человеческой деятельности, от медицины до металлургии. Наиболее известным является ксантан – внеклеточный полисахарид бактерии Xanthomonas Campestris. Ксантан используют как добавку, улучшающую качество самых различных продуктов и технологических операций. Чаще всего его применяют для повышения нефтедобычи, при буровых работах, для повышения урожайности, а также в пищевой, фармацевтической и косметической промышленности [5].
Известно, что ксантан состоит из двух D-глюкопиранозильных звеньев, двух D-маннопиранозильных звеньев и звена D-глюкопиранозилуроновой кислоты [9], степень ветвления и ацетилирования полисахарида зависит от штамма продуцента, благодаря чему биополимер приобретает различные характеристики и свойства. В чистом виде ксантан представляет собой мягкий пушистый порошок белого или кремового цвета. Неорганические элементы составляют около 5,5 % [7]. Процентный состав нейтральных и кислых сахаров зависит от способа выделения ксантана [12], поэтому для его использования в пищевой, медицинской и косметической промышленности важно контролировать количество нейтральных и кислых сахаров.
Для определения кислых сахаров в образце ксантана используют карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул полисахаридов концентрированной серной кислотой. Данный метод обладает рядом недостатков, таких как длительность подготовки эксперимента, использование вредных и концентрированных кислот и щелочей [6].
Существующие методы анализа, такие как фенол-серный, карбазол-серный методы и др., не всегда обладают хорошей воспроизводимостью результатов, трудоемки, дорогостоящи и часто малопригодны для использования в надлежащей лабораторной практике [2, 11, 8]. На сегодняшний день отсутствуют комплексные подходы по исследованию ксантана инструментальными методами анализа для его использования в медицинской, пищевой и технической сферах. В этой связи востребованными являются комплексные экспериментальные исследования, обладающие удовлетворительными валидационными параметрами.
Цель работы – исследование химического состава ксантана инструментальными методами анализа, а именно определение нейтральных и кислых сахаров.
Материалы и методы исследования
В качестве модельного объекта исследования использовался коммерческий образец пищевого ксантана («Company Plasma Product Specification», Китай).
Измерения оптической плотности проводили на УФ-спектрофотометре Cary 60 (Agilent Technologies, Германия) в кварцевых кюветах 10 мм.
Регистрацию ИК-спектров проводили на ИК-спектрометре Agilent 660 FTIR (Agilent Technologies, Германия).
Определение нейтральных сахаров в пересчете на глюкозу в ксантане
При определении нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали фенол-серный метод, основанный на реакции взаимодействия оксиметилфурфурола с фенолом в концентрированной серной кислоте [4]. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий спектр поглощения в видимой области. Для определения нейтральных сахаров готовили растворы с концентрациями 20 мг/см3, 50 мг/см3, 80 мг/см3, 100 мг/см3. Затем к полученным растворам добавляли по 5 см3 воды и проводили измерение оптической плотности при 483±2 нм [16].
Определение кислых сахаров в пересчете на глюкуроновую кислоту в ксантане
При определении кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана использовали карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул концентрированной серной кислотой [15]. Для определения кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана готовили раствор с концентрацией 100 мг/см3. Измерение оптической плотности проводили при 525 ± 2 нм [16].
Результаты исследования и их обсуждение
Определение структуры ксантана
Для установления структуры ксантана и его идентификации использовали метод ИК-спектроскопии.
В качестве стандартного вещества был использован ксантан («Sigma-Aldrich», США) с высокой стабилизирующей активностью, высокой растворимостью, высокой вязкостью даже при маленьких концентрациях.
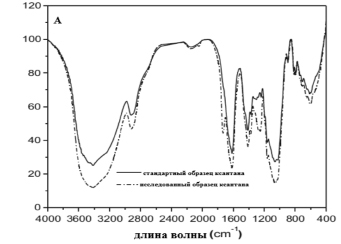
На рис. 1 представлены ИК-спектры стандартного вещества ксантана и исследуемого образца ксантана.
Рис. 1. ИК-спектры стандартного и исследуемого образцов ксантана
При сравнении стандартного образца ксантана и исследуемого образца ксантана очевидно, что некоторые полосы поглощения образца коммерческого ксантана и стандартного образца ксантана совпадают, что указывает на идентичность стандартного образца ксантана исследуемому.
Так, на ИК-спектре имеется область отпечатков пальцев при 1200–850 см-1, которая соответствует области «отпечатков пальцев» пектиновых веществ как для стандартного образца ксантана, так и для исследуемого образца.
Кроме того, ИК-спектр исследуемого образца ксантана показывает наличие свободных, а также неэтерифицированных карбоксильных групп.
Кроме того, имеются полосы поглощения 1416, 1331 и 1240 см-1, которые являются областью «отпечатков пальцев» глюкуроновой кислоты, которые характерны как для стандартного образца ксантана, так и для исследуемого образца. Использованный метод ИК-спектроскопии позволяет судить о том, что ксантан является кислым сахаром, содержащим глюкуроновую кислоту.
Определение глюкозы и глюкуроновой кислоты является обязательным этапом контроля образца ксантана, для установления его состава, также по количеству процентного содержания глюкозы в образце ксантана, говорит о том, что при его получении источником углеродного питания являлись глюкоза и глюкуроновая кислота [3, 13].
Определение нейтральных сахаров
Определение нейтральных сахаров в образцах ксантана проводили при помощи фенол-серного метода. В основу количественного определения нейтральных сахаров в пересчете на глюкозу в исследуемом образце положена реакция взаимодействия оксиметилфурфурола с фенолом в среде серной концентрированной кислоты. Сначала под воздействием концентрированной серной кислоты глюкоза дегидратируется в течение 45 минут до образования оксиметилфурфурола. А далее при действии фенола на оксиметилфурфурол образуется ауриновый краситель, имеющий в видимой области спектра максимум поглощения λmax 483–485 нм [16].
Для точного определения процентного содержания нейтральных сахаров в пересчете на глюкозу в образце ксантана использовали только свежеприготовленные растворы глюкозы, а также раствор 5 % фенола, т.к. раствор фенола достаточно быстро окисляется на свету. Использовали метод сравнения со стандартным раствором глюкозы.
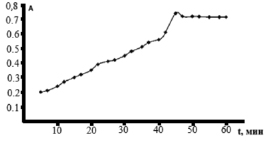
На рис. 2 представлена зависимость величины оптической плотности оксиметилфурфурола от времени его формирования.
Рис. 2. Зависимость величины оптической плотности оксиметилфурфурола от времени его формирования
Замечено, что оксиметилфурфурол формируется в концентрированной серной кислоте в течение 45 мин (рис. 2), тогда как образование ауринового красителя при действии фенола происходит сразу при внесении фенола в реакционную среду. Формирование оксиметилфурфурола завершается к 45 мин и сохраняется величиной постоянной.
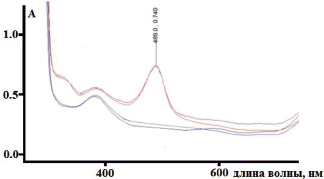
На рис. 3 представлен спектр поглощения в видимой области ауринового красителя, с концентрацией стандартного раствора глюкозы 25 мг/см3. Полоса поглощения ауринового красителя соответствует 489 нм.
Рис. 3. Cпектр поглощения в видимой области ауринового красителя с концентрацией глюкозы 0 мг/см3 (1), 25 мг/см3 (2)
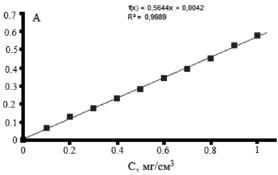
На рис. 4 представлен градуировочный график зависимости оптической плотности раствора глюкозы от ее концентрации при 489 нм. Прямолинейная зависимость наблюдалась в области концентраций глюкозы от 0,1 до 1,0 мг/см3.
Рис. 4. Зависимости оптической плотности раствора глюкозы от ее концентрации в растворе
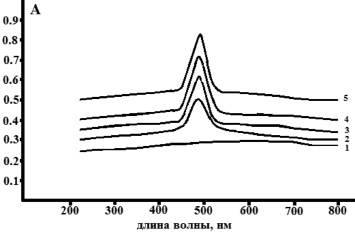
Рис. 5. Спектр поглощения в видимой области исследуемых растворов ксантана разных концентраций: 0 мг/см3 (1), 20 мг/см3 (2), 50 мг/см3 (3), 80 мг/см3 (4), 100 мг/см3 (5)
На рис. 5 представлен спектр поглощения в видимой области исследуемых образцов ксантана, разных концентраций.
Содержание нейтральных сахаров в пересчете на глюкозу в образце ксантана составило 52,0 ± 3 %. Известно, что содержание нейтральных сахаров в пересчете на глюкозу в образцах ксантана может варьироваться от 35 до 80 %.
Таким образом, рабочими условиями для количественного определения нейтральных сахаров в пересчете на глюкозу в образце ксантана являются:
– время выдерживания в концентрированной серной кислоте 45 мин;
– максимум поглощения ауринового красителя при 485 нм;
– свежеприготовленные 5 % раствор фенола и раствор глюкозы в день эксперимента.
Определение глюкуроновой кислоты
Для увеличения селективности определения глюкуроновой кислоты в образце ксантана и уменьшения влияния нейтральных сахаров на результаты определения глюкуроновой кислоты карбазол-серным методом разрушение полимерной молекулы проводили концентрированной серной кислотой в присутствии сульфаминовой кислоты, которая препятствует реакции карбазола с альдозами, образовавшимися при гидролизе полисахаридов.
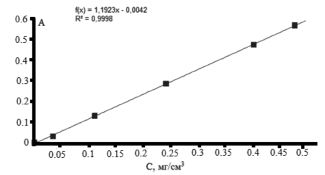
На рис. 6 представлена зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах. Прямолинейная зависимость наблюдалась в области концентраций глюкуроновой кислоты от 0,03 до 0,5 мг/см3. Общее содержание глюкуроновой кислоты в исследуемом образце ксантана определяли по методу градуировочного графика. Содержание глюкуроновой кислоты в исследуемом образце ксантана в пересчете на % составило 24,79 ± 1,24 %. Известно, что содержание глюкуроновой кислоты в образце ксантана составляет от 5 до 40 %.
Следует отметить, что данная методика трудоемка, длительна, требует использования вредных концентрированных кислот и щелочей и занимает 6 ч. Кроме того, результаты плохо воспроизводятся.
В связи с этим в качестве альтернативы определения кислых сахаров в ксантане предложен метод потенциометрического титрования раствором 0,1 Н KOH [16].
Потенциометрическое титрование образца ксантана проводили в водном растворе. Методика заключалась в следующем: навеску ксантана 0,0100 г растворяли в 10 мл воды в стакане для титрования емкостью 50 мл. Для непрерывного перемешивания использовали магнитную мешалку. Электрохимическая ячейка состояла из стеклянного и хлоридсеребряного электродов. В качестве титранта использовали 0,1 Н раствор щелочи KOH. Измерение рН производили через каждые 0,2 мл добавки титранта. Точку эквивалентности определяли по методу Грана [1, 14].
Рис. 6. Зависимость оптической плотности комплекса карбазола с кислыми сахарами при λ = 525 нм от концентрации глюкуроновой кислоты в стандартных растворах
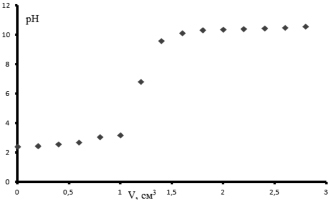
Рис. 7. Кривая потенциометрического титрования образца ксантана
На рис. 7 представлена кривая потенциометрического титрования образца ксантана.
При использовании потенциометрической индикации конечной точки титрования возникают трудности, связанные с отсутствием четко выраженных перегибов на кривых титрования функциональных групп кислотного характера, что требует последующей математической обработки результатов, такой как построение кривых Грана [14, 15]. Все кривые потенциометрического титрования образца ксантана обработаны по методу Грана.
На рис. 8 представлен пример определения конечной точки титрования по методу Грана образца ксантана (зависимость величины G от объема титранта):
G = (W + V)·10-Е – для кислой среды;
G = (W + V)·10(E-14) – для щелочной среды,
где V – объем титранта, мл; E – значения потенциала, В; W – начальный объем пробы, мл.
На основании рис. 8 конечная точка титрования равна объему 1,2 мл, что соответствует количеству глюкуроновой кислоты 23,13 ± 1,6 мг/см3.
Сравнительное содержание глюкуроновой кислоты в образце ксантана, полученное потенциометрическим титрованием и карбазол-серным методом, представлено в таблице.
Сравнительное содержание глюкуроновой кислоты в образце ксантана методом потенциометрического титрования и карбазол-серным методом
Карбазол-серный метод, мг/см3
Согласно таблице количество глюкуроновой кислоты, определенное двумя методами, согласуется между собой, однако результаты определения глюкуроновой кислоты карбазол-серным методом имеют завышенные значения, что связано с мешающим влиянием нейтральных сахаров на результаты определения глюкуроновой кислоты. Метод потенциометрического титрования может быть использован для определения количества свободных неэтерифицированных карбоксильных групп, т.к. достаточно прост в исполнении, нет необходимости в использовании дополнительных реактивов.
Заключение
Методом ИК-спектроскопии проведена идентификация структуры образца ксантана. Выявлено, что ксантан содержит кислые сахара. Подобраны рабочие условия определения нейтральных сахаров в пересчете на глюкозу в образце ксантана фенол-серным методом. Количество нейтральных сахаров в пересчете на глюкозу в исследуемом образце ксантана составило 52,0 ± 3 %. Проведено сравнительное определение кислых сахаров в пересчете на глюкуроновую кислоту в образце ксантана карбазол-серным методом и потенциометрическим титрованием. Количество кислых сахаров в пересчете на глюкуроновую кислоту в исследуемом образце ксантана составило 24,79 ± 1,24 мг/см3.
Глюкуроновая кислота
Из Википедии — свободной энциклопедии
наименование
Глюкуроновая кислота (от глюкоза и др.-греч. οὖρον — моча) — одноосновная органическая кислота, относящаяся к группе уроновых кислот.
Свойства глюкуроновой кислоты аналогичны свойствам глюкозы, но вследствие наличия в её молекуле карбоксильной группы, она способна образовывать лактоны и соли. При нагревании глюкуроновая кислота дегидратируется и декарбоксилируется.
Глюкуроновая кислота способна образовывать растворимые конъюгаты (глюкурониды) со спиртами, фенолами, карбоновыми кислотами, тиолами, аминами и рядом других веществ, за счёт чего достигается их обезвреживание (снижение токсичности) и выведение из организма.
Место желчегонных препаратов в клинической практике
Желчь представляет собой изоосмотическую жидкость, состоящую из воды, электролитов, органических веществ (желчных кислот и солей, холестерина, конъюгированного билирубина, цитокинов, эйкозаноидов и др.) и тяжелых металлов, в частности меди. Общее колич
Желчь представляет собой изоосмотическую жидкость, состоящую из воды, электролитов, органических веществ (желчных кислот и солей, холестерина, конъюгированного билирубина, цитокинов, эйкозаноидов и др.) и тяжелых металлов, в частности меди. Общее количество продуцируемой печенью желчи в сутки составляет в среднем 600 мл. Основными органическими компонентами желчи являются желчные кислоты, которые поступают из двух источников.
В печени и кишечнике могут образовываться и третичные желчные кислоты (сульфометахолевая, урсодезоксихолевая), которые так же, как и вторичные, участвуют в энтерогепатической циркуляции.
Желчь выполняет в организме две важнейшие биологические функции:
Основные компоненты желчи как билиарного секрета представлены в таблице 1, а как билиарного экскрета — в таблице 2.
Билиарная экскреция является единственным путем выведения из организма растительных стеролов, таких, как ситостерол, а также ксенобиотиков, присутствующих в растениях, препятствуя их накоплению в организме. Все они, а также ряд липофильных лекарств — метаболитов жирорастворимых витаминов и стероидных гормонов — в гепатоците конъюгируются с глютатионом, сульфатами, глюкуроновой кислотой, реже — с глюкозой, ксилозой, глицином или таурином и выделяются в желчь. Данные компоненты желчи, и в первую очередь растительные стеролы, благодаря конъюгации с глютатионом, увеличивают концентрацию органических анионов в каналикулах и участвуют в формировании фракции желчи, независимой от желчных кислот, и таким образом оказывают желчегонный эффект.
Формирование желчи складывается из следующих этапов:
В гепатоците из холестерина синтезируются две первичные желчные кислоты: холевая и хенодезоксихолевая, которые конъюгируются с аминокислотами — глицином или таурином. Конъюгация обеспечивает их растворимость в воде даже при кислых значениях рН, делает их устойчивыми к преципитации ионами кальция и снижает их проницаемость через клеточные мембраны. В гепатоцит из энтерогепатической циркуляции также поступают первичные конъюгированные и деконъюгированные желчные кислоты. Первые в неизмененном виде, а вторые после реконъюгации вновь секретируются в желчь. Вторичные желчные кислоты — дезоксихолевая и литохолевая, которые являются продуктами микробного метаболизма соответственно из холевой и хенодезоксихолевой кислот, попадая из энтерогепатической циркуляции в гепатоцит, конъюгируются. Дезоксихолевая кислота связывается с глицином или таурином и циркулируется вместе с первичными желчными кислотами.
Литохолевая кислота наряду с глицином и таурином конъюгируется и с сульфатами, что резко снижает ее всасывание и поступление в энтерогепатическую циркуляцию. Последнее имеет огромное биологическое значение, а именно: сохранение целостности гепатоцитов и билиарного эпителия. Реже в энтерогепатическую циркуляцию включается урсодезоксихолевая кислота, которая является продуктом микробной модификации первичных желчных кислот. Максимальное содержание ее в общем пуле желчных кислот не превышает 5%.
Внутриклеточный транспорт желчных кислот от базолатеральной до каналикулярной мембраны гепатоцита осуществляется цитозольными протеинами (3-α-гидроксистероиддегидрогеназа и др.). В этот процесс также вовлекаются эндоплазматический ретикулум и аппарат Гольджи. Большое значение придается трансцитозольному везикулярному транспорту желчных кислот, билирубина и липидсодержащих субстанций. Время прохождения компонентов желчи от базолатеральной до каналикулярной мембраны составляет около 10 мин.
Каналикулярная секреция является наиболее важным этапом формирования желчи. Компоненты желчи поступают в каналикулы четырьмя путями:
Экскреция компонентов желчи из гепатоцитов осуществляется с участием АТФ-зависимых транспортных белков, способных перемещать компоненты желчи из цитоплазмы в просвет канальцев против градиента концентраций.
В результате их функционирования в канальцы поступают желчные кислоты и их соли, а также ряд других осмотически активных веществ (глутатион, бикарбонаты). Последние участвуют в формировании зависимой и независимой от желчных кислот фракций желчи, составляющих по 225 мл/сут каждая. Вода диффундирует в канальцы по осмотическому градиенту из синусоидов через плотные межклеточные соединения, в среднем 150 мл/сут.
Те соединения, которые активно транспортируются в каналикулы из гепатоцитов и участвуют в формировании желчи, обозначаются как первичные компоненты желчи (конъюгированные желчные кислоты, органические анионы и др.). Они не способны проходить через межклеточные соединения канальцев. Первичные компоненты желчи, и в первую очередь желчные кислоты, обладают холеретической активностью. Молекулы, которые поступают в каналикулы пассивно через межклеточные соединения, обозначаются как вторичные компоненты желчи. В их состав входят вода, электролиты, глюкоза, ионы кальция.
Ток желчи в каналикулах обеспечивается активной каналикулярной секрецией и сокращением периканаликулярных нитей актина, которые индуцируются конъюгированными желчными кислотами. Из каналикул желчь через промежуточные канальцы Геринга поступает в экстралобулярные желчные протоки, которые, соединяясь между собой, образуют долевые, а затем и общий желчный проток.
Во время прохождения желчи по внутрипеченочным желчным протокам состав ее изменяется: через межклеточные соединения протокового эпителия в просвет диффундирует вода; холангиоцитами абсорбируются глюкоза и некоторые органические кислоты; происходит гидролиз глютатиона до аминокислот, которые частично всасываются. При появлении в желчи неконъюгированных желчных кислот последние всасываются пассивно холангиоцитами и поступают в гепатоцит через перидуктулярные капилляры (холегепатическая циркуляция желчных кислот). Под влиянием секретина и глюкагона происходит активная секреция бикарбонатов и отмечается увеличение содержания IgA и слизи.
В результате пузырная желчь может содержать анионы в концентрации, превышающей 200 ммоль, и оставаться изотоничной.
Во время приема пищи желчный пузырь опорожняется и в течение 30–45 мин остается в сокращенном, а сфинктер Одди — в расслабленном состоянии. В этот период слизистой оболочкой в просвет желчного пузыря секретируются вода и электролиты, что способствует вымыванию из него всех накопившихся субстанций, а в двенадцатиперстную кишку непрерывно поступает печеночная желчь. При отсутствии желчного пузыря в межпищеварительный период печеночная желчь депонируется в проксимальных отделах тонкой кишки, главным образом в двенадцатиперстной кишке, а после еды поступает в дистальные отделы. Избыточное содержание слабоконцентрированной желчи в двенадцатиперстной кишке с развитием дуоденальной гипертензии является одним из механизмов развития болевого синдрома и диспепсических расстройств у больных, перенесших холецистэктомию.
После поступления желчи в тонкую кишку метаболизм и скорость транзита каждого из ее компонентов существенно различаются. Так, скорость транзита желчных кислот значительно ниже, чем других компонентов желчи. Лишь незначительная часть желчных кислот (не более 5%) теряется с калом, основная их масса всасывается и вступает в энтерогепатическую циркуляцию.
В проксимальных отделах тонкой кишки часть конъюгированных с глицином желчных кислот всасывается пассивно. Основная масса желчных кислот активно абсорбируется с участием специфического белка-переносчика (идеальный транспортер для желчных кислот), который локализуется на апикальной поверхности энтероцитов.
В дистальных отделах тонкой кишки и в толстой кишке желчные кислоты подвергаются микробной деконъюгации и легко абсорбируются.
Поступая в портальную кровь, основная масса желчных кислот (70–90%) связывается с альбумином и возвращается в печень, где они захватываются гепатоцитами, конъюгируются и вновь транспортируются в билиарную систему и кишечник. В результате вышеуказанной энтерогепатической циркуляции в организме формируется пул желчных кислот, равный приблизительно 5 ммоль с периодом полураспада в 2–3 дня.
Ведущая роль в регуляции холереза принадлежит гастроинтестинальным гормонам — холецистокинину и секретину. Холецистокинин секретируется гормональными клетками двенадцатиперстной кишки. Основные его эффекты сводятся:
Продукцию холецистокинина, а следовательно, продукцию желчи стимулируют жиры, особенно с наличием жирных кислот с длинной цепью (жареные продукты), белки, кислоты, составные компоненты желчегонных трав (алкалоиды, протопин, сангвинарин, эфирные масла, жиры и др.), холинергические стимулы.
Секретин, продуцирующийся в двенадцатиперстной кишке, стимулирует секрецию воды, электролитов и бикарбонатов эпителием билиарных и панкреатических протоков и потенцирует эффекты холецистокинина. Основными стимуляторами выделения секретина являются соляная кислота, жиры, желчные кислоты и, возможно, растительные алкалоиды и стеролы.
В регуляции желчеобразования и желчевыведения определенная роль принадлежит давлению в желчных протоках (в норме — 15–20 см водного столба). При повышении давления в протоках секреция желчи снижается, а при достижении уровня 35 см водяного столба полностью прекращается секреция билирубина, желчных кислот и воды.
Медикаментозная коррекция процессов желчеобразования возможна на различных его этапах.
В клинической практике широко используются препараты, усиливающие продукцию желчи и ее поступление в кишечник. Желчегонные средства могут оказывать на функции пищеварительного тракта как положительные, так и отрицательные эффекты, если не учтены все показания и противопоказания к их назначению.
Механизм действия желчегонных препаратов сводится:
При назначении желчегонного средства необходимо четко представлять следующее:
В зависимости от ведущего механизма действия желчегонные средства подразделяются на препараты, усиливающие продукцию желчи — холеретики и обеспечивающие поступление желчи из желчного пузыря в кишечник — холекинетики. Холеретики включают две группы препаратов:
В группу холекинетиков включены препараты, стимулирующие сократительную функцию желчного пузыря и снижающие тонус сфинктера Одди: сернокислая магнезия, многоатомные спирты, никодин, гимекромон, домперидон, — и ряд растительных препаратов (гепабене, берберин, сибектан и др.). Миотропные спазмолитики, расслабляя тонус сфинктеров билиарного тракта и улучшая отток желчи в двенадцатиперстную кишку, формально также можно рассматривать как желчегонные средства. Ряд желчегонных средств оказывает сочетанные эффекты: холеретический, холецистокинетический и спазмолитический в отношении сфинктера Одди.
Основными показаниями для применения желчегонных препаратов являются:
Желчегонные препараты, содержащие соли желчных кислот, а также синтетического и растительного происхождения существенно увеличивают функциональную нагрузку на гепатоциты, истощают в них содержание детоксицирующих субстанций и антиоксидантов (глютатион, сульфаты и др.). Особенно это касается многокомпонентных составов лечебных трав (желчегонные, слабительные, успокаивающие сборы), а также растительных средств китайского и тибетского происхождения. При назначении желчегонных препаратов необходимо удостовериться в отсутствии блокады тока желчи на этапах «печеночная клетка–внутри- и внепеченочная билиарная система».
Абсолютными противопоказаниями к назначению желчегонных средств являются все варианты холестаза: внутрипеченочный (гепатоцеллюлярный, каналикулярный, дуктулярный) и внепеченочный с желтухой и без желтухи. Исключением является использование урсодезоксихолевой кислоты при внутрипеченочном холестазе.
При назначении препаратов, содержащих желчные кислоты, за исключением урсодезоксихолевой кислоты, следует учитывать, что они противопоказаны при активных гепатитах и циррозах печени любой этиологии, язвенной болезни и эрозиях слизистой оболочки желудочно-кишечного тракта, панкреатитах и поносах, не связанных со стеатореей. Желчегонные средства растительного происхождения не следует использовать при панкреатитах, кроме паренхиматозных (безболевые формы), при гепатитах и циррозах печени с наличием активности и признаков печеночно-клеточной недостаточности, при синдроме раздраженного кишечника с преобладанием диареи.
При хронических заболеваниях печени использование желчегонных препаратов, в состав которых включен гепатопротектор, в частности силимарин, является актуальным. Силимарин входит в группу флавоноидов. Многочисленные экспериментальные и клинические исследования позволили уточнить основные механизмы действия данного препарата.
Таким образом, одновременное назначение силимарина и желчегонных средств может нивелировать отрицательный эффект последних на гепатоциты и открывает возможность для их использования при токсикометаболических и других поражениях печени, протекающих без холестаза и при отсутствии высокой активности и аутоиммунных расстройств.
Выбор препарата определяется индивидуально, и в каждом конкретном случае необходимо решать, назначать ли препарат, содержащий желчь, или средство растительного происхождения в виде монотерапии или в комплексном лечении. Ниже приведены ориентировочные схемы лечения заболеваний билиарной системы с использованием желчегонных средств.
I. Гипомоторная дискинезия желчного пузыря при нормальной моторной функции желудочно-кишечного тракта или в сочетании с гастро- и/или дуоденостазом:
При наличии симптомов бактериальной контаминации тонкой кишки — антибактериальные средства: фуразолидон или эрсефурил, или интетрикс, или ципрофлоксацин, или сульгин и другие в общепринятых дозах в течение 5–7 дней.
II. Гипомоторная дискинезия желчного пузыря и толстой кишки:
III. Гипомоторная дискинезия желчного пузыря в сочетании с гипермоторной функцией кишечника (поносы):
IV. Гипермоторная дискинезия желчного пузыря:
V. Хронический бескаменный холецистит:
VI. Желчнокаменная болезнь, I стадия (наличие в желчном пузыре неоднородной желчи и/или билиарного сладжа):
VII. Дисфункция сфинктера Одди (постхолецистэктомический синдром):
VIII. Токсико-метаболические поражения печени без признаков внутрипеченочного холестаза (жировой гепатоз, стеатогепатит при эндокринных заболеваниях, при патологии тонкой кишки, хронические гепатиты низкой активности токсического генеза, компенсированные циррозы печени). Одним из компонентов комплексной терапии может быть комбинированный желчегонный препарат с гепатопротекторным эффектом, назначаемый в течение 2–4 нед.
При всех вышеуказанных нарушениях билиарной системы наряду с представленной симптоматической терапией проводится этиологическое и патогенетическое лечение основного и сопутствующих заболеваний, используются физиотерапевтические и бальнеологические процедуры, большая роль отводится диетическому питанию.
Таким образом, проблема коррекции желчеобразования и желчевыведения является актуальной. Для ее решения предложено огромное количество желчегонных средств, как с доказанной, так и с недостаточно доказанной, а также с неустановленной эффективностью. Помимо официальных препаратов в клинической практике используется большое количество трав, в том числе и в виде различных сборов, которые не прошли серьезной контролированной клинической апробации как каждого их компонента отдельно, так и суммарно на эффективность и токсичность. Во многих литературных источниках желчегонный эффект трав отождествляется с гепатопротекторным и даются рекомендации (что недопустимо и опасно) по их использованию при холестазах, вирусных поражениях печени, хронических панкреатитах и других заболеваниях, при которых желчегонные противопоказаны.
Литература
Э. П. Яковенко, доктор медицинских наук, профессор
П. Я. Григорьев, доктор медицинских наук, профессор
Н. А. Агафонова, кандидат медицинских наук, доцент
А. В. Яковенко, кандидат медицинских наук, доцент