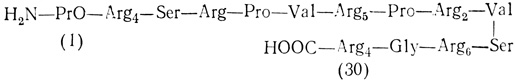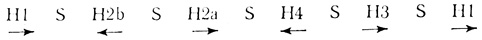Что такое гистоновые белки
Гистоны
Гистоны — основной класс нуклеопротеинов, ядерных белков, необходимых для сборки и упаковки нитей ДНК в хромосомы. Существует пять различных типов гистонов, названных H1/Н5, H2A, H2B, H3, H4. Последовательность аминокислот в этих белках практически не различается в организмах различного уровня организации. Гистоны — небольшие, сильно основные белки, связывающиеся непосредственно с ДНК. Гистоны принимают участие в структурной организации хроматина, нейтрализуя за счёт положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре.
Благодаря этому 46 молекул ДНК диплоидного генома человека общей длиной около 2 м, содержащих в сумме 6·10 9 пар оснований (п.о.), могут поместиться в клеточном ядре диаметром всего 10 мкм.
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой. Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером, взаимодействует с гистоном Н1.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки, множество ферментов и факторов транскрипции, связанных с определёнными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоновые белки интересны со многих точек зрения. Благодаря высокому содержанию лизина и аргинина они, как уже упоминалось, проявляют сильно основные свойства. Кроме того, последовательность аминокислот гистонов, то есть их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей. Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и её полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы ещё в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точковые мутации, все они, очевидно, приводили к вымиранию мутантных организмов.
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано с фосфорилированием гистонов, а усиление транскрипции — с ацетилированием в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Некоторые детали механизма регуляции смотри: Белки группы polycomb
Катится, катится к ДНК гистон
Asf1 подвозит гистоны — блоки для «строительства» хромосом
иллюстрация автора статьи
Автор
Редакторы
Каждый раз, когда клетки делятся митозом или мейозом, их ДНК расплетается и удваивается, умудряясь при этом сохранять свою структуру и целостность. Ювелирная упаковка ДНК (обеспечиваемая гистонами) жизненно важна, ведь именно от неё зависит, какие гены будут считываться и работать в той или иной клетке. Подробности того, как ДНК удаётся упаковаться каждый раз правильным образом и как происходит транспортировка нужных гистонов к месту сборки, выясняла команда биологов из Биотехнологического центра исследований и инноваций Университета Северной Дании и Университета Копенгагена. Эта работа вошла в кандидатскую диссертацию Илназ Климовской, сейчас — менеджера медицинских и научных проектов в «Новартис Фарма» в Москве. Результаты исследования опубликованы в журнале Nature Communications.
«Биология — наука 21 века»
Эта работа публикуется в рамках конкурса научно-популярных статей, проведенного на конференции «Биология — наука 21 века» в 2014 году.
Речь идёт о гистонах Н3-Н4
Разные, как две капли воды
Известно, что все клетки многоклеточного организма имеют одинаковый геном. Впрочем, данное утверждение не совсем точно — столь длинный код не может триллионократно копироваться без единой ошибки, чтобы все копии были абсолютно идентичны, но большинство «опечаток» всё же остаются незамеченными из-за избыточности генетического кода. Одно «слово» — код одной аминокислоты, или триплет, — может быть заменено другим, синонимичным ему, и такого рода «опечатка» не приведёт к смысловой замене в кодируемом белке.
Выходит, сотни и тысячи типов клеток, различающихся в зависимости от местоположения и функции, развиваются из одной и той же зиготы. Значит, один набор хромосом формирует и округлый со вмятинкой посередине безъядерный эритроцит, и многоядерную веретенообразную клетку поперечнополосатой мышечной ткани, и тянущие друг к другу руки отростков нейроны, и секреторную клетку поджелудочной железы, и все остальные клетки, в которых производятся специфические, только им необходимые белки и проходят такие разные химические реакции?
Клетки, на которые поделится зигота, несмотря на свою видимую идентичность, имеют огромный потенциал вариабельности. Так и две капли воды, кажущиеся абсолютно одинаковыми, могут иметь совершенно разный состав примесей, разное микробное «население» и ещё множество недоступных невооружённому глазу отличий. Но если с каплями всё понятно (они могут быть неразличимы на вид, но взяты из разных водоёмов или содержать разные добавки), то оплодотворённая яйцеклетка одна, и никто не добавляет вещества в поделившиеся клетки извне. Как же так получается? Если геном одинаков, а клетки все разные, — здесь явно задействованы какие-то механизмы, не связанные с последовательностью нуклеотидов в цепочке. Такие изменения иногда называют «надгеномными». Они происходят в течение жизни организма и могут передаваться потомству, хотя не влияют на последовательность ДНК (см. «Рыбки Danio rerio наследуют модификации ДНК от отца» [3]). Изучением таких изменений занимается наука эпигенетика, рассказывающая про три основных способа надгеномного регулирования:
Рисунок 1. Клетки одного и того же организма — самые непохожие близнецы, хотя и являются, по сути, копиями
иллюстрация автора статьи
Драгоценное кружево и узелковое письмо: зачем и как ДНК упаковывают в хроматин
Рисунок 2. Узелковое письмо кипу
Если бы мы смогли посмотреть на молекулу ДНК, мы увидели бы, что она похожа на очень длинную (примерно 1 метр — а ведь она умещается в клеточном ядре!) тонкую нить, плавающую, на первый взгляд, спутанным, но на деле — организованным комком в ядре клетки. Но простота такой модели обманчива (потому что в действительности всё намного интереснее) — перед тем, как клетка делится, нить упаковывается ещё плотнее, определённым образом «наматываясь на катушку», состоящую из белков-гистонов, образуя нуклеосому (структурную единицу хроматина).
Зачем вообще образуется хроматин? Во-первых, упаковка ДНК в организованную структуру даёт широкий простор для регуляции считывания информации, заложенной в ней. Какие-то участки можно оставить более открытыми, какие-то — более закрытыми, влияя тем самым на то, какая информация будет считываться. Во-вторых, нить в развёрнутом виде длинная, тонкая, может легко запутаться, порваться, а повреждение её чревато серьёзными последствиями (вплоть до гибели клетки). Нить ДНК уязвима для веществ, растворённых в цитоплазме клетки (туда она попадает после того, как в процессе деления защитный «сейф» ядерной оболочки, где клетка хранит своё главное богатство, растворяется), её запросто может без всякого злого умысла покромсать на кусочки какой-нибудь фермент. Оставить тонкую нить ДНК без защиты никак нельзя.
Вот представьте: вы купили в магазине большой моток дорогого прелестного и невероятно тонкого кружева ручной работы. Что будет, если вы его в размотанном виде начнёте протаскивать его сквозь терновые заросли? Правильно, оно порвётся в клочки. Но если его красиво, аккуратно и компактно упаковать, этого не произойдёт. Наша ДНК — творение куда более сложное, ценное, прекрасное и, не побоюсь этого слова, грандиозное, потому что ещё и несет на себе важное послание — нуклеотидный текст, ошибки в котором могут стать причиной серьёзных заболеваний, в том числе онкологических. Поэтому эволюция позаботилась о создании эффективного механизма упаковки такого бесценного сокровища — это и есть хроматин, о котором говорилось выше.
В генах нити ДНК, как в узелковом письме инков (кипу), записаны инструкции по сборке белков из аминокислот. От плотности «обмотки» вокруг гистонов зависит, какие гены будут «видны» транскрипционным факторам (ТФ) [5], прочитаны ими, и, следовательно, какие гены будут работать. Когда клетки делятся самым распространённым — митотическим — способом, внутри родительской клетки удваиваются и затем делятся между двумя дочерними все их составные компоненты, в том числе и ДНК. Для упаковки удвоенного количества ДНК в хроматин клетке нужно в два раза больше гистонов, этих строительных блоков, создающих каркас архитектуры хроматина.
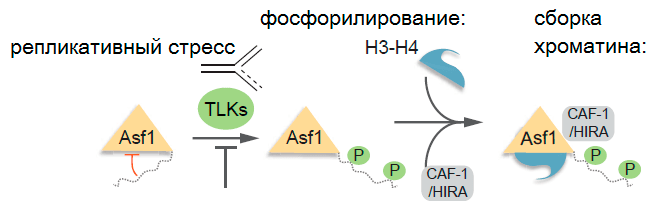
Производство гистонов и производство ДНК в клетке чётко скоординированы. Эти два процесса похожи на циркачей, выполняющих совершенно синхронные трюки. Гистоны не возникают в нужное время и в нужном месте сами собой. Они производятся в цитоплазме клетки, поэтому им надо ещё как-то добраться до ядра, где спрятана клеточная ДНК. Транспортирует эти «кирпичики» на стройку специальный белок Asf1. Он относится к классу шаперонов — вспомогательных белков, которые отвечают за целостность и эффективность различных белков-партнёров. Именно Asf1 занимается высокоточной доставкой гистонов — то есть, является поставщиком строительного материала к месту возведения очередного шедевра природной архитектуры — хроматина.
Эй, прибавь-ка ходу, машинист!
Asf1, который занимается перевозкой димера (объединения из двух молекул) гистонов H3—H4, может фосфорилироваться (присоединять остаток фосфорной кислоты) ферментом TLK1 (tousled-like kinase). Исследователи нашли сайты фосфорилирования — «крючочки», куда фермент может «повесить» фосфатную группу. С помощью метода масс-спектрометрии их нанесли на карту, показав, что фосфорилирование происходит во многих точках «хвостика» молекулы, содержащего сериновые и треониновые аминокислотные остатки. TLK1 особенно активен в тот промежуток времени, когда удваивается ДНК и синтезируются гистоны, — в S-фазе интерфазы (синтетического периода в промежутке между клеточными делениями), — затем его количество в клетке уменьшается. Фосфорилируя белок Asf1, TLK1 превращает его в высокоскоростной и сверхточный товарный поезд, обеспечивающий немедленную доставку «строительных материалов» к месту удвоения ДНК и сборки хроматина. Таким образом, учёные вышли на новый уровень понимания того, как регулируется развитие клеток. Верные и стоящие на своём месте гистоны определяют судьбу клетки: правильно ли она делает, если хочет стать непохожей на других? Стимулирует ли она рост и развитие организма, или встала на кривую дорожку, которая приведёт к онкологическому заболеванию?
Рисунок 3. TLK-1 (как и другие человеческие TLK) активен в синтетическом периоде интерфазы и подавляется действием репликативного стресса (нарушения правильного удвоения ДНК, что как раз и приводит к повреждению молекулы и может стать причиной онкологических заболеваний). Возможно, фосфорилирование Asf1 играет ключевую роль в транспортировке гистонов и сборке хроматина как во время нормального течения S-фазы (синтетического периода интерфазы), так и в ответ на репликативный стресс. Отсюда — надежды исследователей найти способ воздействия на раковые клетки, чтобы снизить их устойчивость к лечению. CAF-1 (chromatin assembly factor 1) и HIRA — ещё два из множества гистоновых шаперонов, участвующих в сборке хроматина.
В дальнейшем команда исследователей собирается глубже вникнуть в процесс дупликации хроматина и найти методы воздействия на деление и развитие опухолевых клеток с помощью TLK1 (например, нарушить поставки к ним гистонов при удвоении ДНК), постаравшись сделать раковые клетки менее устойчивыми.
Словарик терминов
Статья написана на основе пресс-релиза [1] и оригинальной публикации [2].
Что такое гистоновые белки
Гистоны
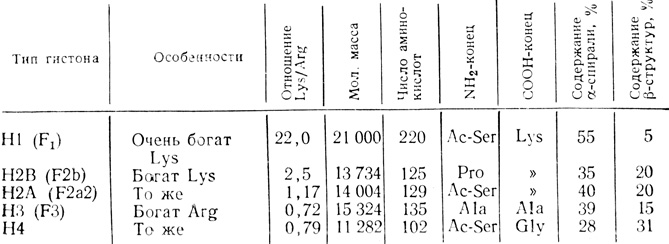
Таблица 2.1. Параметры гистонов из тимуса теленка
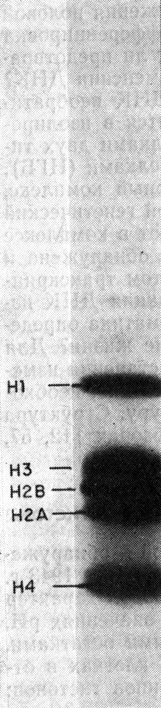
Рис. 2.1. Электрофореграмма гистонов в полиакриламидном геле
Важное свойство всех гистонов состоит в том, что их положительно заряженные лизиновые и аргининовые остатки образуют кластеры в особых областях полипептидной цепи. Этим и объясняется наличие во вторичной структуре гистонов вытянутых β-структур. Очевидно, эти положительно заряженные β-структуры связываются с отрицательно заряженными фосфатными группами ДНК сильнее, чем с другими группами. Нейтрализация положительных зарядов в гистонах должна приводить к их отделению от ДНК. Из табл. 2.1 видно, что гистоны H2A, H2B, Н3 и Н4, находящиеся внутри нуклеосом, имеют больше вытянутых β-структур, чем гистон Н1, расположенный между нуклеосомами.
Прокариоты не имеют гистонов. Появление гистонов совпало с возникновением ясно выраженных ядер, хромосом и процесса дифференцировки. Гистоны подавляют синтез РНК [167] и ДНК [142] in vitro. При полном или частичном удалении гистонов из хроматина сильно увеличивается его матричная активность. Однако маловероятно, чтобы гистоны контролировали или регулировали транскрипцию генов, так как: а) имеется только пять основных видов гистонов, тогда как геном эукариотов содержит несколько тысяч генов; б) количество гистонов обычно постоянно в клетках всех типов и во всех периодах жизни; в) количество гистонов одинаково в метаболически активных и метаболически неактивных клетках. Следовательно, можно предположить, что гистоны включены в структуру и организацию хроматина и действуют как общие репрессоры его активности.
Гистон Н1
При изучении последовательности аминокислот подфракций гистона Н1 было показано, что в отличие от остальных четырех гистонов он имеет основной концевой COOH-участок. Концевая NH2-область (1-40) также имеет основной характер (24-39). В концевой NH2-области изогистонов Н1 найдено большое число аминокислотных замен. Эти замены, по-видимому, определяют функциональные различия изогистонов Н1 во взаимодействии с НГБ и эффекторами, а также в связывании с ДНК. Концевая NH2-область представляет собой неупорядоченную спираль. Центральный участок [(39±4)-(116±4)] кроме большого числа аминокислот кислотного характера и двух ароматических аминокислот содержит неполярные аминокислоты. Этот участок способен к образованию вторичной глобулярной структуры. Он в основном инвариантен и весьма консервативен, т. е. все гистоны Н1 различных организмов имеют в этой области практически одну и ту же последовательность аминокислот. По-видимому, она играет существенную роль в структуре хроматина.
Концевая COOH-область является сильно основной из-за наличия большого числа лизиновых остатков и весьма консервативна внутри одного вида. Поэтому она может играть общую роль во всех гистонах Н1. Она также представляет собой неупорядоченную спираль. Эта область в основном ответственна за связывание с ДНК. Предполагают, что основные области гистона Н1 связываются с ДНК, а неполярная и глобулярная центральная область взаимодействует с другими молекулами [77, 89, 154]. Стафилококковая дезоксирибонуклеаза специфически расщепляет хроматин между нуклеосомами, в результате чего образуются фрагменты ДНК, связывающие две соседние нуклеосомы. Показано, что гистон Н1 соединяется приблизительно с 30-60 парами оснований этих фрагментов ДНК, т. е., по-видимому, гистон Н1 не участвует в образовании структуры нуклеосомы, а располагается в областях между нуклеосомами. Положительный заряд гистона Н1 выше, чем у других гистонов. Он первым вытесняется из хроматина кислотой или щелочью и в большей степени подвержен разрушению протеазами, когда еще находится в связанном состоянии в комплексе хроматина [26, 263]. Если гистон Н1 добавить к хроматину с недостаточным содержанием этого гистона, то хроматин сжимается [46, 47]. Если же гистон Н1 смешать с двухцепочечной ДНК, то образуются структуры, имеющие форму бублика (тора) [166]; другие гистоны в подобных условиях участвуют в образовании глобул, похожих на нуклеосомы. Таким образом, гистон Н1, вероятно, участвует в образовании структур хроматина высшего порядка, а именно способствует закручиванию нитей нуклеосом в сверхспиральный виток с диаметром
20 нм [47]. Аналогичные структуры образует с ДНК гистон Н5. Вероятно, различные подфракции гистона Н1 могут быть связаны с различными межнуклеосомными (линкерными) областями хроматина и участвуют в образовании разных сверхспиралей. В интерфазном хроматине ДНК свернута в несколько тысяч раз, благодаря чему она умещается по длине метафазной хромосомы. Определенную роль в этой конденсации ДНК может играть гистон Н1.
Гистон Н1 отличается от остальных гистонов быстрым обменом в культуре клеток [16]. В то время как синтез остальных четырех гистонов связан с синтезом ДНК и происходит только в S-фазе, синтез Н1 в клетках штаммов Friend и HeLa может происходить и в отсутствие синтеза ДНК, т. е. в G1-фазе [385]. В клетках ВНК синтез гистона Н1 также частично происходит в G1-фазе,[343].
Таблица 2.2. Сравнение свойств гистона Н1 и нуклеосомных гистонов
Гистоны Н2А, Н2В, Н3 и Н4
Гистон Н5
Кроме гистонов пяти типов, которые присутствуют во всех клетках и тканях, имеющие ядро эритроциты низших позвоночных, рыб, амфибий, рептилий и птиц содержат другой гистон, Н5, который во многом похож на гистон Н1. Он был впервые обнаружен в эритроцитах цыпленка в 1961 г. [266], и позднее его существование было подтверждено [159]. Гистон Н5 содержит приблизительно 197 аминокислотных остатков, дает полосу рядом с гистоном Н1 при электрофорезе в полиакриламидном геле и имеет молекулярную массу
23000. Ему свойствен молекулярный полиморфизм, а расположен он между нуклеосомами. Гистон Н5 связан с А-Т-областью ДНК и, так же как гистон Н1, оказывает стабилизирующее влияние на хроматин. Он тоже богат лизином, который составляет 23% его аминокислотных остатков. С помощью метода ЯМР установлено, однако, что он отличается от гистона Н1, и, возможно, его эволюция происходила самостоятельно [78]. Лизиновые остатки гистона Н5 ацетилированы в большей степени, чем у гистона Н1, но не так сильно фосфорилированы. Он содержит большое число сериновых остатков (21), и у него, в отличие от гистона Н1, не наблюдается специфического образования кластеров из основных аминокислот на NH2-конце. В противоположность гистону Н1 его NH2-конец имеет структуру глобулы.
Протамины
45 аминокислот. Они богаты аргинином и не содержат лизина и триптофана; аргинин составляет две трети всех аминокислот. Собирающиеся в кластеры аргининовые остатки образуют длинные участки, с помощью которых протамины связываются с ДНК сперматид. После образования этой связи транскрипционная активность хроматина полностью подавляется. Если удалить протамины, то хроматин принимает вид бусинок и становится чувствительным к микрококковой нуклеазе. При добавлении протаминов эта структура исчезает и хроматин становится невосприимчивым к нуклеазе. Сериновые остатки протаминов могут быть фосфорилированы и дефосфорилированы. Полагают, что эта ковалентная модификация необходима для правильного связывания протаминов с ДНК [105], Ниже показана структура типичного протамина рыб:
Протамины, как и гистоны, синтезируются в цитоплазме. Их короткие мРНК транслируются на дирибосомах. Эти РНК в отличие от мРНК гистонов содержат на 3′-конце полиадениловую кислоту [169]. На 5′-конце они имеют 7-метилгуанин. Хотя в семенниках форели протамины синтезируются на стадии сперматиды, транскрипция их мРНК происходит значительно раньше, а именно на стадии первичного сперматоцита [170]. мРНК так же, как и рибонуклеопротеидные частицы, до наступления стадии сперматиды остается неактивной. Аналогичная ситуация наблюдается и в случае гистонов. Ооциты Xenopus содержат мРНК материнских гистонов в неактивной форме, которые активируются и транслируются во время деления яйца. Протамины содержатся только в сперматоцитах, однако неизвестно, почему экспрессия их генов происходит только в этих клетках и как она начинается на соответствующей стадии развития этих клеток.
Гены гистонов
В исследованиях на Drosophila показано, что гены гистонов расположены в хромосоме II. Пять структурных генов пяти гистонов богаты парами G-C и тандемно повторяются. Они разделены участками, богатыми парами А-Т, которые не транслируются. Вся область кодирования генов гистона содержит 6000-7000 пар оснований ДНК. Ниже показаны расположение и длина генов в яйце морского ежа вместе со спейсерными участками (S) [39].
Структурные гены гистонов не содержат интронов, или нетранслируемых областей, как гены глобина, яичного альбумина и иммуноглобулина, а также не транскрибируются как более длинные предшественники РНК [312]. Спейсерные области не имеют небольших повторяющихся последовательностей оснований, как это наблюдается у генов рРНК и 5S-PHK. У всех видов морских ежей порядок расположения и направления транскрипции гистоновых генов одинаковы, тогда как у разных видов Drosophila они различны [230]:
Синтез и обновление гистонов
Гены гистонов транскрибируются в направлении 5′→3′ с помощью РНК-полимеразы II, так как процесс транскрипции чувствителен к α-аманитину [225]. По-видимому, мРНК пяти гистонов транскрибируются отдельно, а не как единая полицистронная мРНК [205]. Они имеют коэффициент седиментации приблизительно 9S и могут быть разделены в полиакриламидном геле [187]. На 3′-конце мРНК гистонов нет полиадениловой кислоты [5], а на их 5′-конце присутствуют последовательности m 7 G(5′)pppN m или m 7 G(5′)pppN m pN [260].
Синтез гистонов тесно связан с синтезом ДНК. мРНК гистонов синтезируются в начале S-фазы, а затем переходят в цитоплазму, где они соединяются с рибосомами для синтеза гистонов [293, 303, 310, 331]. мРНК гистонов существуют приблизительно столько же времени, сколько длится S-период, т. е. 10-12 ч. Есть сообщение, что для транскрипции мРНК гистонов необходимы фосфорилированные НГБ [194], но оно требует подтверждения.
Если синтез ДНК затормозить с помощью цитозинарабинозида или оксимочевины, то синтез мРНК гистонов также прекращается, уже образовавшиеся мРНК разрушаются и синтез гистонов останавливается. Как только это происходит, прекращается также синтез ДНК [188, 366, 379]. Таким образом, клетка обладает механизмом, «включающим» и «выключающим» гены гистонов в соответствии с синтезом ДНК. Стехиометрическое соотношение синтезированных гистонов Н1:Н2А:Н2В:Н3:Н4 равно 0,5:1:1:1:1. Это свидетельствует о том, что четыре гена нуклеосомных гистонов транскрипционно связаны, и их трансскрипция, вероятно, скоординирована. По-видимому, матрица для гистона Н1 не связана с другими генами, поскольку количество синтезированного гистона Н1 составляет только половину количества других гистонов. У Drosophila, расположение гистоновых генов у которой отличается от расположения генов у морского ежа, ген гистона Н1 отделен от гена гистона Н3 1200 парами оснований ДНК. Следовательно, он может иметь самостоятельный промотор [230]. Более того, синтез гистона Н1 в фазе G1 в три раза интенсивнее синтеза других гистонов [343].
Судьба четырех нуклеосомных гистонов в процессе деления клетки изучалась с помощью 3 Н-лизина и других меченых аминокислот [220]. На примере культуры in vitro миобластов цыпленка показано, что, когда клетка делится, уже существовавшие нуклеосомные гистоны остаются в одной из дочерних клеток, а вновь синтезированные гистоны переходят в другую клетку. Таким образом, новые гистоны, по-видимому, не смешиваются со старыми, и какое-то время их состав сохраняется неизменным. Последовательно синтезирующиеся нуклеосомы располагаются в основном рядом друг с другом. Более того, гистоны в них существуют в неизменном виде в течение трех-четырех поколений. Каким образом это достигается, неизвестно. По-видимому, существует механизм, с помощью которого дифференцированное состояние материнской клетки может передаваться дочерним. В работе с использованием 3 Н-аргинина и 125 I-иоддезоксиуридина в культуральной среде, содержащей клетки мыши [153], было показано, что нуклеосомные гистоны сохраняются в течение многих поколений. Этот факт очень важен, так как ново-синтезированные гистоны связаны с новообразованной ДНК [353]. Высказано предположение, что некоторые НГБ также сохраняются в процессе деления клетки [122]. Такая консервация нуклеосом и НГБ вместе с последующей транскрипционной специфичностью может служить тем механизмом, с помощью которого достигается и сохраняется дифференцировка клетки. Гистон Н1, однако, в течение одного клеточного поколения обновляется на 15% [141]. Кроме того, он интенсивно фосфорилируется в конце фазы G2 клеточного цикла, что совпадает по времени с конденсацией хромосомы [48]. Быть может, фосфорилирование является пусковым механизмом митоза.