Что такое гипокинез мжп
Какие нарушения сердца видны через ЭхоКГ
Сердце – особенный орган, и УЗИ для него тоже особенное. Называется – ЭхоКГ.
Почему нельзя делать УЗИ сердца на обычном ультразвуковом аппарате?
Можно, но только результат исследования окажется неполным. Дело в том, что у эхокардиографа есть дополнительные возможности и особые датчики, которые позволяют получить качественное изображение органа, постоянно находящегося в движении. Кроме того, любой аппарат способен проводить исследование с эффектом Доплера. Доплерография даёт возможность оценить скоростные показатели потока крови, его направление, наличие патологического сброса. Это принципиально важно при оценке состояния клапанов сердца и перегородок, расположенных между предсердиями и желудочками. Наконец, к эхокардиографу можно подсоединить специальный датчик для проведения чреспищеводной эхокардиографии, который внешне больше напоминает гастроскоп.
Говорят, что ЭхоКГ это золотой стандарт в окончательной диагностике инфаркта?
По сути именно ЭхоКГ ставит точку в решении вопроса, были инфаркт миокарда или всё-таки нет. Такую возможность даёт прицельное изучение стенок сердца – передней, боковой, задней или нижней, а также межжелудочковой перегородки. Если миокард в этих зонах получил некротическое повреждение и там сформировался рубец, на эхокардиографии будет выявлено нарушение его сократимости. Это значит, что стенка сокращаться хуже, отставать от рядом расположенных (гипокинезия), сокращаться в своем режиме, что называется, не попадая в ногу (дискинезия), или вообще не будет сокращаться, выбиваясь из общего марша (акинезия). Если подобные изменения обнаружены (а они нередко бывают случайной находкой, без указания на перенесённый инфаркт), то вероятность инфаркта в прошлом более 90%. Если же в диагнозе стоит инфаркт, а по данным ЭКГ и ЭхоКГ подтверждений этому обнаружить не удаётся, скорее всего, речь идет о гипердиагностике и инфаркта на самом деле не было.
Какие показатели ЭхоКГ можно назвать наиболее важными?
Силу сердечной мышцы показывает так называемая фракция выброса (ФВ). Если этот показатель снижен, речь может идти о хронической сердечной недостаточности. Наличие нарушений локальной сократимости миокарда стенок сердца (гипокинезия, дисикинезия, акинезия) свидетельствует о перенесённом инфаркте или ишемии. Оценка клапанов включает количество створок, размер отверстия, доплерографически определяется наличие обратного сброса крови (недостаточность клапана) или повышенного градиента давления на клапане, свидетельствующего о формировании сужения (стеноза) клапана. Недостаточность клапанов или регургитация измеряется в степенях: от первой до четвёртой. Если первую и вторую можно отнести к варианту нормы, то третью (выраженную,) а тем более четвёртую считают патологией, которая требует хирургической коррекции. Анализ перегородок сердца помогает выявить наличие патологических отверстий и сброса крови через них (дефектов межпредсердной и межжелудочковой перегородок). Важную информацию представляют размеры камер сердца, толщина миокарда и наличие его гипертрофии, тромбы в полости сердца.
Что такое стресс — ЭхоКГ?
Если у пациента подозревают ишемическую болезнь сердца, врач-кардиолог обычно назначает нагрузочный тест. Часто это велоэргометрия или тредмил, когда пациент крутит педали велосипеда или идёт по беговой дорожке, а у него постоянно фиксируют ЭКГ, дожидаясь появления ишемии. Но раньше появления изменений на ЭКГ появляются те самые изменения кинетики стенок, о которых мы уже говорили. Тем более, сразу можно точно обнаружить стенку сердца, которая страдает больше всего, и предположить, какая именно артерия сужена бляшками. Поэтому, стресс-тест с ЭхоКГ считается более информативным. Его проводят с помощью физической нагрузки, когда пациент крутит педали на специальном велосипеде в лежачем положении, либо стимулируя работу сердца с помощью введения в вену специальных лекарств. В результате сердце работает намного активнее, и фрагменты миокарда, испытывающие нехватку питания, сокращаются хуже остальных.
Зачем назначают чреспищеводное ЭхоКГ?
В некоторых случаях даже после проведения стандартного ЭхоКГ кардиологам требуется уточнение. То, что не удалось увидеть через грудную клетку с помощью обычного датчика, можно рассмотреть из пищевода с помощью датчика, больше напоминающего гастроскоп. Оказывается, изнутри лучше видно пороки клапанов сердца, состояние его перегородок и наличие тромбов в предсердиях. Исследование проводится в сознании под действием легких снотворных препаратов, по ощущениям приятным его не назовешь, но и слишком дискомфортным тоже, но напоминает проведение обычной гастроскопии.
Как подготовиться к ЭхоКГ?
Обычное исследование, которое называют трансторакальным, особой подготовки не требует. Если речь идёт о чреспищеводном исследовании, то предварительно нужно будет выполнить гастроскопию, чтобы убедиться, что в пищеводе нет эрозий, варикозно расширенных вен и других нарушений. Если в ходе исследования выясниться, что человек с трудом переносит введение «шланга» и в верхние отделы ЖКТ, чреспищеводное ЭхоКГ можно буде провести под внутривенной анестезий, как говорят пациенты «во сне».
Сегодня ЭхоКГ, как и все исследования, активно развивается. Теперь его делают не только из пищевода, но и непосредственно из полости сердца – так называемое внутрисердечное ЭхоКГ. Для этого датчик доводят до сердца от паховых сосудов. Результаты исследования представляют в виде трёхмерных двигающихся изображений такого качества, что врачу трудно отличить реконструкцию от реального бьющегося сердца.
Если у Вас остались вопросы, Вы можете задать их кардиологу онлайн в приложении Доктис.
Онлайн консультации врачей
в мобильном приложении Доктис
Дежурный терапевт и педиатр консультируют бесплатно
© 2016-2021, ООО «Диджитал Медикэл Оперейшнс»
Лицензия на осуществление мед деятельности ЛО-76-01-002757.
Адрес: 121205, г. Москва, Территория Сколково Инновационного Центра, бульвар Большой, д. 42, стр. 1, эт. 4, пом. 1594, раб. 2
Филиал в г. Ярославль: 150062, Ярославская область, г. Ярославль, ул. 5-я Яковлевская, д.17
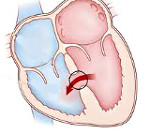
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Причины дефекта межжелудочковой перегородки
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
Симптомы дефекта межжелудочковой перегородки
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений и постепенно прогрессирующим течением с высоким риском развития жизнеугрожающих аритмий и внезапной смерти.
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов.
При ГКМП происходит массивная гипертрофия миокарда левого (и реже правого желудочка), чаще асимметричного характера за счет утолщения межжелудочковой перегородки, часто с развитием обструкции выходного тракта левого желудочка (ЛЖ) при отсутствии каких-либо явных причин.
Общепризнанной является представление о преимущественно наследственной природе ГКМП. В связи с этим, широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми, при этом основной тип наследования – аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
Гипертрофическая кардиомиопатия – это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений.
Возможны три гемодинамических варианта обструктивной ГКМП:
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Повышение диастолического давления в левом желудочке из-за диастолической дисфункции, динамическая обструкция выносящего тракта левого желудочка проявляются одышкой в покое и при физической нагрузке, утомляемости, слабости. Нарастание давления в малом круге кровообращения сопровождается развитием острой левожелудочковой недостаточности (чаще в ночные часы – сердечная астма, альвеолярный отек легких).
Падение фракции выброса при физической нагрузке или нарушениях сердечного ритма сопровождается ухудшением кровообращения головного мозга. Преходящая ишемия мозговых структур проявляется кратковременной потерей сознания (обморок) или предобморочными состояниями (внезапная слабость, головокружение, потемнение в глазах, шум и «заложенность» в ушах).
Методы исследования:
ЭХО-КГ – основной метод диагностики ГКМП. Критериями диагностики ГКМП на основании данных ЭХО-КГ являются:
Если в покое обструкции выносящего тракта левого желудочка нет, ее можно спровоцировать медикаментозными (ингаляция амилнитрита, введение изопреналина, добутамина) или функциональными пробами (проба Вальсальвы, физическая нагрузка), которые уменьшают преднагрузку или повышают сократимость левого желудочка.
Катетеризация сердца и коронарная ангиография проводятся для оценки коронарного русла перед миоэктомией или операцией на митральном клапане, а также чтобы выяснить причину ишемии миокарда. При этом к характерным признакам ГКМП относят:
Сцинтиграфия миокарда и позитронно-эмиссионная томография
При гипертрофической кардиомиопатии сцинтиграфия миокарда имеет некоторые особенности, однако в целом ее значение в диагностике ишемии такое же, как и обычно. Стойкие дефекты накопления указывают на рубцовые изменения после инфаркта миокарда, обычно они сопровождаются снижением функции левого желудочка и плохой переносимостью физической нагрузки. Обратимые дефекты накопления указывают на ишемию, вызванную снижением коронарного резерва при нормальных артериях или коронарным атеросклерозом. Обратимые дефекты часто никак не проявляются, однако, по-видимому, они повышают риск внезапной смерти, особенно у молодых больных с гипертрофической кардиомиопатией. При изотопной вентрикулографии можно выявить замедленное наполнение левого желудочка и удлинение периода изоволюмического расслабления.
Позитронно-эмиссионная томография – более чувствительный метод, кроме того, она позволяет учесть и устранить помехи, связанные с затуханием сигнала. Позитронно-эмиссионная томография с фтордезоксиглюкозой подтверждает наличие субэндокарлиальной ишемии, вызванной снижением коронарного резерва.
Современные подходы к лечению ГКМП
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза.
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск внезапной смерти (в частности, скрытых, прогностически значимых аритмий).
Общие мероприятия
Ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
Медикаментозное лечение
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью внезапной смерти. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов. Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид (антиаритмический препарат IA класса) и амиодарон.
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
Инвазивные методы лечения:
1. Чрезаортальная септальная миэктомия
2. Вальвулопластики или протезирования митрального клапана
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты миэктомии позволяет последующая длительная терапия верапамилом, обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
3. Иссечения межжелудочковой перегородки
В настоящее время разработаны и успешно применяются отличные от классической миэктомии методики. В частности, в НЦССХ им. А. Н. Бакулева под руководством академика Л. А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части правого желудочка. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
4. Транскатетерная септальная аблация
Другим альтернативным методом лечения рефракторной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающей от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматике заболевания.
В Волынской больнице отработана методика выполнения транскатетерной септальной аблации при ГКМП. Доказан положительный результат данного вмешательства при относительно низком риске развития осложнений.