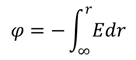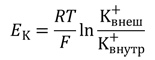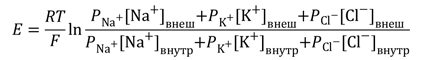Что такое гиперполяризация в физиологии
ГИПЕРПОЛЯРИЗАЦИЯ мембраны
Смотреть что такое «ГИПЕРПОЛЯРИЗАЦИЯ мембраны» в других словарях:
Гиперполяризация — ГИПЕРПОЛЯРИЗÁЦИЯ мембраны, повышение разности потенциалов между наруж. и внутр. сторонами мембраны живой клетки, находящейся в состоянии физиол. покоя, т.е. повышение потенциала покоя. Пассивная Г. возникает при прохождении через мембрану… … Биологический энциклопедический словарь
гиперполяризация — увеличение разности потенциалов между наружной и внутренней сторонами биологической мембраны в возбудимых тканях … Большой медицинский словарь
гиперполяризация пассивная — Г. под анодом постоянного тока, не сопровождающаяся изменением ионной проницаемости мембраны … Большой медицинский словарь
Биоэлектрические потенциалы — электрические потенциалы, возникающие в тканях и отдельных клетках человека, животных и растений, важнейшие компоненты процессов возбуждения (См. Возбуждение) и торможения (См. Торможение). Исследование Б. п. имеет большое значение для… … Большая советская энциклопедия
НЕРВНЫЙ ИМПУЛЬС — волна возбуждения, к рая распространяется по нервному волокну и служит для передачи информации от периферич. рецепторных (чувствительных) окончаний к нервным центрам, внутри центр. нервной системы и от неё к исполнительным аппаратам мышцам и… … Физическая энциклопедия
Поляризация — (франц. polarisation, первоисточник: греч. pólos ось, полюс) биоэлектоическая, возникновение двойного электрического слоя на границе между наружной средой и содержимым живой клетки; при этом наружная поверхность клетки в состоянии покоя… … Большая советская энциклопедия
синапс — а; м. [греч. synapsis соединение, связь] Физиол. Область соприкосновения нервных клеток друг с другом или тканями, содержащими нервные клетки. ◁ Синапсический; синаптический, ая, ое. С ая зона. * * * синапс (от греч. sýnapsis соединение),… … Энциклопедический словарь
Потенциал действия — Потенциал действия волна возбуждения, перемещающаяся по мембране живой клетки в процессе передачи нервного сигнала. По сути своей представляет электрический разряд быстрое кратковременное изменение потенциала на небольшом участке… … Википедия
Торможение (физиология) — У этого термина существуют и другие значения, см. Торможение (значения). Торможение в физиологии активный нервный процесс, вызываемый возбуждением и проявляющийся в угнетении или предупреждении другой волны возбуждения. Обеспечивает… … Википедия
Биоэлектри́ческие потенциа́лы — электрические потенциалы, возникающие в живых клетках и тканях; показатель биоэлектрической активности, определяемой разностью электрических потенциалов между двумя точками живой ткани. Основными видами Б. п. являются мембранный потенциал (или… … Медицинская энциклопедия
Что такое гиперполяризация в физиологии
В нервных волокнах сигналы передаются с помощью потенциалов действия, которые представляют собой быстрые изменения мембранного потенциала, быстро распространяющиеся вдоль мембраны нервного волокна. Каждый потенциал действия начинается со стремительного сдвига потенциала покоя от нормального отрицательного значения до положительной величины, затем он почти так же быстро возвращается к отрицательному потенциалу. При проведении нервного сигнала потенциал действия движется вдоль нервного волокна вплоть до его окончания.
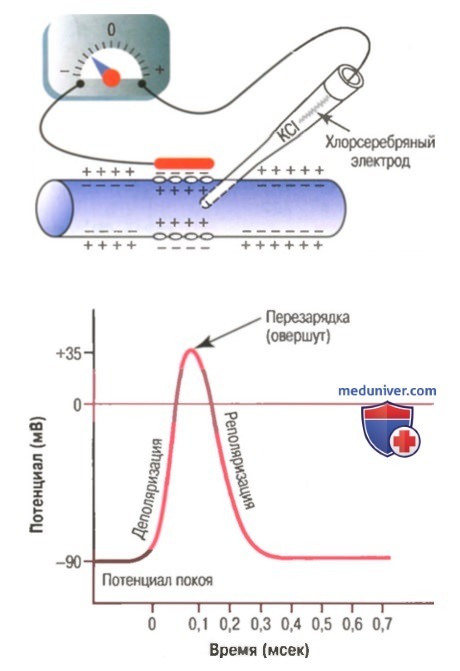
Фаза реполяризации. В течение нескольких долей миллисекунды после резкого повышения проницаемости мембраны для ионов натрия, натриевые каналы начинают закрываться, а калиевые — открываться. В результате быстрая диффузия ионов калия наружу восстанавливает нормальный отрицательный мембранный потенциал покоя. Этот процесс называют реполя-ризацией мембраны.
Для более полного понимания факторов, являющихся причиной деполяризации и реполяризации, необходимо изучить особенности двух других типов транспортных каналов в мембране нервного волокна: электроуправляемых натриевых и калиевых каналов.
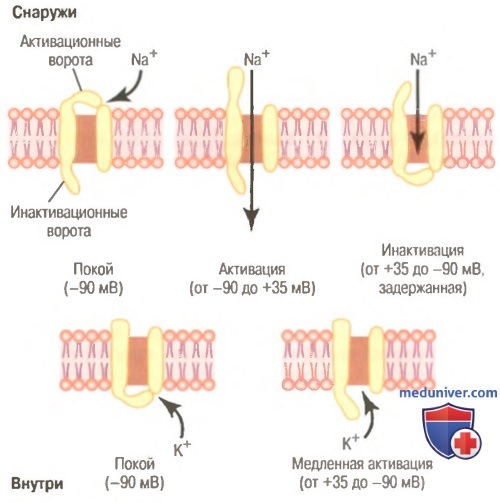
Показана последовательная активация и инактивация натриевых каналов и задержанная активация калиевых каналов.
Инактивация натриевого канала. В верхней правой части рисунке показано третье состояние натриевого канала. Увеличение потенциала, открывающее активационные ворота, закрывает инактивационные ворота. Однако инактивационные ворота закрываются в течение нескольких десятых долей миллисекунды после открытия активационных ворот. Это значит, что конформационное изменение, приводящее к закрытию инактивационных ворот, — процесс более медленный, чем конформационное изменение, открывающее активационные ворота. В результате через несколько десятых долей миллисекунды после открытия натриевого канала инактивационные ворота закрываются, и ионы натрия не могут более проникать внутрь волокна. С этого момента мембранный потенциал начинает возвращаться к уровню покоя, т.е. начинается процесс реполяризации.
Существует другая важная характеристикая процесса инактивации натриевого канала: инактивационные ворота не открываются повторно до тех пор, пока мембранный потенциал не вернется к значению, равному или близкому к уровню исходного потенциала покоя. В связи с этим повторное открытие натриевых каналов обычно невозможно без предварительной реполяризации нервного волокна.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Формирование мембранного потенциала покоя
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K + ) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
На эти вопросы можно ответить только в том случае, если узнать, как клетка создаёт себе разность электрических потенциалов (потенциал покоя) на мембране.
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ноздрачёв А.Д. и др. Начала физиологии [5].
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na + и K + ), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na + и K + ).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na + на K +
Но ведь при обмене одного положительного заряда (Na + ) на другой такой же положительный заряд (K + ) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K + из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология) [7].
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K + ) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Медицинские интернет-конференции
Языки
Биологическая роль эндотелия в условиях нормы
Агабеков, А.И., Рзаева Т.Ш.
Резюме
В работе предствлены современные данные отечественной и зарубежной литературы относительно биологической роли эндотелия сосудов в условиях нормы, участия эндотелия в регуляции сосудистого тонуса, коагуляционного потенциала крови, регуляции адгезии лейкоцитов, регуляции проницаемости сосудов и их реэндотелизацию за счет факторов роста
Ключевые слова
Обзор
Агабеков А.И., Рзаева Т.Ш.
Научные руководители: д.м.н., проф. Чеснокова Н.П., д.м.н., проф. Барсуков В.Ю
Кафедра патологической физиологии им. А.А. Богомольца
Введение
Эндотелиальные клетки имеют.гетерогенную структуру, обладающую многообразными функциями, а нарушение структуры и функций эндотелия является инициирующим фактором развития различных форм патологии. Эндотелиальная выстилка сосудов весьма разнообразна, в ряде органов и тканей имеет плотные межклеточные контакты, носит непрерывный характер, что свойственно для гематоэнцефалического барьера. В других органах и тканях, в частности, в почках, ряде эндокринных желез, эндотелий носит фенестрированный, синусоидальный характер, и тем самым обеспечивает селективную проницаемость для различных веществ (З. А. Лупинская, А. Г.Зарифьян, Т. Ц. Гурович, С. Г. Шлейфер 2008)
Сосудистый эндотелий, по мнению ряда авторов, является эндокринным органом, и выполняет многочисленные функции, в частности, регуляцию коагуляционного потенциала крови, а также сосудистого тонуса. Эндотелиальные клетки опосредуют воспалительные и иммунные процессы; регулируют адгезию лейкоцитов; модулируют окисление липидов; регулируют проницаемость сосудов, их реэндотелизацию за счет факторов роста.
Целью данной работы явился анализ данных литературы отечественных и зарубежных авторов относительно роли эндотелия в регуляции функциональной активности сосудистой стенки в условиях нормы.
Эндотелиальные факторы, регулирующие сосудистый тонус.
Вазодилатирующие факторы, продуцируемые эндотелием
Касаясь биологических эффектов ряда вазодилатирующих соединений, синтезируемых в эндотелиальных клетках, следует прежде всего остановиться на эффектах NO.
NО образуется в клетках эндотелия из L-аргинина под действием фермента NO-синтетазы. Имеются два уровня секреции NO — базальный и стимулированный. Тонус сосудов в покое осуществляется постоянной базальной секрецией. Некоторые химические вещества: ацетилхолин, АТФ, брадикинин, а также гипоксия или механическая деформация увеличивают синтез NO. Стимулируя гуанилатциклазу, NO увеличивает образование цГМФ в гладкомышечных клетках, тромбоцитах, что обусловливает расслабление сосудов, ингибирует пролиферацию гладкомышечных клеток и тормозит активность тромбоцитов и макрофагов. (В. Ф. Киричук, А. П. Ребров, С. И. Россошанская, 2005)
Простациклин синтезируется преимущественно в эндотелии. Основным механизмом, регулирующим его образование, является активность ферментов циклооксигиназ. Простациклин оказывает вазодилатирующее действие за счет стимуляции специфических рецепторов, локализованных на гладкомышечных клеток сосудов, что ведет к повышению активности в клетках аденилатциклазы и увеличение образования цАМФ. (Дзгоева Ф. У., Кутырина И. М. 2000)
Пуриновые основания, эндогенными источниками которых являются тромбоциты, эндотелиоциты, нейроны и другие клетки, действуют на различные рецепторы клеток сосудистой стенки: при воздействии на рецепторы эндотелия, происходит стимуляция образования основных вазодилатирующих факторов: простациклина, оксида азота, эндотелиального гиперполяризующего фактора; при воздействии на рецепторы гладкомышечных клеток сосудов пуриновые нуклеотиды вызывают эндотелий-независимую вазодилатацию.
К эндогенным каннабиоидам относят анаидамид и 2-арахидонилглицерин, источниками которых являются клетки эндотеия, тромбоциты, лейкоциты, макрофаги, а также периваскулярные нервные окончания. Анаидамид и 2-арахидонилглицерин образуются в больших количествах при активации тромбоцитов и моноцитов и участвуют в механизмах снижения артериального давления при различных патологических состояниях. (Чурюканов М. В., Чурюканов В. В., 2004)
Известны еще два фактора, выделяемые эндотелием и вызывающие дилатацию сосудов: натрийуретический пептид С-типа (НПС) и адреномедуллин. Натрийуретический пептид С вызывает релаксацию сосудов и угнетает пролиферацию гладкомышечных клеток. Большей частью НПС синтезируется в эндотелии, воздействует на рецепторы гладкомышечных клеток, вызывая увеличение образования цГМФ, приводящего к расширению сосуда. Адреномедуллин действует как прямой вазодилататор за счет увеличения продукции цАМФ. В результате активации аденилатциклазы образуется из препроадреномедуллина в эндотелиальных и гладкомышечных клетках сосудов. Доказано. что сосудорасширяющее действие адреномедуллина связано как с эндотелий-зависимыми, так и с эндотелий-независимыми механизмами. Предполагается наличие специфических рецепторов к адреномедуллину. (Kitamura K. et al. Adrenomedullin, 1993)
Вазоконстрикторные факторы, продуцируемые эндотелием
Эндотелиальные факторы вызывают сужение сосудов, что связано с отсутствием высвобождения факторов релаксации и с продукцией констриктивных агентов. К вазоконстрикторам, синтезирующимся в эндотелиальных клетках относят эндотелины, тромбоксан А2, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II.
Тромбоксан А2 преимущественно синтезируется в тромбоцитах, но некоторое его количество образуется в эндотелии. Специфические рецепторы к нему расположены на гладкомышечных клетках сосудистой стенки. Сокращение гладкомышечных клеток при стимуляции тромбоксаном связано со снижением активности аденилатциклазы и повышением содержания внутриклеточного кальция. (Дзгоева Ф. У., Кутырина И. М., 2000)
Ангиотензин ||, образуется в результате активации ренин-ангиотензиновой системы и является одним из наиболее сильных вазоконстрикторов. Активация данной системы может происходить как на системном уровне при выделении ренина клетками юкстагломерулярного комплекса почек, так и локально, на уровне эндотелия, в котором образуется ренин и ангиотензин-превращающий фермент. (Бабак О. Я., Кравченко Н. А. 2005)
Роль эндотелия в регуляции коагуляционного потенциала крови
Как указывалось выше, при гипоксии и действии медиаторов, увеличивающих синтез NO, в эндотелиальных клетках, медии и адвентиции синтезируется простациклин. Простациклин активирует аденилатциклазу, следствием чего является увеличение содержания цАМФ, который, помимо выполнения вазодилатирующей функции, препятствует активации тромбоцитов и вызывает релаксацию сосудов. Нарушение синтеза простациклина или снижение его поступления в кровь создает тромбогенную опасность. NO подавляет адгезию и агрегацию тромбоцитов. Этот процесс ассоцирован с увеличением содержания в тромбоцитах цГМФ.
Тромбогенный риск повышается по мере снижения содержания в плазме крови активных антитромбинов, в первую очередь АТ III, при одновременном наличии предрасполагающих факторов — гиперлипидемии, ожирения, диабета, сердечной недостаточности. (Suck G., Traut W. 2000)
Эндотелий играет важную роль в развитии фибринолиза за счет секреции тканевого и урокиназного активаторов плазминогена и его ингибиторов, которые могут или быстро нейтрализовать плазмин, или препятствуют активации плазминогена. Под влиянием гемодинамических факторов, пристеночного напряжения сдвига, трансмурального давления и ряда других факторов возникает динамическое изменение синтеза и секреции тромбогенных и атромбогенных субстанций эндотелия. В физиологических условиях выделение атромбогенных субстанций преобладает над тромбогенными. (Петрищев Н.Н., Власов Т.Д. 2003)
В регуляции гемостатической функции эндотелия большое значение имеют гормоны вазопрессин, эстрогены, цитокины: интерлейкин-1, TNF- α, гемодинамические факторы. К факторам эндотелиального происхождения, ингибирующим адгезию и агрегацию тромбоцитов, относят простациклины, простагландины Е2, NO.
Значение эндотелия в регуляции адгезии лейкоцитов
Исключительно важную роль играет эндотелий в развитии адгезии лейкоцитов. К адгезивным молекулам эндотелия относятся Р-селектин, GMP-140, ELAM-1, ICAM. Повышение адгезивности эндотелия имеет большое значение в патогенезе воспалительных процессов, атеросклерозе, септическом шоке. Однако до настоящего момента остается не изученным значение нарушения адгезивных свойств сосудистой стенки в патогенезе неоплазий различной локализации и развитии метастазирования малигнизированных клеток.
Значение эндотелиальных клеток в процессе ангиогенеза
Эндотелию принадлежит значительная роль в процессе ангиогенеза в условиях патологии. В стабильном состоянии эндотелиоциты пролиферируют лишь раз в 10 лет. Под действием ангиогенных факторов происходит пролиферация эндотелиоцитов, которая заканчивается их дифференцировкой и реэндотелизацией сосудов. Эндотелий активно участвует в процессе кооперации между эндотелиоцитами и окружающими клетками, выделяя факторы роста (VEGF, FGF-2), вызывая таксис и пролиферацию гладкомышечных клеток и фибробластов.
Эндотелиальная дисфункция является одним из универсальных патогенетических факторов развития таких форм патологии как атеросклероз, гипертоническая болезнь, сахарный диабет, тромбогеморрагический синдром и канцерогенез. Причинами эндотелиальной дисфункции могут быть ишемия, гипоксия тканей, свободно-радикальное повреждение, цитокины и ряд других факторов.
Заключение
В патогенезе заболеваний различного генеза большое значение имеют нарушения функциональной активности сосудистой стенки, являющейся, по существу, эндокринным органом, регулирующим состояние сосудистого тонуса, коагуляционного и тромбоцитарного-сосудистого звеньев системы гемостаза, фибринолиз, адгезивно-агрегационные способности эндотелия, процессы ангиогенеза, экспрессирующие белки МНС I и II классов, участвующих в ряде случаев в представлении антигенов-аллергенов, а также продуцирующим различные цитокины локального и системного действия. В патогенезе заболеваний различной этиологии важная роль относится эндотелиальной дисфункции, в связи с этим абсолютно необходимо знание многочисленных функций сосудистой стенки в условиях нормы и маркеров эндотелиальной дисфункции, свидетельствующих о развитии патологии.
Литература
1. Петрищев Н.Н., Власов Т.Д. Физиология и патофизиология эндотелия/Дисфункция эндотелия. Под ред. Н.Н. Петрищева. СПбГМУ 2003: стр. 4—38.
2. Киричук В. Ф., Ребров А. П., Россошанская С. И. Тромбоз. Гемостаз. Реология./Функции эндотелия сосудистой стенки 2005 №2: стр. 23
3. Каде А.Х., Занин С.А., Губарева Е.А., Туровая А.Ю., Богданова Ю.А., Апсалямова С.О., Мерзлякова С.Н. Физиологические функции сосудистого эндотелия // Фундаментальные исследования. – 2011. – № 11-3. – С. 611-617;
4. Барсуков В.Ю., Чеснокова Н.П., Агабеков А.И., Бизенкова М.Н. Показатели эндотелиальной дисфункции и состояния коагуляционного потенциала крови как объективные критерии инициации и малигнизации клеток при раке толстой кишки // Современные проблемы науки и образования. – 2015. – № 6.;
5. Агеев, Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечно-сосудистых заболеваний / Ф.Т. Агеев // ЖСН. 2004.-Т. 4, № 1.-С. 21-22.
6. Чурюканов М. В., Чурюканов В. В. Функциональная организация и терапевтический потенциал эндогенной каннабиноидной системы //Экспериментальная и клиническая фармакология. – 2004. – Т. 67. – №. 2. – С. 70-78.
7. Воскобой И. В., Семенов А. В., Мазуров А. В. и др. Активность тромбоцитов и функциональное состояние эндотелия у больных с нестабильной стенокардией с благоприятным и неблагоприятным исходом (проспективное исследование) / // Кардиология. — 2002. — № 9. — С. 4-11
9. Дзгоева Ф. У., Кутырина И. М. Тромбоксан А2 и простациклин у больных хроническим гломерулонефритом и ишемической болезнью сердца в условиях нефротоксического действия рентгеноконтрастных средств //Протективное действие антагонистов кальция. Тер. арх. – 2000. – Т. 6. – С. 42-45.
10. Айламазян Э. К., Мозговая Е. В. Гестоз: теория и практика //М.: МЕДпресс-информ. – 2008. – Т. 272.
11. Черток В. М., Коцюба А. Е. Эндотелиальный (интимальный) механизм регуляции мозговой гемодинамики: трансформация взглядов //Тихоокеанский медицинский журнал. – 2012. – №. 2 (48).
12. Бабак О. Я., Кравченко Н. А. Роль ренин-ангиотензиновой системы в ремоделировании сердца и сосудов //Укр. терапевт. журн. – 2005. – №. 2. – С. 89-96.
13. Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А. Эндотелины в норме и патологии //Международный журнал прикладных и фундаментальных исследований. – 2016. – №. 10-2. – С. 210-214.
14. Kitamura K. et al. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma //Biochemical and biophysical research communications. – 1993. – Т. 192. – №. 2. – С. 553-560
15. Suck G., Traut W. TROMB, a new retrotransposon of the gypsy–Ty3 group from the fly Megaselia scalaris //Gene. – 2000. – Т. 255. – №. 1. – С. 51-57.
16. Baylis C., Vallance P. Measurement of nitrite and nitrate levels in plasma and urine—what does this measure tell us about the activity of the endogenous nitric oxide system? Curr Opin Nephrol Hypertens 1998 Jan;7(l):59-62.
17. Moncada S., Vane J,R. Pharmacology and endogenous roles of prostaglandin endoperoxides, thromboxane A2 and prostacyclin. Pharmacol Rev 1979;30:293-331
18. Faraci F. M., Heistad D. D. Regulation of the cerebral circulation: role of endothelium and potassium channels //Physiological reviews. – 1998. – Т. 78. – №. 1. – С. 53-97.