Что такое гидроксония и как он образуется
Гидроксоний
| Гидроксоний | |
|---|---|
  | |
| Главное | |
| Систематическое название | Гидроксоний |
| Другое название | Ион гидроксония |
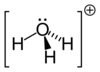
| Молекулярная формула | H3O + |
| Молярная масса | 19,02 г/моль |
| Свойства | |
| Константа диссоциации кислоты pKa | −1,7 |
| За исключением некоторых особых случаев, образуется при в стандартных условиях (25 °C, 100 кПа) | |
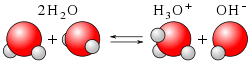
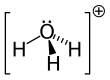
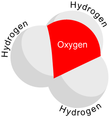
Гидроксо́ний (оксоний, гидроний) НзО + — комплексный ион, соединение протона с молекулой воды.
Водородные ионы в водных и спиртовых растворах кислот существуют в виде гидратированных или сольватированных ионов гидроксония. Для измерения концентрации водородных ионов используется водородный электрод.
Полезное
Смотреть что такое «Гидроксоний» в других словарях:
ГИДРОКСОНИЙ — Н3О+, гидратированный ион водорода; существует в водных растворах кислот … Большой Энциклопедический словарь
гидроксоний — сущ., кол во синонимов: 1 • гидроний (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
гидроксоний — Н3О+, гидратированный ион водорода; существует в водных растворах кислот. * * * ГИДРОКСОНИЙ ГИДРОКСОНИЙ, Н3О+, гидратированный ион водорода; существует в водных растворах кислот … Энциклопедический словарь
гидроксоний — oksonis statusas T sritis chemija apibrėžtis Hidratuotas protonas. formulė H₃O⁺ atitikmenys: angl. hydronium; hydroxonium; oxonium rus. гидроксоний; оксоний … Chemijos terminų aiškinamasis žodynas
Гидроксоний — гидратированный ион водорода H3O+: см. Гидроний и Оксониевые соединения … Большая советская энциклопедия
ГИДРОКСОНИЙ — Н3О+, гидратированный ион водорода; существует в вод. р рах кислот … Естествознание. Энциклопедический словарь
гидроксоний — ион оксония … Cловарь химических синонимов I
гидроксоний-катион — гидроксоний катион, гидроксония катиона … Орфографический словарь-справочник
Гидроксоний-ион — … Википедия
Ион гидроксония
| Ион гидроксония | |
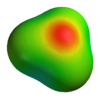
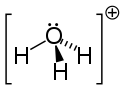   Структура иона гидроксония. | |
| Идентификация | |
|---|---|
| Название ИЮПАК | оксоний |
| Н о CAS | 13968-08-6 |
| PubChem | 123332 |
| ЧЭБИ | 29412 |
| Улыбки | |
| Химические свойства | |
| Грубая формула | H 3 O [изомеры] H 3 O + (водн.) |
| Молярная масса | 19,0232 ± 0,0005 г / моль H 15,9%, O 84,1%, |
| pKa | -1,74 при 25 ° C |
| Единицы СИ и СТП, если не указано иное. | |
редактировать  | |
Резюме
Номенклатура
Геометрия
Решение
Сольватации иона гидроксония в воде еще не полностью охарактеризованы. Преобладающая геометрия, выведенная из криоскопии воды, будет H 3 O + (H 2 O) 6. : каждый ион в среднем сольватирован шестью молекулами воды, которые больше не могут сольватировать другой ион.
Команда из Калифорнии предложила в 2010 году новую модель, основанную на анализе инфракрасной спектроскопии, согласно которой протоны сольватируются в виде агрегатов [H 13 O 6 ] + в котором положительный электрический заряд будет беспорядочно распределяться по шести молекулам воды.
Автопротолиз воды
Ион оксония постоянно присутствует в воде из-за реакции автопротолиза :
Общую схему реакции можно записать:
pH чистой воды при 25 ° C
Константа ионизации воды при 25 ° C записывается:
отсюда значение pH чистой воды при 25 ° C :
СОДЕРЖАНИЕ
Определение pH
В чистой воде одинаковое количество гидроксида и ионов H +, поэтому это нейтральный раствор. При 25 ° C (77 ° F) вода имеет pH 7 и pOH 7 (это меняется при изменении температуры: см. Самоионизация воды ). Значение pH менее 7 указывает на кислый раствор, а значение pH более 7 указывает на щелочной раствор.
Номенклатура
Ионов оксоний является любой ион с катионом трехвалентного кислорода. Например, протонированная гидроксильная группа представляет собой ион оксония, но не ион гидроксония.
Состав
Кислоты и кислотность
Гидратированный протон очень кислый: при 25 ° C его p K a составляет приблизительно 0. С другой стороны, Сильверштейн показал, что экспериментальные результаты Баллингера и Лонга подтверждают pKa 0,0 для водного протона.
Изначально предполагалось, что pH будет мерой концентрации водородных ионов в водном растворе. Практически все такие свободные протоны быстро гидратируются; поэтому кислотность водного раствора более точно определяется его концентрацией H + (водн.). В органических синтезах, таких как реакции, катализируемые кислотой, ион гидроксония ( H
3 О +
) используется взаимозаменяемо с H +
ион; выбор одного из них не оказывает существенного влияния на механизм реакции.
Решение
Исследователям еще предстоит полностью охарактеризовать сольватацию иона гидроксония в воде, отчасти потому, что существует много различных значений сольватации. Исследование депрессии точки замерзания показало, что средний ион гидратации в холодной воде составляет примерно H
3 О +
(ЧАС
2 O)
6 : в среднем каждый ион гидроксония сольватирован 6 молекулами воды, которые не могут сольватировать другие молекулы растворенного вещества.
Расчет энтальпий и свободных энергий различных водородных связей вокруг катиона гидроксония в жидкой протонированной воде при комнатной температуре в 2007 году и исследование механизма прыжков протона с использованием молекулярной динамики показали, что водородные связи вокруг иона гидроксония (образованные с помощью молекулярной динамики) три водных лиганда в первой сольватной оболочке гидроксония) довольно сильны по сравнению с лигандами объемной воды.
Стоянов предложил новую модель, основанную на инфракрасной спектроскопии, в которой протон существует как H
13 О +
6 ион. Таким образом, положительный заряд делокализован на 6 молекул воды.
Твердые соли гидроксония
Межзвездный H
3 О +
Межзвездная химия
Также стоит отметить, что относительные скорости реакций образования в таблице выше одинаковы для данной реакции при обеих температурах. Это связано с тем, что константы скорости этих реакций имеют константы β и γ равные 0, в результате чего k = α, который не зависит от температуры.
Поскольку все три реакции производят либо H
2 O или OH, эти результаты подтверждают тесную связь между их относительными содержаниями и H
3 О +
. Скорости этих шести реакций таковы, что они составляют приблизительно 99% химических взаимодействий иона гидроксония в этих условиях.
Астрономические открытия
За этими первыми обнаружениями последовали наблюдения ряда дополнительных H
3 О +
переходы. Первые наблюдения каждого последующего обнаружения перехода приведены ниже в хронологическом порядке:
Гидроний
СОДЕРЖАНИЕ
Определение pH [ править ]
В чистой воде содержится равное количество ионов гидроксида и гидроксония, поэтому это нейтральный раствор. При 25 ° C (77 ° F) вода имеет pH 7 и pOH 7 (это меняется при изменении температуры: см. Самоионизация воды ). Значение pH менее 7 указывает на кислый раствор, а значение pH более 7 указывает на щелочной раствор. [ необходима цитата ]
Номенклатура [ править ]
Ионов оксоний является любой ион с катионом трехвалентного кислорода. Например, протонированная гидроксильная группа представляет собой ион оксония, но не ион гидроксония. [ необходима цитата ]
Структура [ править ]
Кислоты и кислотность [ править ]
Изначально предполагалось, что pH будет мерой концентрации водородных ионов в водном растворе. [6] Практически все такие свободные протоны быстро реагируют с водой с образованием гидроксония; поэтому кислотность водного раствора более точно характеризуется концентрацией гидроксония. В органических синтезах, таких как реакции, катализируемые кислотой, ион гидроксония ( H
3 О +
) могут использоваться как взаимозаменяемые с H +
ион; выбор одного из них не оказывает существенного влияния на механизм реакции. [ необходима цитата ]
Решение [ править ]
Исследователям еще предстоит полностью охарактеризовать сольватацию иона гидроксония в воде, отчасти потому, что существует много различных значений сольватации. Исследование депрессии точки замерзания показало, что средний ион гидратации в холодной воде составляет примерно H
3 О +
(ЧАС
2 O)
6 : [7] в среднем каждый ион гидроксония сольватирован 6 молекулами воды, которые не могут сольватировать другие молекулы растворенного вещества. [ необходима цитата ]
Расчет энтальпий и свободных энергий различных водородных связей вокруг катиона гидроксония в жидкой протонированной воде [14] при комнатной температуре в 2007 году и исследование механизма прыжков протона с использованием молекулярной динамики показали, что водородные связи вокруг иона гидроксония ( образованные тремя водными лигандами в первой сольватной оболочке гидроксония), довольно сильны по сравнению с таковыми из объемной воды. [ необходима цитата ]
Новая модель была предложена Стояновым [15], основанная на инфракрасной спектроскопии, в которой протон существует как H
13 О +
6 ион. Таким образом, положительный заряд делокализован на 6 молекул воды. [ необходима цитата ]
Твердые соли гидроксония [ править ]
Межзвездный H
3 О +
[ редактировать ]
Гидроний является распространенным молекулярным ионом в межзвездной среде и обнаруживается в диффузных [18] и плотных [19] молекулярных облаках, а также в плазменных хвостах комет. [20] Межзвездные источники наблюдений гидрокония включают области Стрельца B2, Ориона OMC-1, Ориона BN – IRc2, Ориона KL и кометы Хейла – Боппа.
Межзвездная химия [ править ]
Также стоит отметить, что относительные скорости реакций образования в приведенной выше таблице одинаковы для данной реакции при обеих температурах. Это связано с тем, что константы скорости этих реакций имеют константы β и γ равные 0, в результате чего k = α, который не зависит от температуры. [ необходима цитата ]
Поскольку все три реакции производят либо H
2 O или OH, эти результаты подтверждают тесную связь между их относительными содержаниями и H
3 О +
. Скорости этих шести реакций таковы, что они составляют приблизительно 99% химических взаимодействий иона гидроксония в этих условиях. [ необходима цитата ]
Астрономические открытия [ править ]
За этими первыми обнаружениями последовали наблюдения ряда дополнительных H
3 О +
переходы. Первые наблюдения каждого последующего обнаружения перехода приведены ниже в хронологическом порядке:
Закон Оствальда, ион гидроксония и приложения закона действия массы к ионному равновесию
Применение закона действия массы к ионному равновесию
Электролитический раствор
По ионизации в воде Вещества подразделяются на:
Слабый электролит : «Неполная ионизация». Не ионизируйте полностью в воде, такой как слабые кислоты и слабые щелочи.
В слабых электролитах ионизируется только небольшое количество молекул, потому что одновременно происходят два противоположных процесса: диссоциация молекул на ионы и сочетание ионов с образованием молекул, когда скорости этих двух процессов равны, состояние равновесия достигается.
Водный раствор соляной кислоты является хорошим проводником электричества, но раствор уксусной кислоты является слабым из-за соляной кислоты из сильных кислот, которые полностью ионизированы, а уксусная кислота из слабых кислот, которые ионизированы не полностью.
С другой стороны, в случае ковалентных соединений, таких как газообразный хлористый водород и чистая этановая кислота, связи между их атомами в молекуле являются ковалентными, эти два вещества также ионизируются в воде, но с разной степенью, газообразный хлористый водород является ионизированная, почти 100% этановая кислота подвергается ионизации в гораздо меньшей степени, это можно проверить с помощью следующих экспериментов.
Эксперимент (1)
Эксперимент (2)
Эксперимент (3)
Заключение
Ион гидроксония
Слабый электролит → диссоциированные ионы
Закон Оствальда
Применяя закон действия масс к этой равновесной системе, получаем следующее соотношение.
Где [H + ], [A — ] представляют концентрацию образующихся ионов, [HA] представляет недиссоциированную кислоту в равновесном состоянии, K a представляет собой константу ионизации или диссоциации кислоты, Когда один моль слабой кислоты (HA ) растворяется в (V) литре раствора, затем при равновесии.
Степень ионизации = Количество диссоциированных молей / Общее количество молей перед
Если количество диссоциированных молей составляет (α) моль, то количество недиссоциированных молей из HA = (1 − α) и количество полученных молей (H + ) и (A — ) равно α моль. вещество (моль / л.
Концентрация (C) = количество молей / объем на литр (V)
В слабой (одноосновной или одноосновной) кислоте:
Если количество молей до диссоциации составляет 1 моль, следовательно, степень ионизации (α) равна количеству диссоциированных молей кислот, закон Оствальда для разбавления иллюстрирует количественное соотношение между степенью ионизации (α) и разбавлением.
Закон Оствальда: при постоянной температуре продукт умножения образовавшихся ионов, деленный на концентрацию неионизированных молей для слабых электролитов, является постоянным и называется константой ионизации.
При постоянной температуре степень ионизации (α) увеличивается за счет разбавления (так что значение K a остается постоянным). В случае слабых электролитов степень ионизации (α) достаточно мала, и ею можно пренебречь, следовательно, величиной ( 1 − α) считается приблизительно равным единице, и соотношение принимает вид K a = α² / V.
Поскольку концентрация слабой кислоты (C) = 1 / V моль / литр, приведенное выше уравнение принимает вид K a = α² × C
Это означает, что увеличение разведения (уменьшение концентрации) вызывает увеличение степени диссоциации и наоборот.
Закон Оствальда: Константа ионизации (K a ) для слабой кислоты с концентрацией (C) может быть определена из соотношения, K a = α² × C, где α — степень ионизации.
Расчет концентрации ионов гидроксония слабых кислот
Когда слабая кислота, такая как уксусная кислота с концентрацией (C), диссоциирует в воде в соответствии с уравнением
Константа диссоциации для такой реакции, K a = 1,8 · 10 −5.
Из приведенного выше уравнения количество выделенного ацетат-иона (CH 3 COO — ) равно количеству образовавшегося иона гидроксония (H 3 O + ).
Поскольку кислота слабая, количество диссоциированной кислоты (α) невелико, и им можно пренебречь, поэтому концентрация уксусной кислоты в равновесии (C − α) равна исходной концентрации уксусной кислоты (C), следовательно.
Слабые основания — это основания, которые частично диссоциируют в водных растворах, когда аммиак, слабое основание, растворяется в воде, происходит следующая равновесная реакция: