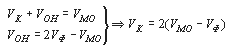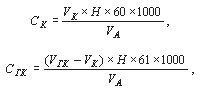Что такое гидрокарбонаты в воде
Что такое гидрокарбонаты в воде
Как отмечалось выше (в разделе «Щелочность и кислотность»), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0–8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН 4,1–4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислоты (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации – 0,05 моль/л либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0–8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции:
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
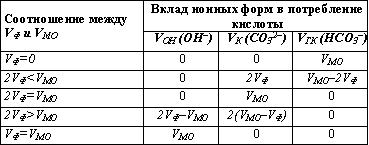
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (VМО) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты VМО содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (VФ) и метилоранжу (VМО). Рассмотрим несколько возможных вариантов, сопоставляя величины VФ и VМО.
VФ = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
VФ
VФ = VМО. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (СК) и гидрокарбонатами (СГК) в мг/л по формулам:
где:
VК и VГК – объем раствора соляной кислоты, израсходованный на титрование карбоната и гидрокарбоната соответственно, мл;
Н – точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.;
VА – объем пробы воды, взятой для анализа, мл;
60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях;
1000 – коэффициент пересчета единиц измерений.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в ммоль/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
Выполнение анализа
А. Титрование карбонат-аниона
 |
 |
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
5.1. Карбонаты и гидрокарбонаты
Как отмечалось выше (в разделе «Щелочность и кислотность), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной С02, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0-8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
OH-+H+=H2О
Определение гидрокарбонат-анионов основано на реакции:
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты (Vo) в миллилитрах, израсходованной на титрование карбоната (Vк) и гидрокарбоната (Vгк).
Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (Vмо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты Vmo содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (Vф) и метилоранжу (Vмо). Рассмотрим несколько возможных вариантов, сопоставляя величины Vo и vmo.
1. Vф=0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
5. Vф = Vмо. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных водах.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л.
При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу — общую щелочность, которая измеряется в мг-экв/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСОз.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т. к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Сульфаты, — распространенные компоненты природных вод. Их присутствие в воде обусловлено растворением некоторых минералов — природных сульфатов (гипс), а также переносом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы (IV) до оксида серы (VI), образования серной кислоты и ее нейтрализации (полной или частичной):
Наличие сульфатов в промышленных сточных водах обычно обусловлено технологическими процессами, протекающими с использованием серной кислоты (производство минеральных удобрений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического эффекта для человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250-400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например, сульфатных и кальциевых (в осадок выпадает CaS04).
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/л, лимитирующий показатель вредности — органолептический.
Хлориды присутствуют практически во всех пресных поверхностных и грунтовых водах, а также в питьевой воде, в виде солей металлов. Если в воде присутствует хлорид натрия, она имеет соленый вкус уже при концентрациях свыше 250 мг/л; в случае хлоридов кальция и магния соленость воды возникает при концентрациях свыше 1000 мг/л. Именно по органолептическому показателю — вкусу установлена ПДК для питьевой воды по хлоридам (350 мг/л), лимитирующий показатель вредности — органолептический.
Большие количества хлоридов могут образовываться в промышленных процессах концентрирования растворов, ионного обмена, высоливания и т. д., образуя сточные воды с высоким содержанием хлорид-аниона.
Высокие концентрации хлоридов в питьевой воде не оказывают токсических эффектов на людей, хотя соленые воды очень коррозионно активны по отношению к металлам, пагубно влияют на рост растений, вызывают засоление почв.
Сухой остаток характеризует содержание в воде нелетучих растворенных веществ (главным образом минеральных) и органических веществ, температура кипения которых превышает 105-110 °С.
Величину сухого остатка можно также оценить расчетным методом. При этом надо суммировать полученные в результате анализов концентрации растворенных в воде минеральных солей, а также органических веществ (гидрокарбонат суммируется в количестве 50 %). Для питьевой и природной воды величина сухого остатка практически равна сумме массовых концентраций анионов (карбоната, гидрокарбоната, хлорида, сульфата) и катионов (кальция и магния, а также определяемых расчетным методом натрия и калия).
Величина сухого остатка для поверхностных вод водоемов хозяйственно-питьевого и культурно-бытового водопользования не должна превышать 1000 мг/л (в отдельных случаях допускается до 1500 мг/л).
7. Общая жесткость, кальций и магний
Жесткость воды — одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. Жесткость воды пагубно сказывается на трубопроводах при использовании воды в тепловых сетях, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.
Жесткость воды обусловлена присутствием растворимых и малорастворимых солей-минералов, главным образом кальция (Са2+’) и магния (Mg2+).
Кроме указанных, к солям жесткости относят также соли стронция (Sr2+), цинка (Zn2+) и др., однако в поверхностных и грунтовых природных водах из перечисленных катионов заметных концентрациях присутствуют практически исключительно кальций и магний.
Величина жесткости воды может варьироваться в широких пределах в зависимости от типа пород и почв, слагающих бассейн водосбора, а также от сезона года, погодных условий. Общая жесткость воды в озерах и реках тундры, например, составляет 0,1-0,2 мг-экв/л, а в морях, океанах, подземных водах достигает 80-100 мг-экв/л и даже больше (Мертвое море). В табл. 11 приведены значения общей жесткости воды некоторых рек и водоемов России.
Значения общей жесткости воды некоторых рек и водоемов России
Море, озеро
Общая жесткость, мг-экв/л
Общая жесткость, мг-экв/л
Черное море
Волга
Балтийское море
Москва
Белое море
Иртыш
Оз. Балхаш
Оз. Байкал
Оз. Ладожское
Днепр
Из всех солей, относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Содержание других растворимых солей кальция и магния в природных водах обычно очень мало. Жесткость, придаваемая воде гидрокарбонатами, называется гидрокарбонатной, или временной, т. к. гидрокарбонаты при кипячении воды (точнее, при температуре более 60 °С) разлагаются с образованием малорастворимых карбонатов (Mg(HC03)2 в природных водах встречается реже, чем Са(НСОз)2, т. к. магнезитовые породы мало распространены. Поэтому в пресных водах преобладает так называемая кальциевая жесткость):
В природных условиях приведенная выше реакция обратима, однако при выходе на поверхность подземных (грунтовых) вод, обладающих значительной временной жесткостью, равновесие сдвигается в сторону образования СO2, который удаляется в атмосферу. Этот процесс приводит к разложению гидрокарбонатов и выпадению в осадок СаСОз и MgCO3. Таким путем образуются разновидности карбонатных пород, называемые известковыми туфами.
В присутствии растворенного в воде углекислого газа протекает и обратная реакция. Так происходит растворение, или вымывание, карбонатных пород в природных условиях.
Жесткость, обусловленная хлоридами или сульфатами, называется постоянной, т. к. эти соли устойчивы при нагревании и кипячении воды.
Суммарная жесткость воды, т. е. общее содержание растворимых солей кальция и магния, получила название «общей жесткости».
Ввиду того, что солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жесткости, или жесткость воды, измеряется в единицах эквивалентной концентрации — количеством г-экв/л или мг-экв/л. При жесткости до 4 мг-экв/л вода считается мягкой; от 4 до 8 мг-экв/л — средней жесткости; от 8 до 12 мг-экв/л — жесткой; более 12 мг-экв/л — очень жесткой (встречается и другая классификация воды по степеням жесткости)
Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7 мг-экв/л (в отдельных случаях — до 10 мг-экв/л), лимитирующий показатель вредности — органолептический.
8. Общее солесодержание
Для расчета общего солесодержания по сумме массовых концентраций главных анионов в миллиграмм-эквивалентной форме их массовые концентрации, определенные при анализе и выраженные в мг/л, умножают на коэффициенты, указанные в табл. 12, после чего суммируют.
Коэффициенты пересчета концентраций
Нитрит
Концентрацию катиона калия в данном расчете (для природных вод) условно учитывают в виде концентрации катиона натрия. Полученный результат округляют до целых чисел (мг/л).
9. Растворенный кислород
Кислород постоянно присутствует в растворенном виде в поверхностных водах. Содержание растворенного кислорода (РК) в воде характеризует кислородный режим водоема и имеет важнейшее значение для оценки экологического и санитарного состояния водоема. Кислород должен содержаться в воде в достаточном количестве, обеспечивая условия для дыхания гидробионтов. Он также необходим для самоочищения водоемов, т. к. участвует в процессах окисления органических и других примесей, разложения отмерших организмов. Снижение концентрации РК свидетельствует об изменении биологических процессов в водоеме, о загрязнении водоема биохимически интенсивно окисляющимися веществами (в первую очередь органическими). Потребление кислорода обусловлено также химическими процессами окисления содержащихся в воде примесей, а также дыханием водных организмов.
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями», т. е. в результате физико-химических и биохимических процессов. Кислород также поступает в водные объекты с дождевыми и снеговыми водами. Поэтому существует много причин, вызывающих повышение или снижение концентрации в воде растворенного кислорода.
Растворенный в воде кислород находится в виде гидратированных молекул О2. Содержание РК зависит от температуры, атмосферного давления, степени турбулизации воды, количества осадков, минерализации воды др. При каждом значении температуры существует равновесная концентрация кислорода, которую можно определить по специальным справочным таблицам, составленным для нормального атмосферного давления. Степень насыщения воды кислородом, соответствующая равновесной концентрации, принимается равной 100 %. Растворимость кислорода возрастает с уменьшением температуры и минерализации, и с увеличением атмосферного давления.
В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л и подвержено значительным сезонным и суточным колебаниям. В эвтрофированных и сильно загрязненных органическими соединениями водных объектах может иметь место значительный дефицит кислорода. Уменьшение концентрации РК до 2 мг/л вызывает массовую гибель рыб и других гидробионтов.
В воде водоемов в любой период года до 12 часов дня концентрация РК должна быть не менее 4 мг/л. ПДК растворенного в воде кислорода для рыбохозяйственных водоемов установлена 6 мг/л (для ценных пород рыбы), либо 4 мг/л (для остальных пород).
Растворенный кислород является весьма неустойчивым компонентом химического состава вод. При его определении особо тщательно следует проводить отбор проб: необходимо избегать контакта воды с воздухом до фиксации кислорода (связывания его в нерастворимое соединение).
В ходе анализа воды определяют концентрацию РК (в мг/л) и степень насыщения им воды (в %) по отношению к равновесному содержанию при данных температуре и атмосферном давлении.
Контроль содержания кислорода в воде — чрезвычайно важная проблема, в решении которой заинтересованы практически все отрасли народного хозяйства, включая черную и цветную металлургию, химическую промышленность, сельское хозяйство, медицину, биологию, рыбную и пищевую промышленность, службы охраны окружающей среды. Содержание РК определяют как в незагрязненных природных водах, так и в сточных водах после очистки. Процессы очистки сточных вод всегда сопровождаются контролем содержания кислорода. Определение РК является частью анализа при определении другого важнейшего показателя качества воды — биохимического потребления кислорода (БПК).
10. Биохимическое потребление кислорода (БПК)
В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т. п. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т. д. Органические загрязнения попадают в водоем разными путями, главньм образом со сточными водами и дождевыми поверхностными смывами с почвы.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. В водоемах с большим содержанием органических веществ большая часть РК потребляется на биохимическое окисление, лишая, таким образом, кислорода другие организмы. При этом увеличивается количество организмов, более устойчивых к низкому содержанию РК, исчезают кислородолюбивые виды и появляются виды, терпимые к дефициту кислорода. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации РК, и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т. е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления.
Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1) °С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК5) (Может определяться также БПК10 за 10 суток и БПКполн за 20 суток (при этом окисляется около 90 и 99 % органических веществ соответственно)), однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления (БПК10 или БПКполн. соответственно). Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света (в темном месте).
Величина БПК увеличивается со временем, достигая некоторого максимального значения — БПКполн.; причем загрязнители различной природы могут повышать (понижать) значение БПК. Динамика биохимического потребления кислорода при окислении органических веществ в воде приведена на рис.8.
Рис. 8. Динамика биохимического потребления кислорода:
а — легкоокисляющиеся («биологически мягкие») вещества — сахара, формальдегид, спирты, фенолы и т. п.;
в — нормально окисляющиеся вещества — нафтолы, крезолы, анионогенные ПАВ, сульфанол и т. п.;
с — тяжело окисляющиеся («биологически жесткие») вещества — неионогенные ПАВ, гидрохинон и т. п.
Таким образом, БПК — количество кислорода в (мг), требуемое для окисления находящихся в 1 л воды органических вещества в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде, биохимических процессов.
Ориентировочно принимают, что БПК5 составляет около 70 % БПКполн., но может составлять от 10 до 90 % в зависимости от окисляющегося вещества.