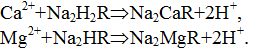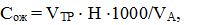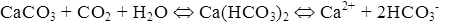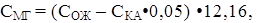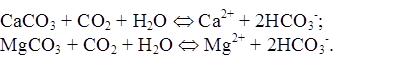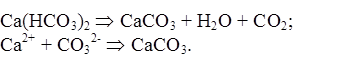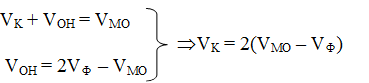Что такое гидрокарбонат в воде
Гидрокарбонаты в питьевой воде
Гидрокарбонаты в питьевой воде – это компоненты, определяющие ее щелочность. Их содержание в воде объясняется несколькими процессами:
Гидрокарбонаты в питьевой воде уменьшают количество водородных ионов, приводят к уменьшению кислотности и повышению щелочности. Благодаря высокой концентрации гидрокарбонатов некоторые минеральные воды могут использоваться для лечения гастритов и повышенной кислотности желудочного сока. В умеренных концентрациях гидрокарбонат-ионы необходимы качественной питьевой воде для поддержания нормальной щелочности, оптимального значения рН и приемлемых органолептических характеристик.
Зачем насыщать воду гидрокарбонатами
Гидрокарбонаты в воде нужны для того, чтобы корректировать водородный показатель pH воды и улучшить ее вкусовые свойства. Если щелочность низкая, уровень pH будет нестабилен вследствие низкой буферной емкости такой воды. Низкая (практически нулевая) щелочность и пониженные уровни рН характерны, в частности, для воды после очистки обратным осмосом.
Гидрокарбонаты в воде (природной) – это прежде всего соли кальция и магния (гидрокарбонаты этих элементов существуют только в растворенном состоянии). При нагреве и кипячении растворенные гидрокарбонаты элементов жесткости частично перейдут в нерастворимые карбонаты, и вода станет мягче.
При необходимости (например, после обратного осмоса) гидрокарбонаты в воде можно повысить, используя специально разработанные для этого модификации минеральной добавки «Северянка Бикарбонат». Помимо повышения щелочности питьевой воды и коррекции рН, эта добавка улучшает её вкусовые качества.
Полезные качества и показания к применению гидрокарбонатной минеральной воды
Каждый хоть раз сталкивался с симптомами гастрита или другими проблемами пищеварения. Для облегчения этих состояний приходится пить дорогостоящие препараты.
Но ведь легче предотвратить появление недуга. Гидрокарбонатная минеральная вода – альтернатива для профилактики и лечения отклонений в работе ЖКТ.
Что это за минералка?

Такие воды являются родниковыми, они обогащаются минеральными соединениями благодаря омовению и частичному растворению ископаемых, находящихся под землей.
Классификация
Прежде, чем отправиться в магазин, надо ознакомиться с разнообразием щелочных вод и разобраться в их отличиях.
Гидрокарбонатные воды делят по следующим признакам:
| Вид | Вместимость солей, г/л |
| Столовая | До 3 |
| Лечебно-столовая | 3-10 |
| Лечебная | Более 10 |
Среди всех вод 2 вида, выпускаемых в бутылках, гидрокарбонатные составляют приблизительно 30%. Они содержат много кислых солей угольной кислоты, до 15% хлоридов в виде поваренной соли.
По показателю вместимости солей и назначению применения двууглекислые воды делят на:
Польза от применения
Щелочная минералка:
Воду с бикарбонатами рекомендуют употреблять при нарушениях функций ЖКТ и мочевыделительной системы. Терапия помогает устранить такие неприятные симптомы, как изжога, отрыжка.
Как сделать выбор?
Минеральная вода предназначена для устранения различных отклонений, а не для утоления жажды. Применять ее следует по рекомендациям врача. Особенно дело касается лечебной воды.
В идеале пить минералку непосредственно из источника. Но для тех, у кого нет возможности отправиться на курорт, повсеместно продают минералку в бутылках.
Также существуют природные воды, изначально содержащие углекислоту. Их не подвергают искусственному газированию.

Желательно брать воду в стеклянной таре, так как пластик, при нарушении условий температурного режима хранения, выделяет вредные вещества, которые попадают в напиток.
Цена не является показателем высокого качества. Чаще всего, это признак отдаленности источника. Воды, разлитые в Европейских странах, стоят на порядок выше, чем добываемые в России и ближайшем зарубежье, ведь на их транспортировку затрачивают немалые средства.
Названия популярных марок
Некоторые бренды минералки заслужили доверие покупателей и высокую репутацию благодаря качеству и оздоровительным свойствам воды. Их названия используют как символ здоровья и долголетия.
Слабощелочные
Список лучших столовых вод:
Щелочные
Столово-лечебные воды пользуются наибольшей популярностью, имеют более насыщенный состав. Они помогают вылечить различные недуги, но при этом у них относительно мягкий вкус.
Самые знаменитые марки:
Сильнощелочные
Сильнощелочные воды обладают выраженным лечебным эффектом, применяются только по назначению врача. Для них характерен яркий специфический вкус. Пить такую воду следует в строго ограниченном количестве.
Наиболее распространенными являются:
От каких болезней помогает избавиться?
Если заболевание достаточно серьезное, одной водой вылечиться не удастся. Но при комплексной терапии, минералка дает положительные результаты и ускоряет выздоровление.
Ощелачивающие воды принимают при следующих болезнях:
Длительность, время приема и суточную норму указывает врач после осмотра, опроса пациента, тщательных исследований и постановки диагноза.
Противопоказания

Детям до трех лет также следует отказаться от этого лечебного напитка. Так как у малышей еще не сформированы ферменты, способные расщепить сложные элементы для полноценного усвоения.
Правила употребления для укрепления здоровья
Максимальную пользу несет свежая вода из источника, бутилированная – менее эффективна, но зато доступна в любом городе.
Важно принимать воду правильно. Для лучшего всасывания полезных компонентов следует пить ее неспеша в предписанном объеме.
Основные моменты при лечении минералкой:
| Диагноз | Когда пить |
| Профилактика | За 30 минут до еды |
| Язва желудка | После еды |
| Гастрит с пониженной кислотностью | Во время еды |
| Гастрит с повышенной кислотностью | Через час после еды |
При ухудшении состояния стоит перестать пить щелочную воду и записаться на прием к врачу.
Заключение
Устранение неприятных симптомов проще и приятней проводить натуральными средствами, чем медикаментами. Минеральные вещества необходимы для нормального функционирования ЖКТ. Но надо помнить, что минералка – это не просто жидкость, и что пить ее надо с учетом вышеприведенной информации.
Что такое гидрокарбонат в воде

Ремонт кулеров в Тамбове
Мы работаем для Вас в обычном режиме. Сделать заказ Вы можете по телефонам на сайте.
Бикарбонаты
Бикарбонаты – это соли угольной кислоты. Содержание бикарбонатов является важнейшим параметром для питьевой воды. Бикарбонаты попадают в воду из углекислого газа атмосферы и почвы. Также бикарбонаты образуются
в ходе растворения карбонатных пород. Измеряется содержание бикарбоната в количестве миллиграммов на один литр воды.
Бикарбонаты очень часто еще называют гидрокарбонатами, так как они хорошо растворяются в воде.
Если говорят про бикарбонаты в воде, то, как правило, подразумевается бикарбонат натрия (NaHCO3). Это вещество еще также часто называют пищевой или питьевой содой.
Бикарбонат натрия оказывает весьма позитивное воздействие на человеческий организм. Это вещество благотворно влияет на почки, способствует скорейшему выведению камней, обладает антисептическими свойствами, позволяет обеспечить должный уход за ротовой полостью. Однако повышенное содержание бикарбоната натрия может привести к обратному эффекту.
Также в воде содержатся бикарбонаты калия и магния, которые влияют на временную жесткость воды. Поэтому к концентрации карбонатов в питьевой воде выдвигаются повышенные требования. Нормой считается, если содержание гидрокарбонатов в питьевой воде не превышает 400 миллиграмм на литр.
СОДЕРЖАНИЕ РАСТВОРЁННОГО КИСЛОРОДА И ГИДРОКАРБОНАТОВ В ПОВЕРХНОСТНЫХ И ПОДЗЕМНЫХ ВОДАХ ГОРОДА КУРГАНА
В наше время почти на все водные объекты оказывается антропогенное влияние особенно на водоемы находящиеся в близи проживания человека поэтому важно вовремя проводить мероприятия, позволяющие в полной мере оценить показатели воды, которые непосредственным образом оказывают влияния на жизнь водоёма и его обитателей.
Одним из таких показателей является кислород. Большинство живых существ испытывают необходимость в кислороде и его соединениях обитатели водоёмов не исключения, поэтому концентрация кислорода в воде является важным показателям благополучия. Постоянное присутствие растворённого кислорода в поверхностных водах характеризует кислородный режим водоёмов и имеет первостепенное значение для оценки санитарного и экологического состояния. Для комфортного существования гидробионтов кислород должен присутствовать в воде в достаточном объёме. Так же не стоит принижать роль кислорода как участника разнообразных химических процессов, это такие процессы как окисление и разложения. Растворенный кислород оказывает сильное влияние на водный объект и поэтому необходимо наблюдать за концентрацией этого важнейшего показателя.
Немалую роль на процессы, протекающие в водоёме так же оказывают такие показатели как засоление, являясь возможно не самым важным показателям для водоёма в целом, оно оказывает большое влияние на жизнь рыб, беспозвоночных, и всевозможные виды водных растений. Соли, растворенные в воде на прямую, влияют на жизнь организмов, резистентность и обмен веществ.
Используя водные объекты для многих целей, например, таких как источник водоснабжения, в промысловых целях, отдыха возникает необходимость контроля показателей с целью определения изменения состояние экосистемы. Поэтому своевременное проведение данных исследований не вызывает сомнений.
Объектом исследования являются водоёмы, города Кургана.
Предмет: оценка содержание молекулярного кислорода и гидрокарбонатов в пробах воды взятых из разных источников.
Цель работы: Теоретически обосновать динамику растворённого кислорода и гидрокарбонатов в поверхностных и подземных водах города Кургана и определить содержания кислорода и гидрокарбонатов в поверхностных и подземных водах города Кургана.
Гипотезы исследования:
1)Содержания молекулярного кислорода и гидрокарбонатов зависит от температуры, водной растительности, уровня загрязнения, химического состава воды.
2)На состав гидробионтов озер оказывают влияние комплекс факторов.
Для доказательства гипотезы и достижения поставленной цели решали следующие задачи:
1.Провести теоретическое обоснование динамики растворённого кислорода и гидрокарбонатов в поверхностных и подземных водах города Кургана.
2.Подобрать методики определения молекулярного кислорода и гидрокарбонатов и отработать их.
3.Определить содержание молекулярного кислорода и гидрокарбонатов в пробах.
4. Проанализировать полученные результаты
Методы: теоретический 1) формализация 2) моделирование
Инструментальный 1) кондуктометрический 2) потенциометрический
Теоретическое значение – проведено теоретическое обоснование динамики растворённого кислорода и гидрокарбонатов в поверхностных и подземных водах города Кургана.
Практическая значимость определения молекулярного кислорода и гидрокарбонатов заключается в том, что полученные знания можно будет использовать как основу для разработки мероприятий по аэрации водоемов,
и как контроль за протекающими в воде процессами с целью недопущения экологических бедствий.
Глава 1. Газовые компоненты в природных водах и факторы на них влияющие
1.1 Растворенный кислород в воде и его содержание
Кислород это один из главных растворенных газов, который всегда присутствует в поверхностных водах он имеет первостепенное значение для оценки его экологического и санитарного состояния. Находясь в водоёмах в достаточном количестве, он обеспечивает необходимые условия для дыхания гидробионтов. Также участвует в процессах разложения отмерших организмов и окисляет различные примеси.
В природной воде он находится в виде гидратированных молекул O2. Насыщение вод кислородом происходит в результате процессов фотосинтеза водной растительности, может поступать в водоемы с осадками, так же поступает в результате абсорбции кислорода из атмосферы. Абсорбция кислорода из атмосферы происходит на поверхности воды. Скорость этого процесса уменьшается с повышением температуры, с понижением давления и повышением минерализации.
Понижение его до 2 мг/дм 3 вызывает массовую гибель (замор) рыбы. В свою очередь и избыток кислорода не несёт не чего хорошего для водных обитателей и может привести их к гибели. Перенасыщение воды кислородом наблюдается в водоемах при сильном освещении, недостаточно сильном перемешивании слоёв воды и мощном развитии зеленых водорослей.
1.1.1 Факторы, влияющие на растворимость кислорода
Растворенный кислород в поверхностных водах находится в виде молекул О2. На растворимость кислорода в воде оказывают влияние температура, минерализация и давление (Таблица 1). Чем ниже температура и минерализация и больше атмосферное давление, тем больше растворимость кислорода в воде. Величину растворимости кислорода при нормальном давлении называют нормальной концентрацией. Насыщение воды кислородом, соответствующее нормальной концентрации, принимается равным 100%.
Таблица 1: Зависимость растворимости кислорода от температуры при атмосферном давлении 760 мм рт. ст.
1. Водоемы и показатели качества воды
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
1. Водоемы и показатели качества воды
1.2. Показатели экологического состояния водоемов и качества поверхностных вод
1.2.4. Минеральный состав воды
Минерализация – суммарное содержание всех найденных при химическом анализе воды минеральных веществ; обычно выражается в мг/дм 3 (до 1000 мг/дм 3 ) и ‰ (промилле или тысячная доля при минерализации более 1000 мг/дм 3 ).
Классификация природных вод по минерализации
Минерализация, г/дм 3
Многие производства, сельское хозяйство, предприятия питьевого водоснабжения предъявляют определенные требования к качеству вод, в частности, к минерализации, так как воды, содержащие большое количество солей, отрицательно влияют на растительные и животные организмы, технологию производства и качество продукции, вызывают образование накипи на стенках котлов, коррозию, засоление почв.
Минеральный состав воды интересен тем, что отражает результат взаимодействия воды как физической фазы и среды жизни с другими фазами (средами): твердой, т.е. береговыми подстилающими, а также почвообразующими минералами и породами; газообразной (с воздушной средой) и содержащейся в ней влагой и минеральными компонентами. Кроме того, минеральный состав воды обусловлен целым рядом протекающих в разный средах физико-химических и физических процессов – растворения и кристаллизации, пептизации и коагуляции, седиментации, испарения и конденсации и др. Большое влияние на минеральный состав воды поверхностных водоемов оказывают протекающие в атмосфере и в других средах химические реакции с участием соединений азота, углерода, кислорода, серы и др.
Можно выделить две группы минеральных солей, обычно встречающихся в природных водах (табл. 8).
Основные компоненты минерального состава воды
Компонент минерального состава воды
Предельно допустимая концентрация
Тяжелые металлы (сумма)
Железо общее (сумма Fе 2+ и Fe 4+ )
Как видно из табл. 8, основной вклад в минеральный состав вносят соли 1-й группы (они образуют так называемые «главные ионы»), которые определяют в первую очередь. К ним относятся хлориды, карбонаты, гидрокарбонаты, сульфаты. Соответствующими катионами для названных анионов являются калий, натрий, кальций, магний. Соли 2-й группы также необходимо учитывать при оценке качества воды, т.к. на каждую из них установлено значение ПДК, хотя они вносят незначительный вклад в солесодержание природных вод.
Соотношение концентрации в воде главных ионов (в мг-экв/л) определяет типы химического состава воды. В зависимости от преобладающего вида анионов (>25 % эквивалента при условии, что суммы мг-экв анионов и катионов принимаются равными 50 % соответственно каждая) различают воды гидрокарбонатного класса (концентрация НСО3 >25 % экв. анионов), сульфатного (SО4 >25 % экв.), хлоридного (С1 >25 %, экв.). Иногда выделяют также воды смешанных, или промежуточных, типов. Соответственно, среди катионов выделяются группы кальциевых, магниевых, натриевых или калиевых вод.
Минерализация воды имеет важнейшее значение при характеристике химического состава вод. При этом проводят анализы воды на содержание минеральных компонентов в различные периоды: для поверхностных вод – в зимнюю межень, весеннее половодье (пик), летне-осеннюю межень, летне-осенний паводок; для вод заболоченных участков – в зимнюю межень; весеннее половодье, для почвенных вод – в зимнюю межень, весеннее половодье и летне-осеннюю межень.
Концентрации растворенных в воде минеральных солей, определяют, как правило, химическими методами – титриметрическим, колориметрическим. Концентрации некоторых компонентов (например, катионов натрия, калия) в воде можно оценить расчетными методами, имея данные о значениях концентраций других катионов и анионов.
Жесткость. Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Из всех солей, относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Суммарное содержание растворимых солей кальция и магния называют общей жесткостью. Общая жесткость подразделяется на карбонатную, обусловленную концентрацией гидрокарбонатов (и карбонатов при рН 8,3) кальция и магния, и некарбонатную – концентрацию в воде кальциевых и магниевых солей сильных кислот. Поскольку при кипячении воды (точнее при температуре более 60 0 С) гидрокарбонаты переходят в карбонаты, которые выпадают в осадок, карбонатную жесткость называют временной или устранимой. Остающаяся после кипячения жесткость (обусловленная хлоридами или сульфатами) называется постоянной.
Жесткость воды — одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находят ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. Жесткость воды пагубно сказывается на трубопроводах при использовании воды в тепловых сетях, приводит к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.
В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обусловливающих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического выветривания горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Обычно преобладает жесткость, обусловленная ионами кальция (до 70 %); однако в отдельных случаях магниевая жесткость может достигать 50–60 %. Жесткость морской воды и океанов значительно выше (десятки и сотни мг-экв/дм 3 ). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья.
Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения.
Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более
7 мг-экв/л (в отдельных случаях – до 10 мг-экв/л), лимитирующий показатель вредности – органолептический.
Предлагаемый метод определения общей жесткости как суммарной массовой концентрации катионов кальция и магния основан на реакции солей кальция и магния с реактивом – трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты):
где R – радикал этилендиаминтетрауксусной кислоты.
Анализ проводят в аммиачном буферном растворе при рН 10,0-10,5 титриметрическим методом в присутствии индикатора хрома темно-синего кислотного.
Общую жесткость (Сож) в мг-экв/л вычисляют по формуле:
где: VTP – объем раствора трилона Б, израсходованного на титрование, мл;
Н – концентрация титрованного раствора трилона Б с учетом поправочного коэффициента, г-экв/л;
VA – объем воды, взятой на анализ, мл;
1000 – коэффициент пересчета единиц измерения из г-экв/л в мг-экв/л.
Определение общей жесткости воды
Оборудование и реактивы
Баня водяная; ножницы; палочка стеклянная; пипетка на 2 мл или на
5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Вода дистиллированная; раствор буферный аммиачный; раствор индикатора хром темно-синего кислотного; раствор трилона Б (0,05 г-экв/л).
О приготовлении растворов см. приложение 3.
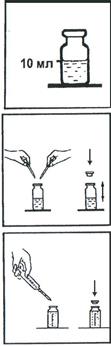
2. Добавьте в склянку пипетками 6-7 капель раствора буферного аммиачного и 4-5 капель раствора индикатора хрома темно-синего кислотного.
3. Герметично закройте склянку пробкой и встряхните для перемешивания.
4. Постепенно титруйте содержимое склянки раствором трилона Б до перехода окраски в точке эквивалентности из винно-красной в ярко-голубую. Периодически встряхивайте склянку для перемешивания пробы. Определите объем раствора, израсходованный на титрование общей жесткости (Vож, мл).
5. Рассчитайте величину общей жесткости (Сож) в мг-экв/л по формуле: Cож = Vож × 5.
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции, после чего принять решение об окончании титрования (окраска раствора может несколько восстановиться. В этом случае необходимо добавить еще некоторое количество раствора трилона Б).
Кальций. Главными источниками поступления кальция в поверхностные воды являются процессы химического выветривания и растворения минералов, прежде всего известняков, доломитов, гипса, кальцийсодержащих силикатов и других осадочных и метаморфических
пород.
Растворению способствуют микробиологические процессы разложения органических веществ, сопровождающиеся понижением рН.
Большие количества кальция выносятся со сточными водами силикатной, металлургической, стекольной, химической промышленности и со стоками с сельскохозяйственных угодий, особенно при использовании кальцийсодержащих минеральных удобрений.
Характерной особенностью кальция является склонность образовывать в поверхностных водах довольно устойчивые пересыщенные растворы CaCO3. Ионная форма (Ca 2+ ) характерна только для маломинерализованных природных вод. Известны довольно устойчивые комплексные соединения кальция с органическими веществами, содержащимися в воде. В некоторых маломинерализованных окрашенных водах до
90-100 % ионов кальция могут быть связаны гумусовыми кислотами.
Концентрация кальция в поверхностных водах подвержена заметным сезонным колебаниям. В период понижения минерализации (весной) ионам кальция принадлежит преобладающая роль, что связано с легкостью выщелачивания растворимых солей кальция из поверхностного слоя почв и пород.
Довольно жесткие требования по содержанию кальция предъявляются к водам, питающим паросиловые установки, поскольку в присутствии карбонатов, сульфатов и ряда других анионов кальций образует прочную накипь. Данные о содержании кальция в водах необходимы также при решении вопросов, связанных с формированием химического состава природных вод, их происхождением, а также при исследовании карбонатно-кальциевого равновесия.
Метод определения массовой концентрации катиона кальция (ГОСТ 1030) аналогичен методу определения общей жесткости с реактивом трилоном Б с той разницей, что анализ проводится в сильнощелочной среде (рН 12-13) в присутствии индикатора мурексида.
Массовую концентрацию кальция рассчитывают по результатам титрования по такой же формуле. Определению кальция мешают карбонаты и диоксид углерода, удаляемые из пробы при ее подкислении.
Оборудование и реактивы
Баня водяная; ножницы; палочка стеклянная; пипетка на 2 мл или на
5 мл со шприцем и соединительной трубкой; пипетка-капельница
(0,5 мл); склянка с меткой «10 мл».
Бумага индикаторная универсальная; вода дистиллированная; индикатор мурексид в капсулах (по 0,03 г); раствор буферный аммиачный; раствор гидроксида натрия (10 %); раствор соляной кислоты (1:100); раствор трилона Б (0,05 г-экв/л).
О приготовление растворов см. приложение 3.
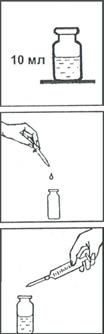
1. В склянку с меткой «10 мл» налейте до метки анализируемую воду.
2. Далее из раствора удаляется гидрокарбонат-анион. Для этого в склянку прибавьте по каплям раствор соляной кислоты (1:100) при интенсивном перемешивании стеклянной палочкой до достижения величины рН раствора 4-5 (при перемешивании удаляется и большая часть диоксида углерода, мешающего определению).
Величину рН контролируйте с помощью бумаги индикаторной универсальной.
3. К пробе прибавьте пипеткой-капельницей 13-14 капель (около 0,5 мг) раствора гидроокиси натрия и содержимое одной капсулы (0,02-0,03 г) индикатора мурексида. Раствор перемешайте стеклянной палочкой.
4. Затем проведите титрование раствором трилона Б из пипетки на 5 мл на черном фоне до перехода окраски в точке эквивалентности из оранжевой в сине-фиолетовую. Определите объем раствора трилона Б, израсходованный на титрование кальция (VКА, мл).
5. Рассчитайте массовую концентрацию кальция (СКА) в мг-экв/л по уравнению:
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции, после чего принять решение об окончании титрования (окраска раствора может несколько восстановиться. В этом случае необходимо добавить еще некоторое количество раствора трилона Б).
Магний. В поверхностные воды магний поступает в основном за счет процессов химического выветривания и растворения доломитов, мергелей и других минералов. Значительные количества магния могут поступать в водные объекты со сточными водами металлургических, силикатных, текстильных и других предприятий.
Содержание магния в поверхностных водах подвержено заметным колебаниям: как правило, максимальные концентрации наблюдаются в меженный период, минимальные — в период половодья.
Для определения содержания магния в незагрязненных поверхностных и грунтовых природных водах, как и в большинстве речных вод, можно применять расчетный метод по разности результатов определения общей жесткости и концентрации катиона кальция. Для анализа загрязненных вод на содержание магния необходимо применять прямое определение магния.
Массовую концентрацию катиона магния (Смг) в мг/л определяют расчетным методом, производя вычисления по формуле:
где СОЖ и СКА – результаты определения общей жесткости (мг-экв/л) и массовой концентрации катиона кальция (мг/л) соответственно; 0,05 – коэффициент пересчета концентрации катиона кальция в миллиграмм-эквивалентную форму; 12,16 – эквивалентная масса магния.
Полученный результат округлите до целых чисел (мг/л).
Карбонаты и гидрокарбонаты. Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов, например:
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
Как отмечалось выше (в разделе «Щелочность и кислотность»), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферного СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0-8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН. 4,1-4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислот (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксол-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации 0,05 г-экв/л либо 0,1 г-экв/л.
Определение гидрокарбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0-8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции:
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты (V0) в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (Vмо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты Vмо содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обусловливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (Vф) и метилоранжу (Vмо). Рассмотрим несколько возможных вариантов, сопоставляя величины Vф и Vмо.
1. Vф = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
2. Vф ¹ 0, причем 2Vф Vмо. В данном случае в исходной пробе гидрокарбонаты отсутствуют, но присутствуют не только карбонаты, но и другие потребляющие кислоту анионы, а именно – гидроксо-анионы. При этом содержание последних эквивалентно составляет Vон = 2Vф – Vмо. Содержание карбонатов можно рассчитать, составив и решив систему уравнений:
5. VФ = Vмо. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основе уравнений реакций потребления кислоты карбонатами (Ск) и гидрокарбонатами (Сгк) в мг/л по формулам:
где Vк и Vгк – объем раствора соляной кислоты, израсходованной на титрование карбоната и гидрокарбоната соответственно, мл; Н – точная концентрация титрованного раствора соляной кислоты (нормальность), г-экв/л; VA – объем пробы воды, взятой для анализа, мл; 60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях; 1000 – коэффициент пересчета единиц измерений.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в мг-экв/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что при анализе сточных и загрязненных природных вод получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл с резиновой грушей (медицинским шприцем) и соединительной трубкой; пипетка-капельница, склянка с меткой «10мл».
Раствор индикатора метилового оранжевого 0,1 %-ный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 г-экв/л).
О приготовлении растворов см. приложение 3.
1. Титрование карбонат-аниона
1. В склянку налейте до метки (10 мл) анализируемую воду.
2. Добавьте пипеткой 3-4 капли раствора фенолфталеина.
Примечание. При отсутствии окрашивания раствора либо при слабо-розовом окрашивании считается, что карбонат-анион в пробе отсутствует (рН пробы меньше 8,0-8,2).
3. Постепенно титруйте пробу с помощью мерного шприца с наконечником либо мерной пипетки раствором соляной кислоты (0,05 г-экв/л) до тех пор, пока окраска побледнеет до слабо-розовой, и определите объем раствора соляной кислоты, израсходованный на титрование по фенолфталеину (Уф, мл).
2. Титрование гидрокарбонат-аниона
4. В склянку налейте до метки (10 мл) анализируемую воду либо используйте раствор после определения карбонат-аниона.
5. Добавьте пипеткой 1 каплю раствора метилового оранжевого.
Примечание. Для более четкого определения момента окончания титрования определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
6. Постепенно титруйте пробу с помощью мерного шприца с наконечником раствором соляной кислоты (0,05 г-экв/л) при перемешивании до перехода желтой окраски в розовую, определяя общий объем раствора, израсходованного на титрование по метилоранжу
(Vмо, мл). При использовании раствора после определения карбонат-аниона необходимо определить суммарный объем, израсходованный на титрование карбоната и гидрокарбоната.
Обязательно перемешивайте раствор при титровании!
Момент окончания титрования определяйте по контрольной пробе.
3. Определение ионных форм, обусловливающих потребление кислоты на титрование
В зависимости от соотношения между количествами кислоты, израсходованными на титрование по фенолфталеину (Vф) и метилоранжу (Vмо), по табл. 9 выберите подходящий вариант для вычисления ионных форм, обусловливающих потребление кислоты при титровании. Раствор после титрования карбонат-аниона оставьте для дальнейшего определения в нем массовой концентрации гидрокарбонат-аниона.
Определение ионных форм, обусловливающих потребление кислоты
на титрование