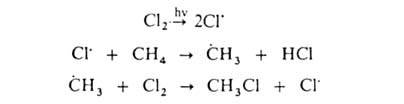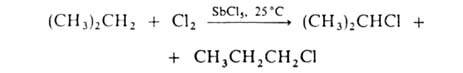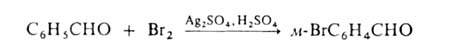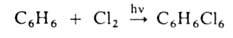Что такое гидрогалогенирование в химии
ГИДРОГАЛОГЕНИРОВАНИЕ
присоединение галогено-водородов по кратным связям орг. соед., напр.:
Реакц. способность галогеноводородов возрастает в ряду: HF
Полезное
Смотреть что такое «ГИДРОГАЛОГЕНИРОВАНИЕ» в других словарях:
гидрогалогенирование — hidrohalogeninimas statusas T sritis chemija apibrėžtis Vandenilio halogenido prijungimas prie daugiagubojo ryšio. atitikmenys: angl. hydrohalogenation rus. гидрогалогенирование … Chemijos terminų aiškinamasis žodynas
Алкены — У этого термина существуют и другие значения, см. Алкен (значения). Пространственная структура этилена. Алкены (олефины, этиленовые углеводороды) ациклические непредельные углеводороды … Википедия
АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ — (от греч. aleiphar, род. падеж aleiphatos масло, смола, жир) (соединения жирного ряда, ациклич. соединения), углеводороды и их производные, углеродные атомы к рых связаны между собой в открытые неразветвленные или разветвленные цепи. Об алифатич … Химическая энциклопедия
ГАЛОГЕНЗАМЕЩЕННЫЕ УГЛЕВОДОРОДОВ — орг. соед., в молекулах к рых содержатся атомы галогенов, связанные с углеводородными радикалами (алифатич., ароматич. и алициклическими). В зависимости от характера радикала, у к рого находится атом галогена, в алифатич. ряду различают первичные … Химическая энциклопедия
ГАЛОГЕНИРОВАНИЕ — (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р ций замещения (заместительное Г.) или присоединения (присоединительное Г.). Заместительное галогенирование. При действии галогенов на насыщ. углеводороды… … Химическая энциклопедия
ОЛЕФИНЫ — (от лат. oleum масло) (алкены, этиленовые углеводороды), ненасыщ. ациклич. углеводороды, содержащие одну двойную связь С=С; общая ф ла С n Н 2n. Атомы углерода при двойной связи имеют sp2 гибридизацию и образуют s и p связи. Последняя состоит из… … Химическая энциклопедия
ЭПОКСИДНОЕ ЧИСЛО — количество к ты HHal (в молях), необходимое для гидрогалогенирования эпоксидных групп, содержащихся в 100 г орг. в ва. Характеризует содержание a эпоксидных групп (этиленоксидных, пропиленоксидных или глицидиловых). Определение эпоксидных групп… … Химическая энциклопедия
Этилен — Этилен … Википедия
Химическая энциклопедия
ГИДРОГАЛОГЕНИРОВАНИЕ
Реакц. способность галогеноводородов возрастает в ряду: HF < НС1 < НВг < HI.
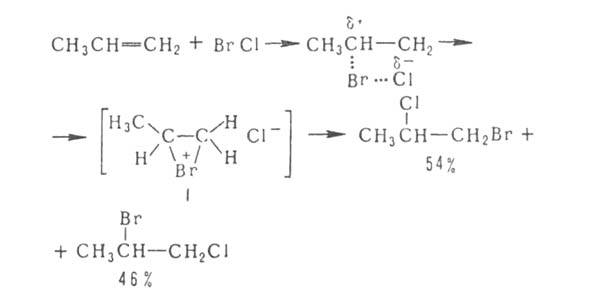
Г. протекает по гетеролитич. механизму, при к-ром водород присоединяется к Наиб. гидрогенизированному атому углерода ( Марковникова правило). В случае несимметричных олефинов происходит образование вторичных или третичных алкилгалогенидов, напр.:
Реакц. способность олефина повышается при введении в его молекулу электронодонорных групп и понижается при введении электроноакцепторных в след. ряду:
Присоединение галогеноводородов к связям С=С, сопряженным с электроноакцепторными группами, напр. С=О, COOR, CN, протекает медленнее, чем в случае изолированных связей. Атом галогена присоединяется в положение к электроноакцепторной группе:
Поскольку при Г. образуется промежут. карбкатион, в ходе р-ции возможно образование изомерных продуктов, напр.:
В среде нуклеоф. р-рителей возможна конкурирующая р-ция с р-рителем, напр.:
В присут. инициаторов радикальных р-ций Г. идет по го-молитич. механизму против правила Марковникова (эффект Караша), напр.:
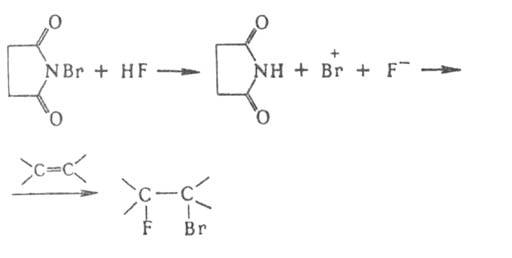
Г. широко применяется в орг. синтезе. При гидрофторировании хлорированных олефинов р-цию проводят в автоклаве:
Обычно гидрохлорирование и гидрооромирование в газовой фазе проводят, пропуская газообразные галогеноводороды в жидкий олефин при Ч 20
галогенирование
ГАЛОГЕНИРОВАНИЕ (галоидирование)
введение галогена в молекулу орг. соединения. Осуществляют путем реакций замещения (заместительное Г.) или присоединения (присоединительное Г.).
Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
По свободнорадикальному механизму идет также Г. углеводородных цепей жирноароматич. соединений. В присут. кислот Льюиса реакция протекает по электроф. механизму, напр.:
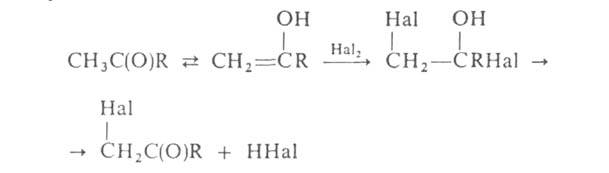
Г. алифатич. карбоновых кислот в α-положение проводят с помощью Cl2 или Br2 в присутствии красного Р (Гелля-Фольгарда-Зелинского реакция). Замещение α-водородных атомов в алифатич. и жирноароматич. карбонильных соед. идет через присоединение галогена к енольной форме, напр.:
Действием N-галогенамидов, гл. обр. N-бромсукцинимида, в присутствии пероксидов осуществляют свободнорадикальное Г. олефинов, жирноароматич. и гетероароматич. соед. по метальной или метиленовой группе, соседней с двойной связью или циклом (Воля — Циглера реакция).
Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (реакция Саймонса), действием CoF3 и др.
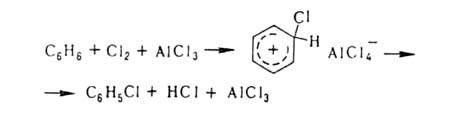
Заместительное Г. в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов ( гл. обр. апротонных или протонных кислот), напр.:
Если в ядре этих соед. присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной кислоты (реакция Биркенбаха — Губо — Уотерса), напр.:
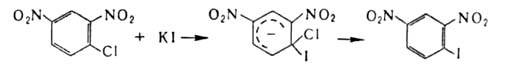
Замещение на галоген атомов, отличных от водорода, или группы атомов осуществляется чаще всего по нуклеоф. механизму. В алифатич. соед. для замены атомов галогенов ( гл. обр. С1 или Br) на иод используют Nal (Финкельштапна реакция), а на фтор-SbF3 (реакция Свартса). Группы OH замещают на хлор или бром действием соответствующих галогеноводородов, тригалогенидов или оксигалогенидов фосфора, а также тионилгалогенидов, а на фтор-действием диэтил-1,1,2-трифтор-2-хлорэтиламина или SF4. Карбоксильную группу замещают на С1, Br или I действием на серебряные соли карбоновых кислот соответствующего галогена (Бородина — Хунсдиккера реакция]. Заменой карбонильного кислорода в альдегидах или кетонах на галоген ( напр., с помощью PCl5, PBr5, SF4, MoF6) получают геминальные галогензамещенные.
В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Br или I каталитич. разложением соответствующих солей диазония в присутствии порошка Cu (Гаттермана-Коха реакция) или действием солей Cu (Зандмепера реакция), а на F-разложением гидрофторидов диазония (Шимана реакция). Для Г. ароматич. и гетероароматич. соед. используют также реакцию замещения ( в т. ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионных
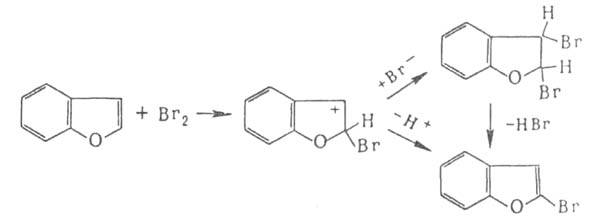
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:
Если цикл активирован, реакция может протекать по ионному механизму, который включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещения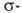
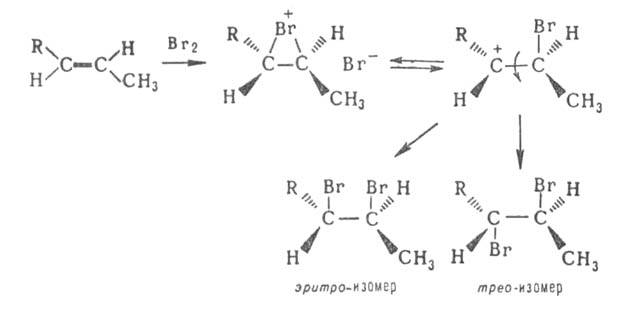
Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов ( см. гидрогалогенирование), межгалогенных соед. ( напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона формулы I, напр.:
Способность галогенов образовывать такие промежут. катионы возрастает в ряду: F » С1 соотв. 63 и 37%:
Присоединительное Г. применяют для получения вицинальных и геминальных дигалогензамещенных, напр.:
Для введения в молекулу атома F широко используют варианты сопряженного присоединения аниона F − и связанного с ним катиона по кратной связи в среде HF, напр.:
Иногда Г. (заместительное и присоединительное) проводят действием галогеноводородов (HCl или HBr) и окислителя ( т. наз. окислительное Г.). Реакцию осуществляют в жидкой или газовой фазе (окислители соотв. H2O2 и O2) в присутствии соли Cu на пемзе.
Лит.: Тереитьев А. П., Яновская Л. А., в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957, с. 7–342; Кнунянц И. Л., Сокольский Г. А., там же, с. 343–87; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ.. М., 1973, с. 374–468; Эфрос Л. С, Горелик М. В., Химия и технология промежуточных продуктов. Л., 1980; Чамберс Р. Д., Джеймс С. Р, в кн.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 622–719.
Типы химических реакций в органической химии
Реакции присоединения
Реакции присоединения характерны для соединений с кратными связями, таких как алкены, алкины, альдегиды, а также для циклических соединений. В зависимости от того, какая молекула выступает в качестве реагента, различают реакции гидрирования, гидрогалогенирования, галогенирования, гидратации и др.
Гидрирование — реакция присоединения молекулы водорода по кратной связи:
Гидрогалогенирование — реакция присоединения галогеноводорода (например, гидрохлорирование):
Галогенирование — реакция присоединения галогена (например, хлорирование):
Гидратация — реакция присоединения воды:
Полимеризация — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
Примером реакции полимеризации может служить получение полиэтилена из этилена (этена):
Реакции отщепления (элиминирования)
Примерами таких реакций может служить получение этилена из различных органических веществ.
Дегидрирование (отщепление водорода) этана:
Дегидратация (отщепление воды) этанола:
Дегидрогалогенирование (например, отщепление хлороводорода) хлорэтана:
Дегалогенирование (например, отщепление двух атомов хлора) 1,2-дихлорэтана:
Особое значение среди реакций отщепления имеет реакция термического расщепления углеводородов, на которой основан крекинг (от англ. to crack — расщеплять) алканов — важнейший технологический процесс: