Что такое гидрофобные взаимодействия
ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ
ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ (от греч. hydor-вода и phobos-боязнь, страх), сильное притяжение в воде между неполярными частицами (молекулами, остатками сложных молекул, частицами дисперсной фазы и т. п.). Причина гидрофобного взаимодействия-большая энергия водородной связи между молекулами воды, превосходящая энергию их взаимод. с неполярными частицами. Термодинамич. невыгодность контакта воды с неполярными в-вами (рассматриваемая как гидрофобность) и предопределяет сильное притяжение их молекул друг к другу.
Гидрофобное взаимодействие между неполярными атомными группами (углеводородными, галогенуглеродными и т.п.), входящими в состав большинства орг. молекул, определяет особые св-ва их водных р-ров, в т. ч. способность к мицеллообразованию и солюбилизацию (резкое повышение р-римости неполярных в-в типа масел в мицеллярных р-рах). Взаимод. между неполярными группами, входящими в состав полимерных молекул, оказывает решающее влияние на их конформационное состояние в воде. В частности, устойчивость нативной конформации белковых молекул обусловлена определенной последовательностью расположения гидрофобных аминокислотных остатков в полипептидной цепочке. Гидрофобное взаимодействие обеспечивает специфич. взаимод. ферментов с субстратами, самосборку и разл. аспекты функционирования биомембран и др. надмолекулярных структур. Гидрофобное взаимодействие-движущая сила адсорбции ПАВ из водных р-ров на границе с воздухом и неполярными жидкими и твердыми фазами («маслами», гидрофобными минералами типа угля, серы, полимерами типа полиэтилена, полистирола, фторопластов и др.). С гидрофобным взаимодействием связана неустойчивость водных пленок между неполярными фазами, коагуляция и структурообразование в водных дисперсиях гидрофобных частиц (суспензиях, латексах, флотационных пульпах и др.).
Экспериментальные исследования гидрофобного взаимодействия основываются на изучении р-римости инертных газов, углеводородов и др. неполярных в-в в воде, разнообразных термодинамич. и кинетич. св-в водных р-ров орг. соед., сил взаимод. между макроскопич. неполярными пов-стями. Они тесно связаны с изучением структуры воды с применением разл. спектроскопич. методик (оптич. спектроскопии, диэлькометрии, ЯМР, рассеяния нейтронов и др.).
В теоретич. аспекте гидрофобное взаимодействие рассматривают в рамках общей проблемы влияния среды на меж молекулярные взаимодействия. Внедрение неполярной молекулы в воду невозможно без нарушения образуемой молекулами воды пространственной сетки прочных водородных связей. Для такого внедрения требуется значит. затрата работы, т.е. повышается своб. энергия системы (изохорно-изотермич. потенциал, или энергия Гельмгольца). В результате неполярные молекулы в воде начинают притягиваться, поскольку при их сближении термодинамически невыгодный контакт с водой в той или иной степени устраняется и своб. энергия системы понижается. Вызываемые присутствием неполярной молекулы искажения в структуре воды могут передаваться на значит. расстояния по цепочкам водородных связей и обусловливать дальнодействие сил гидрофобного взаимодействия. Эти искажения носят упорядоченный характер и сопровождаются уменьшением энтропии системы; энтропийная природа гидрофобного взаимодействия и проявляется в его усилении при повышении т-ры.
Поскольку эффективный потенциал взаимод. молекул в жидкой среде (т. наз. потенциал средней силы) представляет собой суммарный результат взаимод. большого числа молекул, точное определение его параметров является сложной теоретич. задачей, решаемой в рамках разл. моделей жидкого состояния (см. Жидкость). Энергия гидрофобного взаимодействия неполярных молекул в воде, отвечающая глубине потенциальной ямы, т.е. эффективная энергия межмол. связи, может превосходить энергию дисперсионного взаимодействия этих же молекул в отсутствие среды (в вакууме). В отличие от потенциала взаимод. молекул в отсутствие среды потенциал гидрофобного взаимодействия имеет осциллирующий характер (наблюдается чередование минимумов и максимумов с периодом порядка диаметра молекул среды).
===
Исп. литература для статьи «ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ» : Пчелин В. А., Гидрофобные взаимодействия в дисперсных системах, М., 1976; Коагуляционные контакты в дисперсных системах, М., 1982. В. В. Я минский.
Страница «ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ» подготовлена по материалам химической энциклопедии.
главная > справочник > химическая энциклопедия:
Гидрофобное взаимодействие
Экспериментальные исследования гидрофобного взаимодействия основываются на изучении растворимости инертных газов. углеводородов и др. неполярных веществ в воде, разнообразных термодинамич. и кинетич. свойств водных растворов орг. соед., сил взаимод. между макроскопич. неполярными пов-стями. Они тесно связаны с изучением структуры воды с применением разл. спектроскопич. методик (оптич. спектроскопии. диэлькометрии, ЯМР, рассеяния нейтронов и др.).
В теоретич. аспекте гидрофобное взаимодействие рассматривают в рамках общей проблемы влияния среды на меж молекулярные взаимодействия. Внедрение неполярной молекулы в воду невозможно без нарушения образуемой молекулами воды пространственной сетки прочных водородных связей. Для такого внедрения требуется значит. затрата работы, т.е. повышается своб. энергия системы (изохорно-изотермич. потенциал, или энергия Гельмгольца). В результате неполярные молекулы в воде начинают притягиваться, поскольку при их сближении термодинамически невыгодный контакт с водой в той или иной степени устраняется и своб. энергия системы понижается. Вызываемые присутствием неполярной молекулы искажения в структуре воды могут передаваться на значит. расстояния по цепочкам водородных связей и обусловливать дальнодействие сил гидрофобного взаимодействия. Эти искажения носят упорядоченный характер и сопровождаются уменьшением энтропии системы; энтропийная природа >гидрофобного взаимодействия и проявляется в его усилении при повышении температуры.
Поскольку эффективный потенциал взаимод. молекул в жидкой среде (т. наз. потенциал средней силы) представляет собой суммарный результат взаимод. большого числа молекул, точное определение его параметров является сложной теоретич. задачей, решаемой в рамках разл. моделей жидкого состояния (см. Жидкость). Энергия гидрофобного взаимодействия неполярных молекул в воде, отвечающая глубине потенциальной ямы, т.е. эффективная энергия межмол. связи, может превосходить энергию дисперсионного взаимодействия этих же молекул в отсутствие среды (в вакууме). В отличие от потенциала взаимод. молекул в отсутствие среды потенциал гидрофобного взаимодействия имеет осциллирующий характер (наблюдается чередование минимумов и максимумов с периодом порядка диаметра молекул среды).
Взаимод. между неполярными частицами, аналогичные по своей гидрофобным взаимодействиям, имеют место не только в воде, но и в др. жидкостях с высокой когезионной энергией (высоким поверхностным натяжением), например в формамиде и глицерине. Это позволяет говорить о более общем явлении – лиофобном взаимодействии. Лиофобное взаимод. в принципе может осуществляться и между полярными веществами. Так, адгезия гидрофильных стеклянных частиц усиливается при погружении в ртуть и сопровождается образованием вакуумной полости в контакте между частицами вследствие несмачивания гидрофильных поверхностей ртутью.
Лит.: Пчелин В. А., Гидрофобные взаимодействия в дисперсных системах, М., 1976; Коагуляционные контакты в дисперсных системах, М., 1982. © В.В. Яминский.
ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ
(от греч. hydor-вода и phobos-боязнь, страх), сильное притяжение в воде между неполярными частицами (молекулами, остатками сложных молекул, частицами дисперсной фазы и т. п.). Причина Г. в.-большая энергия водородной связи между молекулами воды, превосходящая энергию их взаимод. с неполярными частицами. Термодинамич. невыгодность контакта воды с неполярными в-вами (рассматриваемая как гидрофобность) и предопределяет сильное притяжение их молекул друг к другу.
Г. в. между неполярными атомными группами (углеводородными, галогенуглеродными и т. п.), входящими в состав большинства орг. молекул, определяет особые св-ва их водных р-ров, в т. ч. способность к мицеллообразованию и солюбилизацию (резкое повышение р-римости неполярных в-в типа масел в мицеллярных р-рах). Взаимод. между неполярными группами, входящими в состав полимерных молекул, оказывает решающее влияние на их конформационное состояние в воде. В частности, устойчивость нативной конформации белковых молекул обусловлена определенной последовательностью расположения гидрофобных аминокислотных остатков в полипептидной цепочке. Г. в. обеспечивает специфич. взаимод. ферментов с субстратами, самосборку и разл. аспекты функционирования биомембран и др. надмолекулярных структур. Г. в.-движущая сила адсорбции ПАВ из водных р-ров на границе с воздухом и неполярными жидкими и твердыми фазами («маслами», гидрофобными минералами типа угля, серы, полимерами типа полиэтилена, полистирола, фторопластов и др.). С Г. в. связана неустойчивость водных пленок между неполярными фазами, коагуляция и структурообразование в водных дисперсиях гидрофобных частиц (суспензиях, латексах, флотационных пульпах и др.).
Экспериментальные исследования Г. в. основываются на изучении р-римости инертных газов, углеводородов и др. неполярных в-в в воде, разнообразных термодинамич. и кинетич. св-в водных р-ров орг. соед., сил взаимод. между макроскопич. неполярными пов-стями. Они тесно связаны с изучением структуры воды с применением разл. спектроскопич. методик (оптич. спектроскопии, диэлькометрии, ЯМР, рассеяния нейтронов и др.).
В теоретич. аспекте Г. в. рассматривают в рамках общей проблемы влияния среды на меж молекулярные взаимодействия. Внедрение неполярной молекулы в воду невозможно без нарушения образуемой молекулами воды пространственной сетки прочных водородных связей. Для такого внедрения требуется значит. затрата работы, т. е. повышается своб. энергия системы (изохорно-изотермич. потенциал, или энергия Гельмгольца). В результате неполярные молекулы в воде начинают притягиваться, поскольку при их сближении термодинамически невыгодный контакт с водой в той или иной степени устраняется и своб. энергия системы понижается. Вызываемые присутствием неполярной молекулы искажения в структуре воды могут передаваться на значит. расстояния по цепочкам водородных связей и обусловливать дальнодействие сил Г. в. Эти искажения носят упорядоченный характер и сопровождаются уменьшением энтропии системы; энтропийная природа Г. в. и проявляется в его усилении при повышении т-ры.
Поскольку эффективный потенциал взаимод. молекул в жидкой среде (т. наз. потенциал средней силы) представляет собой суммарный результат взаимод. большого числа молекул, точное определение его параметров является сложной теоретич. задачей, решаемой в рамках разл. моделей жидкого состояния (см. Жидкость). Энергия Г. в. неполярных молекул в воде, отвечающая глубине потенциальной ямы, т. е. эффективная энергия межмол. связи, может превосходить энергию дисперсионного взаимодействия этих же молекул в отсутствие среды (в вакууме). В отличие от потенциала взаимод. молекул в отсутствие среды потенциал Г. в. имеет осциллирующий характер (наблюдается чередование минимумов и максимумов с периодом порядка диаметра молекул среды).
Лит.: Пчелин В. А., Гидрофобные взаимодействия в дисперсных системах, М., 1976; Коагуляционные контакты в дисперсных системах, М., 1982. В. В. Я минский.
Полезное
Смотреть что такое «ГИДРОФОБНОЕ ВЗАИМОДЕЙСТВИЕ» в других словарях:
гидрофобное взаимодействие — Термин гидрофобное взаимодействие Термин на английском hydrofobic effect Синонимы гидрофобный эффект Аббревиатуры Связанные термины белки, биологическая мембрана, бислой, критическая концентрация мицеллообразования, критическая температура… … Энциклопедический словарь нанотехнологий
гидрофобное взаимодействие — hidrofobinė sąveika statusas T sritis chemija apibrėžtis Vandenyje pasireiškianti trauka tarp nepolinių mikrodalelių. atitikmenys: angl. hydrophobic interaction rus. гидрофобное взаимодействие … Chemijos terminų aiškinamasis žodynas
межплоскостное взаимодействие оснований — стэкинг взаимодействие Гидрофобное взаимодействие, обеспечивающее поддержание вторичной структуры двухцепочечной молекулы ДНК. [Арефьев В.А., Лисовенко Л.А. Англо русский толковый словарь генетических терминов 1995 407с.] Тематики генетика… … Справочник технического переводчика
стэкинг-взаимодействие — base stacking межплоскостное взаимодействие оснований, стэкинг взаимодействие. Гидрофобное взаимодействие, обеспечивающее поддержание вторичной структуры двухцепочечной молекулы ДНК. (Источник: «Англо русский толковый словарь генетических… … Молекулярная биология и генетика. Толковый словарь.
Межплоскостное взаимодействие оснований стэкинг-в — Межплоскостное взаимодействие оснований, стэкинг в. * міжплоскаснае ўзаемадзянне асноў, стэкінг узаемадзеянне * base stacking гидрофобное взаимодействие, обеспечивающее поддержание вторичной структуры двухцепочечной молекулы ДНК … Генетика. Энциклопедический словарь
супрамолекулярная химия — Термин супрамолекулярная химия Термин на английском supramolecular chemistry Синонимы Аббревиатуры Связанные термины биомиметика, ван дер ваальсово взаимодействие, водородная связь, гидрофобное взаимодействие, донорно акцепторное взаимодействие,… … Энциклопедический словарь нанотехнологий
мицелла — Термин мицелла Термин на английском micelle Синонимы Аббревиатуры Связанные термины амфифильный, амфотерный сурфактант, биологические нанообъекты, гидрофобное взаимодействие, коллоидная химия, коллоидный раствор, критическая концентрация… … Энциклопедический словарь нанотехнологий
Наука — ПодразделыОбъекты, относящиеся к сфере нанотехнологийИскусственные (синтетические) низкоразмерные объектыНаноструктурыНаноматериалыПолучение, диагностика и сертификация наноразмерных системМетоды нанесения элементов наноструктур и… … Энциклопедический словарь нанотехнологий
Мембра́ны биологи́ческие — (лат. membrana оболочка, перепонка) функционально активные поверхностные структуры толщиной в несколько молекулярных слоев, ограничивающие цитоплазму и большинство органелл клетки, а также образующие единую внутриклеточную систему канальцев,… … Медицинская энциклопедия
молекулярное распознавание — Термин молекулярное распознавание Термин на английском molecular recognition Синонимы Аббревиатуры Связанные термины доставка генов, активный центр катализатора, антитело, белки, биомедицинские микроэлектромеханические системы, биосенсор,… … Энциклопедический словарь нанотехнологий
Гидрофобные взаимодействия



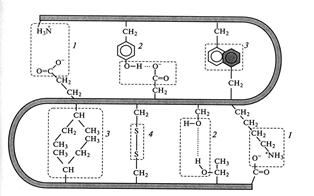
Прежде, чем рассматривать природу гидрофобного взаимодействия, необходимо ввести понятие «гидрофильных» и «гидрофобных» функциональных групп.
Группы, которые могут образовывать водородные связи с молекулами воды, называются гидрофильными.
К этим группам относятся полярные группы: аминогруппа (-NH2), карбоксильная(-COOH), карбонильная группы(-CHO) и сульфгидрильная группа (-SH).
Как правило, гидрофильные соединения хорошо растворимы в воде. . Это обусловлено тем, что полярные группы способны образовывать водородные связи с молекулами воды.
Появление таких связей сопровождается выделением энергии, поэтому и возникает тенденция к максимальному увеличению поверхности контакта заряженных групп и воды (Рис. 2.3):
Рис. 2.3. Механизм образования гидрофобных и гидрофильных взаимодействий
Молекулы или части молекул, неспособные образовывать водородные связи с водой называются гидрофобными группами.
К этим группам относятся алкильные и ароматические радикалы, которые неполярны и не несут электрического заряда.
Гидрофобные группы – плохо или вовсе не растворимы в воде.
Это объясняется тем, что атомы и группы атомов, входящие в состав гидрофобных групп, являются электронейтральнымии (поэтому) не могут образовывать водородных связей с водой.
. Гидрофобные взаимодействия возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды.
В результате этого молекулы воды вытесняются на поверхность гидрофильных молекул (Рис. 2.3).
2.1.5. Ван-дер-ваальсовы взаимодействия.
В молекулах существуют также весьма слабые и короткодействующие силы притяжения между электрически нейтральными атомами и функциональными группами.
Это так называемые ван-дер-ваальсовые взаимодействия.
Они обусловлены электростатическим взаимодействием между отрицательно заряженными электронами одного атома и положительно заряженным ядром другого атома.
Так как ядра атомов экранированы окружающими их собственными электронами от ядер соседних атомов, то возникающие между различными атомами ван-дер-ваальсовы взаимодействия весьма невелики.
Все эти типы взаимодействий принимают участие в формировании, поддержании и стабилизации пространственной структуры (конформации) белковых молекул (Рис. 2.4):
Силы, которые способствуют формированию пространственной структуры белков и удерживающие её в стабильном состоянии, являются очень слабыми силами. Энергия этих сил на 2-3 порядка меньше энергии ковалентных связей. Они действуют между отдельными атомами и группами атомов.
Однако, огромное число атомов в молекулах биополимеров (белков), приводит к тому, что суммарная энергия этих слабых взаимодействий становится сравнима с энергией ковалентных связей.
Белки
В предыдущей лекции мы с вами говорили о том, что аминокислоты, соединяясь друг с другом посредством пептидных связей, образуют полипетиды.
. Белками являются полипетиды, способные образовывать и самостоятельно стабилизировать свою пространственную структуру.
Эта способность приобретается благодаря наличию большого числа слабых нековалентных взаимодействий и связана с числом аминокислотных остатков, образующих полипептидную цепочку.
Как правило, белками называют полипетиды, содержащие более 50 аминокислотных остатков.
Вместе с тем длина полипептидной цепи может достигать до нескольких тысяч остатков аминокислот; молекулярная масса белков колеблется от 6000 до 1 миллиона и более килодальтон.
Гидрофобные взаимодействия в том, что они есть, биологическое значение и примеры
Гидрофобные взаимодействия (HI) это силы, которые поддерживают когезию между неполярными соединениями, погруженными в раствор или полярный растворитель. В отличие от других взаимодействий нековалентного характера, таких как водородные связи, ионные взаимодействия или силы Ван-дер-Ваальса, гидрофобные взаимодействия зависят не от внутренних свойств растворенных веществ, а скорее от растворителей..
Очень иллюстративным примером этих взаимодействий может быть разделение фаз, которое происходит при попытке смешать воду с маслом. В этом случае молекулы масла «взаимодействуют» друг с другом в результате упорядочения молекул воды вокруг них..
Понятие этих взаимодействий существует еще до сороковых годов. Однако термин «гидрофобная связь» был придуман Каузманом в 1959 году при изучении наиболее важных факторов стабилизации трехмерной структуры некоторых белков..
HIs являются наиболее важными неспецифическими взаимодействиями, происходящими в биологических системах. Они также играют важную роль в широком спектре инженерных применений и химической и фармацевтической промышленности, которые мы знаем сегодня.
Каковы гидрофобные взаимодействия??
Физическая причина HI основана на неспособности аполярных веществ образовывать водородные связи с молекулами воды в растворе..
Они известны как «неспецифические взаимодействия», так как они связаны не со сродством между растворенными молекулами, а скорее с тенденцией молекул воды поддерживать свои собственные взаимодействия через водородные связи..
При контакте с водой неполярные или гидрофобные молекулы имеют тенденцию самопроизвольно агрегировать, чтобы достичь наибольшей стабильности за счет уменьшения площади контакта с водой..
Этот эффект можно спутать с сильным притяжением, но это лишь следствие неполярного характера веществ по отношению к растворителю..
Объясненные с термодинамической точки зрения, эти спонтанные ассоциации возникают в поисках энергетически благоприятного состояния, где существует наименьшее изменение свободной энергии (ΔG).
Когда неполярные молекулы связаны друг с другом под воздействием молекул воды, получается более благоприятное состояние, чем если бы эти молекулы оставались отдельными, каждая из которых окружена «клеткой» из разных молекул воды..
Биологическое значение
HI имеют большое значение, так как они происходят в различных биохимических процессах.
В количественном отношении разные авторы получили задачу определить важность HI в стабильности структуры больших количеств белков, заключив, что эти взаимодействия вносят более 50%..
Многие мембранные белки (интегральные и периферические) связаны с липидными бислоями благодаря HI, когда в своих структурах указанные белки обладают доменами гидрофобного характера. Кроме того, стабильность третичной структуры многих растворимых белков зависит от HI.
Некоторые методы в исследовании клеточной биологии используют свойство, которым обладают некоторые ионные детергенты, для образования мицелл, которые представляют собой «полусферические» структуры амфифильных соединений, чьи аполярные области связаны друг с другом благодаря HI.
Мицеллы также используются в фармацевтических исследованиях, которые включают доставку жирорастворимых лекарств, и их образование также необходимо для поглощения сложных витаминов и липидов в организме человека..
Примеры гидрофобных взаимодействий
мембраны
Отличным примером HI является образование клеточных мембран. Такие структуры состоят из бислоя фосфолипидов. Его организация обеспечивается благодаря HI, которые возникают между аполярными хвостами в «отталкивании» от окружающей водной среды.
белок
HI оказывают большое влияние на фолдинг глобулярных белков, биологически активная форма которых получается после установления определенной пространственной конфигурации, обусловленной наличием определенных аминокислотных остатков в структуре.
Апомиоглобин (миоглобин, лишенный гемовой группы) представляет собой небольшой альфа-спиральный белок, который послужил моделью для изучения процесса складывания и важности HI среди аполярных остатков в полипептидной цепи того же самого.
В исследовании, проведенном Dyson и соавторами в 2006 году, где использовались мутированные последовательности апомиоглобина, было продемонстрировано, что инициация событий сворачивания этого зависит, прежде всего, от HI между аминокислотами с аполярными группами альфа-спиралей..
Таким образом, небольшие изменения, вносимые в аминокислотную последовательность, означают важные изменения в третичной структуре, что приводит к образованию деформированных и неактивных белков..
моющие средства
Другим ярким примером HI является способ действия коммерческих моющих средств, которые мы используем для бытовых целей каждый день..
При контакте с жирами в водном растворе молекулы моющего средства связываются друг с другом таким образом, что аполярные хвосты сталкиваются друг с другом, заключая в себе молекулы липидов и выставляя полярные области, которые входят в поверхность мицеллы, на поверхность мицеллы. контакт с водой.