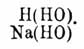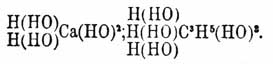Что такое гидраты химия
ГИДРАТЫ
Полезное
Смотреть что такое «ГИДРАТЫ» в других словарях:
ГИДРАТЫ — в химии тела, содерж. в своем составе воду. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГИДРАТЫ соединения простых или сложных химических тел с водою. Полный словарь иностранных слов, вошедших в употребление в… … Словарь иностранных слов русского языка
Гидраты — углеводородных газов (a. hydrates of hydrocarbon gases; н. Hydrate von Kohlenwasserstoffgassen; ф. hydrates des gar hydrocarbones, hydrates des gaz d hydrocarbure; и. hidratos de hidrocarburos gaseosos) соединения включения (клатраты), в… … Геологическая энциклопедия
Гидраты — ГИДРАТЫ, продукты присоединения воды к молекулам, атомам или ионам. Могут быть газообразными, жидкими и твердыми (кристаллогидраты). Широко распространены в природе: многие минералы гидраты, значительная часть природного горючего газа существует… … Иллюстрированный энциклопедический словарь
гидраты — Соединения включения (клатраты), в которых молекулы углеводородных газов заполняют пустоты кристаллической решетки льда. Примечание В естественных условиях встречаются в виде газогидратных залежей в многолетнемерзлых породах; образуются также в… … Справочник технического переводчика
ГИДРАТЫ — твёрдые или жидкие вещества, образующиеся при (см.) простых веществ, а также солей, кислот, оснований и органических соединений … Большая политехническая энциклопедия
Гидраты — Для улучшения этой статьи желательно?: Викифицировать статью. Добавить иллюстрации. Гидраты продукты присоединения … Википедия
Гидраты — суть определенные химические соединения, содержащие в своем составе элементы воды. Между ними различают гидраты в собственном смысле, соединения с кристаллизационной водой и некоторые растворы, обладающие свойствами определенных химических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Гидраты — продукты присоединения воды к неорганическим и органическим веществам. Термин «Г.» употребляется главным образом по отношению к соединениям, содержащим кристаллизационную воду (кристаллогидратам (См. Кристаллогидраты)); он сохранился… … Большая советская энциклопедия
гидраты — мн. Химические соединения, образующиеся в результате гидратации. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ГИДРАТЫ — продукты присоединения воды ( гидратации )к молекулам, атомам или ионам. М. б. газообразными, жидкими и твердыми; последние наз. кристаллогидратами. В р ре многозарядные ионы (А13+, Сг 3+, Be2+ и др.) и небольшие однозарядные (Li+) достаточно… … Химическая энциклопедия
Гидраты
Полезное
Смотреть что такое «Гидраты» в других словарях:
ГИДРАТЫ — в химии тела, содерж. в своем составе воду. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГИДРАТЫ соединения простых или сложных химических тел с водою. Полный словарь иностранных слов, вошедших в употребление в… … Словарь иностранных слов русского языка
Гидраты — углеводородных газов (a. hydrates of hydrocarbon gases; н. Hydrate von Kohlenwasserstoffgassen; ф. hydrates des gar hydrocarbones, hydrates des gaz d hydrocarbure; и. hidratos de hidrocarburos gaseosos) соединения включения (клатраты), в… … Геологическая энциклопедия
ГИДРАТЫ — (oTrpe4.hydor вода), соединения, образовавшиеся путем присоединения молекул воды к молекулам того или иного хим. вещества. К такому присоединению способны даже вещества, вообще в хим. отношении насыщенные. Напр.: а) при реагировании с водой… … Большая медицинская энциклопедия
Гидраты — ГИДРАТЫ, продукты присоединения воды к молекулам, атомам или ионам. Могут быть газообразными, жидкими и твердыми (кристаллогидраты). Широко распространены в природе: многие минералы гидраты, значительная часть природного горючего газа существует… … Иллюстрированный энциклопедический словарь
гидраты — Соединения включения (клатраты), в которых молекулы углеводородных газов заполняют пустоты кристаллической решетки льда. Примечание В естественных условиях встречаются в виде газогидратных залежей в многолетнемерзлых породах; образуются также в… … Справочник технического переводчика
ГИДРАТЫ — твёрдые или жидкие вещества, образующиеся при (см.) простых веществ, а также солей, кислот, оснований и органических соединений … Большая политехническая энциклопедия
Гидраты — Для улучшения этой статьи желательно?: Викифицировать статью. Добавить иллюстрации. Гидраты продукты присоединения … Википедия
Гидраты — продукты присоединения воды к неорганическим и органическим веществам. Термин «Г.» употребляется главным образом по отношению к соединениям, содержащим кристаллизационную воду (кристаллогидратам (См. Кристаллогидраты)); он сохранился… … Большая советская энциклопедия
гидраты — мн. Химические соединения, образующиеся в результате гидратации. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ГИДРАТЫ — продукты присоединения воды ( гидратации )к молекулам, атомам или ионам. М. б. газообразными, жидкими и твердыми; последние наз. кристаллогидратами. В р ре многозарядные ионы (А13+, Сг 3+, Be2+ и др.) и небольшие однозарядные (Li+) достаточно… … Химическая энциклопедия
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ. Гидратация (греч. «хюдор» – вода) – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называются гидратами. Гидролиз (греч. «лисис» – разложение, растворение) – химическая реакция разложения вещества водой.
В течение многих лет химики считали растворение веществ в воде чисто физическим процессом. И сейчас в школьных учебниках к таковым относят, например, растворение в воде сахара. Действительно, при испарении воды из раствора сахара при пониженном давлении легко получить исходное вещество в неизменном виде.
В то же время накапливались данные о том, что процесс растворения нельзя считать чисто механическим смешением компонентов, как, например, гексана и гептана. Так, растворы хлорида натрия и многих других соединений обладают электропроводностью, а сам процесс растворения нередко сопровождается значительными тепловыми эффектами (см. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ). Более того, некоторые соединения при растворении изменяют даже цвет. Например, сульфат меди бесцветный, а его разбавленный раствор – голубой, хлорид кобальта(II) голубой, а его водные растворы розовые. Все эти факты показывают, что растворение в воде – физико-химический процесс, вызванный гидратацией, то есть взаимодействием вещества с водой.
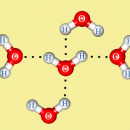
В ходе гидратации в ряде случаев происходит обратимое присоединение воды к ионам, атомам или молекулам растворяемого вещества с образованием гидратов. Так, при растворении в воде кристаллических ионных соединений (солей, щелочей, а также некоторых кислот, например, лимонной и щавелевой), молекулярных соединений (хлороводорода, серной кислоты, спирта, глюкозы и др.) происходит гидратация катионов и анионов, из которых состоит растворяемое вещество, либо гидратация ионов, образующихся в процессе растворения. При этом молекулы воды сохраняются как целое.
| Ион | Энергия гидратации, кДж/моль | Ион | Энергия гидратации, кДж/моль |
| H + | 1076 | Sr 2+ | 1477 |
| H3O + | 460 | Ba 2+ | 1339 |
| Li + | 502 | Zn 2+ | 2130 |
| Na + | 410 | Al 3+ | 4548 |
| K + | 329 | F – | 473 |
| NH4 + | 330 | Cl – | 330 |
| Rb + | 314 | Br – | 296 |
| Cs + | 264 | I – | 264 |
| Mg 2+ | 1887 | OH – | 339 |
| Ca 2+ | 1569 | MnO4 – | 247 |
Алгебраическая сумма энергии кристаллической решетки (или энергии разрыва связей) растворяемого вещества и энергии гидратации ионов определяет суммарный тепловой эффект растворения. В случае ионных соединений процесс может быть существенно экзотермическим (растворение в воде серной кислоты, гидроксидов натрия и калия может вызвать даже вскипание раствора), существенно эндотермическим (стакан с водой, в котором быстро растворяют нитрат аммония, примерзает к влажной подставке) или термонейтральным (растворение бромида натрия практически не сопровождается изменением температуры).
При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической решетки с образованием кристаллогидратов различного состава, например, LiCl·H2O, CuCl2·2H2O, Ba(ClO4)2·3H2O, CdBr2·4H2O, Na2S2O3·5H2O, AlCl3·6H2O, FeSO4·7H2O, MgI2·8H2O, Fe(NO3)3·9H2O, Na2SO4·10H2O, Na2HPO4·12H2O, Al2(SO4)3·18H2O и др. При нагревании, а также при хранении на воздухе (особенно при низкой влажности) многие кристаллогидраты выветриваются, теряя частично или полностью молекулы воды.
Гидратация молекулярных соединений происходит обычно за счет водородных связей и, как правило, не сопровождается существенным тепловым эффектом. Примером может служить растворение сахара. Молекулы воды легко образуют водородные связи с гидроксильными группами, поэтому даже вещества с большими молекулами хорошо растворяются в воде, если содержат много гидроксильных групп (сахароза, поливиниловый спирт). Соединения с небольшими полярными молекулами также легко гидратируются полярными молекулами воды, поэтому такие соединения обычно хорошо растворяются в воде. Примером может служить ацетонитрил СН3CN, который смешивается с водой в любых отношениях.
Необычные гидраты с некоторыми соединениями образует вода, находящаяся в твердом состоянии. В этих гидратах атомы, молекулы ряда веществ включаются в пустоты кристаллической решетки льда. Эти пустоты могут заполняться небольшими молекулами, такими как О2, N2, H2S, СН4, атомами благородных газов. Такие соединения «без химической связи» называют газовыми гидратами. Другие их название – клатраты (соединения включения). Отсутствие химических связей приводит к самым необычным соотношениям молекул воды и включенного вещества. Например, при низких температурах устойчивы соединения, содержащие на 46 молекул Н2О восемь атомов аргона, криптона, ксенона или радона. А вот маленькие атомы гелия и неона таких клатратов не образуют, так как они «ускользают» из слишком больших для них пустот. Клатрат состава Сl2·8H2O получил еще Дэви в 1811 из насыщенного при 0° С водного раствора хлора.
Клатраты, образованные водой и метаном, а также другими газами, часто называют газовыми гидратами. Внешне они похожи на снег или рыхлый лет, но под давлением могут существовать и при плюсовых температурах. Поэтому газовые гидраты могут закупорить газопровод и привести к аварии. Гидраты метана широко распространены в природе, в особенности на шельфе океанов; запасы природного газа в виде газовых гидратов значительно превышают его запасы в свободном состоянии.
Гидратация как химическое взаимодействие с водой может сопровождаться разрушением молекул воды, в этом случае происходит необратимая химическая реакция, которую обычно называют гидролизом – разложением водой. Реакции гидролиза известны как в неорганической, так и в органической химии. Примерами гидролиза неорганических соединений могут служить следующие процессы:
Гидролиз солей, образованных сильным основанием (щелочью) и слабой кислотой или слабым основанием и сильной кислотой сопровождается изменением кислотности среды: Na2S + H2O ® NaHS + NaOH, AlCl3 + H2O ® Al(OH)Cl2 + HCl. В случае таких солей как Al2S3 (их можно получить только сухим путем) гидролиз идет до конца с выделением гидроксида металла и слабой кислоты.
В органической химии реакции гидролиза сопровождаются либо разрушением органической молекулы (гидролиз сложных эфиров, белков): CH3COOC2H5 + H2O ® CH3COOH + C2H2OH, либо заменой в молекуле какой-либо группы на остаток молекулы воды, обычно гидроксил (гидролиз алкилгалогенидов): C2H5Br + H2O ® C2H5OH + HBr. В обоих случаях гидролизу способствует присутствие щелочи, которая связывает выделяющуюся кислоту. В случае белков и других биологически активных молекул реакцию гидролиза направляют в нужном направлении специальные ферменты – гидролазы. Например, фермент амилаза способствует гидролизу крахмала; фермент трипсин направленно гидролизует в белках пептидные связи, образованные аминокислотами аргинином и лизином.
Примерами реакции гидратации в органической химии может служить каталитическая гидратация алкенов с образованием спиртов:
Реакции гидратации широко используются в промышленном органическом синтезе. Например, каталитической гидратацией из этилена получают этиловый спирт, из пропилена – пропиловый спирт, из ацетилена – уксусный альдегид, из метилацетилена – ацетон. Реакция гидратации с образованием гидратов является ключевой при формовании изделий из гипса, при «схватывании» цемента. Образование газовых гидратов используют для разделения многокомпонентных газовых смесей. Наличие запасов гидратов метана в недрах Земли перспективно для будущей добычи природного газа. Реакции гидролиза широко используются в лабораторной практике и в промышленности. Гидролизом целлюлозы получают называемый гидролизный этиловый спирт, гидролизом сахарозы – глюкозу и фруктозу, гидролизом жиров – глицерин и соли карбоновых кислот – мыла. Ферментативный гидролиз органических соединений широко применяется в пищевой, текстильной и фармацевтической промышленности.
Гидраты
Гидратации могут подвергаться как молекулы, так и отдельные ионы растворенного вещества. Главным доказательством правильности взглядов Джонса является наличие аномально большого понижения температуры замерзания концентрированных растворов, которое Джонс объяснил не увеличением числа частиц растворенного тела, что для больших концентраций невероятно, а уменьшением числа частиц свободного растворителя, после того как часть его связалась с ионами растворенного вещества, превратив их в гидрат. Аналогичные аномалии были замечены и для повышения температуры кипения концентрированных растворов. Другая группа доказательств основана на изучении спектров поглощения растворов окрашенных солей. При разбавлении полосы абсорбции суживаются, так как гидратация ионов увеличивается, инерция их растет, и световая энергия с большим трудом может привести их в колебания, обусловливающие поглощение света. Различие температурных коэффициентов электропроводности при разных концентрациях и для различных солей также является, по Джонсу, доказательством существования гидратов. С ростом температуры электропроводность растворов растет вследствие уменьшения вязкости среды, мешающей передвижению ионов. Если ионы гидратированы, к этому прибавляется еще и влияние происходящей при повышении температуры дегидратации ионов, уменьшающей их диаметр и увеличивающей их подвижность. Действительно, температурный коэффициент электропроводности больше в слабых растворах (где гидратация больше) и особенно для тех солей, для которых и другие методы дают указания о более высокой гидратации (SrCl2, АlСl3).
Степень гидратации каждого иона в отдельности, т. е. количество соединенных с ним молекул воды, определяется двумя методами. Первый из них основывается на том, что при передвижении ионов от одного электрода к другому с ними должна переноситься гидратная вода, что влечет за собой изменение концентрации какого-либо «нейтрального» вещества, находящегося в растворе у одного из электродов. Этот метод, впервые указанный Нернстом, не привел, однако, к количественным результатам, т. к. оказалось весьма трудным найти действительно нейтральное вещество, которое при передвижении ионов оставалось бы у одного из электродов и не увлекалось бы ими, как и гидратная вода.
Криогидраты нельзя считать гидратами в точном смысле этого слова, так как они представляют собою не соединение, а смесь льда с определенным гидратом, выпадающую при определенной температуре из раствора, который насыщен данным гидратом.
ГИДРАТЫ
продукты присоединения воды ( гидратации )к молекулам, атомам или ионам. М. б. газообразными, жидкими и твердыми; последние наз. кристаллогидратами.
Смотреть что такое ГИДРАТЫ в других словарях:
ГИДРАТЫ
суть определенные химические соединения, содержащие в своем составе элементы воды. Между ними различают гидраты в собственном смысле, соединения с крис. смотреть
ГИДРАТЫ
продукты присоединения воды к неорганическим и органическим веществам. Термин «Г.» употребляется главным образом по отношению к соединениям, со. смотреть
ГИДРАТЫ
ГИДРАТЫ, продукты присоединения воды к неорганич. и органич. веществам. Термин «Г.» употребляется гл. обр. по отношению к соединениям, содержащим кри. смотреть
ГИДРАТЫ
Гидраты — суть определенные химические соединения, содержащие в своем составе элементы воды. Между ними различают гидраты в собственном смысле, соединения с кристаллизационной водой и некоторые растворы, обладающие свойствами определенных химических соединений. К первым принадлежат такие соединения, в которых, на основании некоторых реакций их образования и их превращений, вода принимается содержащеюся в виде водных остатков ОН (гидроксил). Таковы кислоты, гидраты оснований, или водные окиси, и спирты, или алкоголи. Общей для всех их формулой будет R(ОН) n, где R есть элемент или сложная группа атомов, например, водная окись натрия, или едкий натр Na(HO), водная окись кальция, или едкая известь Са(НО) 2, кислоты азотная NO 2 (OH), серная SO 2(OH)2, борная R(OH) 3, уксусная C 2H3 O(OH), обыкновенный винный спирт C 2H5 (HO), глицерин С 3 Н 3 (ОН) 3 и т. п. Они могут рассматриваться, как вода, в которой произошло замещение одного атома водорода каким-нибудь R, например, натрием, что видно из сопоставления формул воды и едкого натра Сколько частиц воды принимало участие в замещении, столько и водных остатков находится в гидрате, например: Число же частиц воды определяется эквивалентностью R. Такое замещение может быть воспроизведено и в действительности. Так, натрий и др. щелочные, а также щелочноземельные металлы выделяют из воды газообразный водород и дают соответствующие Г. Из других реакций их образования на первом плане следует поставить действие воды на хлорангидриды или другие галоидангидриды, так как эта реакция с ясностью показывает справедливость принятого воззрения на Г., как гидроксильные соединения, ибо здесь один атом водорода воды соединяется с атомом хлора хлорангидрида, образуя хлористый водород НCl, а остаток воды ОН вступает на место хлора хлорангидрида, образуя гидрат. Так образуется, например, серная кислота при разложении водой хлористого сульфурила: SО 2Cl2 + 2Н 2O = SO2(OH)2 + 2НCl или уксусная кислота из хлористого ацетила: C2H3 OCl + Н 2 O = С 2H3 О(НО) + НCl. Основные Г. не образуются этой реакцией, вследствие прочности по отношению к воде отвечающих им хлористых соединений. Однако, присутствие и в них водных остатков можно видеть из обратной реакции, именно получения хлористых металлов при действии хлористого водорода на основные Г., при чем водород хлористого водорода соединяется с водным остатком гидрата, образуя воду, а хлор становится на его место в гидрате, например: Са(НО) 2 + 2НCl = СаСl 2 + 2Н(НО). Многие Г. образуются прямым соединением безводных тел (ангидридов) с водой, напр.: SO3 + Н 2 O = Н 2 SО 4; СаО + Н 2 O = Са(НО) 2. Далее, они могут получиться при реакциях двойного разложения солей с другими Г. (реакция, важная для получения Г. слабых кислотных и основных окислов, не способных прямо соединяться с водой), напр.: CuSO4 + 2Na(HO) = Сu(НО) 3 + Na2SO4; (NaO)2SiO3 + Н 2 SО 4 = (HO)2SiO + Na2SO4. В подобные же реакции могут вступать и сложные эфиры; таково, например, омыление их щелочами по уравнению: C2H3O2(C2H5) + NaHO = C2H3O(NaO) + C2H3(HO). Наконец, Г. можно получить путем образования в соединениях водных остатков при реакциях окисления и восстановления; так уксусный альдегид (вещество ангидридное, водных остатков не содержащее), присоединяя кислород, дает уксусную кислоту, а, соединяясь с водородом, образует спирт: C2H3 O. H + О = C 2H3O(HO); C2H4O + H2 = C2H5(OH). Одним нагреванием часто нельзя или трудно выделить из Г. воду, в них содержащуюся (известь, серная кислота), а иногда и вовсе нельзя даже при сильнейшем накаливании (едкий натр, метафосфорная кислота). В некоторых случаях легче достигается полное разложение гидрата, чем разложение его на воду и ангидрид (спирт, уксусная, азотная кислота). Но есть между Г. и легко теряющие воду и даже такие, которые едва способны к самостоятельному существованию. Теряя воду, многие гидраты, прежде образования ангидридов, могут переходить в ангидрогидраты, т. е. гидраты с меньшим количеством воды; так наиболее богатый водой гидрат фосфорной кислоты, ортофосфорная кислота РО(НО) 3, при нагревании до 300° образует пирофосфорную кислоту (РО) 2 (НО) 2 O, а эта последняя при прокаливании дает метафосфорную РО 2 (НО); подобным же образом для кремнезема (см.) и мн. др. существуют многочисленные ряды гидратов с постепенно убывающим содержанием воды. Будучи лишь в незначительной мере способны к реакциям прямого соединения, гидраты с легкостью, и это для них весьма характерно, вступают в реакции двойного разложения, причем их водные остатки или водород последних обмениваются на атомы галоидов, металлов и сложные атомные группы (остатки спиртов и кислот), образуя галоидангидриды, соли и сложные эфиры и выделяя воду или газообразный водород. Замещение водных остатков кислот и спиртов хлором и образование из них хлорангидридов происходит при действии РCl 5: C2H3O(OH) + PCl3 = C2H3OCl + POCl3 + HCl; водные основания обменивают ОН на Cl, как уже было указано выше, при действии соляной кислоты НCl, образуя хлористые металлы. Через замещение водных остатков оснований и спиртов остатками кислот при реакциях двойного разложения получаются соли и сложные эфиры: Na(HO) + H(NO3) = Na(NO3) + Н 2O; C2H5(HO) + H(C2H3O2) = C2H5(C2H3O2) + H2O. Кислоты и спирты обменивают водород своих водных остатков на металлы при взаимодействии с металлами или их окисями и гидратами, причем образуются соли или алкоголяты, напр.: H2SO2 + Zn = ZnSO4 + Н 2; HaSO4 + ZnO = ZnSO4 + Н 2O; H2SO2 + Zn(HO2) = ZnSO4 + 2H2O; C2H5(HO) + Na = C2H5 (NaO) (алкоголят натрия) + H 2. П. П. Рубцов Δ.
ГИДРАТЫ
углеводородных газов (a. hydrates of hydrocarbon gases; н. Hydrate von Kohlenwasserstoffgassen; ф. hydrates des gar hydrocarbones, hydrates d. смотреть
ГИДРАТЫ
ГИДРАТЫв химии тела, содерж. в своем составе воду.Словарь иностранных слов, вошедших в состав русского языка.- Павленков Ф.,1907.ГИДРАТЫсоединения прос. смотреть
ГИДРАТЫ
ГИДРАТЫ
1) Орфографическая запись слова: гидраты2) Ударение в слове: гидр`аты3) Деление слова на слоги (перенос слова): гидраты4) Фонетическая транскрипция сло. смотреть
ГИДРАТЫ
ГИДРАТЫ
ГИДРАТЫ
Ударение в слове: гидр`атыУдарение падает на букву: аБезударные гласные в слове: гидр`аты
ГИДРАТЫ
ГИДРАТЫ
продукты гидратации раз л. в-в. Вода в Г. присутствует в виде индивидуальных частиц и обычно может быть удалена при нагревании. Твёрдые Г. наз. кристал. смотреть