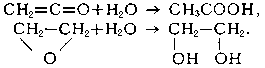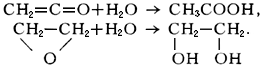Что такое гидратация в химии определение
ГИДРАТАЦИЯ
(от греч. hydor-вода), присоединение воды к молекулам, атомам или ионам. Может осуществляться без разрушения или с разрушением молекул воды. Г. без разрушения молекул воды приводит к гидратам. Обусловлена электростатич. и ван-дер-ваальсовым взаимодействиями, координационными и иногда водородными связями. Г. в растворе-частный случай сольватации.
Г. молекул в р-рах изучена недостаточно. Энтальпии Г. молекул, отсчитанные, как и для ионов, от их стандартных состояний в вакууме, содержат вклад, обусловленный влиянием молекул растворенного в-ва на водородные связи между молекулами воды, и обычно не превышают неск. десятков кДж/моль.
Г.-важный фактор, обусловливающий р-римость в-в в воде, электролитич. диссоциацию, распределение в-в между фазами в многокомпонентных системах, содержащих воду, кинетику и равновесие р-ций в водных р-рах, образование кристаллогидратов (см. также Растворы неэлектролитов, Растворы электролитов, Гидраты):
Г. с разрушением молекул воды широко распространена в неорг. и орг. химии. Г. оксидов элементов приводит в зависимости от их природы к образованию щелочей, к-т или амфотерных гидроксидов. Эта р-ция-основа мн. пром. процессов, напр. получения серной и азотной к-т, твердения вяжущих материалов (при этом происходит также образование кристаллогидратов). С .И. Дракин.
Щелочная Г. нитрилов до амидов осуществляется по нуклеоф. механизму. По этому же механизму гидратируются соед., содержащие электроноакцепторные заместители (хлораль, мезоксалевая к-та, гексафторацетон) и 

Г. непредельных углеводородов-важнейшая стадия во мн. процессах переработки нефтяного сырья, попутных и прир. газов. Г. используется в пром-сти для получения, напр., этанола из этилена, изопропанола из пропилена, ацетальдегида и ацетона из ацетилена, этиленгликоля из этиленоксида, уксусной к-ты и ее ангидрида из кетена. Г.-одна из стадий синтеза карбоновых к-т из олефинов. См. также Дегидратация.
Лит.: Креетов Г. А., Термодинамика ионных процессов в растворах, 2 изд., Л., 1984.
Гидратация
Полезное
Смотреть что такое «Гидратация» в других словарях:
Гидратация — иона натрия Гидратация (от др. греч. ὕδωρ вода) присоединение молекул воды к молекулам или … Википедия
Гидратация — 1. Процесс связывания частиц растворимого в воде вещества с молекулами воды. Г. является частным случаем сольватации присоединения к веществам какого либо растворителя. Г. электролитов в растворах является главной причиной их диссоциации на ионы … Геологическая энциклопедия
ГИДРАТАЦИЯ — Общее название, прилагаемое обыкновенно ко всем химическим реакциям, при котор. происходит присоединение воды. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. гидратация ((гр. hydor вода) присоединение воды к… … Словарь иностранных слов русского языка
ГИДРАТАЦИЯ — ГИДРАТАЦИЯ, хим. термин, обозначающий процесс присоединения воды к какому либо веществу. Сюда относятся: I. Выделение из водного раствора какого либо вещества кристаллов, содержащих на одну молекулу вещества разное колич. молекул воды.… … Большая медицинская энциклопедия
ГИДРАТАЦИЯ — присоединение воды к веществу. Может протекать с разрушением молекул воды, напр., при синтезе этанола гидратация этилена, или без их разрушения, напр., при образовании кристаллогидратов. Обусловливает растворимость веществ в воде,… … Большой Энциклопедический словарь
гидратация — сольватация Словарь русских синонимов. гидратация сущ., кол во синонимов: 5 • гипергидратация (1) • … Словарь синонимов
Гидратация — [гр. hydro – вода] – межмолекулярное взаимодействие веществ, обладающих избыточной свободной энергией, с водой, при котором молекулы воды не разрушаются, с образованием новых соединений – гидратов постоянного или переменного… … Энциклопедия терминов, определений и пояснений строительных материалов
ГИДРАТАЦИЯ — ГИДРАТАЦИЯ, присоединение воды ионом или веществом. Гидрат комплексное соединение, как, например, сульфат меди (II), которое содержит связанную воду, чьи молекулы слабо привязаны к каждому кристаллу (CuSO435H2O). ЭТАН может быть гидратирован для… … Научно-технический энциклопедический словарь
гидратация — Химическое присоединение воды к различным веществам [Терминологический словарь по строительству на 12 языках (ВНИИИС Госстроя СССР)] EN hydration DE Hydration FR hydratation … Справочник технического переводчика
гидратация — Вид механического выветривания горных пород, когда при наличии воды внутри минералов она расширяет поры и приводит к разрушению породы … Словарь по географии
ГИДРАТАЦИЯ — присоединение молекул воды к различным веществам; является частным случаем (см.). Г. широко применяют для получения кислот, спиртов, альдегидов, гашёной извести и др … Большая политехническая энциклопедия
Гидратация
Гидрат а ция (от греч. hydor — вода), процессы связывания воды химическими веществами. Различают несколько видов гидратации.
Гидратация окислов приводит к гидроокисям, представляющим собой щёлочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси кальция даёт гидроокись кальция (в технике этот процесс называется «гашение извести»):
При гидратации трёхокиси мышьяка образуется слабая мышьяковистая кислота, имеющая амфотерные свойства:
Гидратация органических соединений происходит по кратным связям; в случае циклических соединений гидратация приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая гидратация). Гидратация этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой гидратации олефинов получают спирты, например этиловый спирт из этилена:
В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между атомом водорода и группой OH.
Многие неорганические и некоторые органические вещества образуют с водой твёрдые кристаллогидраты, постоянного состава, которые ведут себя как индивидуальные химические соединения. Так, безводный сульфат меди CuSO4 бесцветен; из его водных растворов кристаллизуется ярко-синий гидрат CuSO4·5H2O — медный купорос, при нагревании которого образуется сначала голубой CuSO4·3H2O, затем CuSO4·H2O белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится гидратация молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами H2O. При растворении электролитов происходит гидратация ионов, затрудняющая ассоциацию последних. Энергия гидратации в значительной степени компенсирует энергию диссоциации электролита; т. о., гидратация ионов является одной из главных причин электролитической диссоциации в водных растворах. Образование кристаллогидратов и гидратация молекул и ионов в растворах являются частными случаями сольватации, т. е. присоединения молекул растворителя. К гидратации относят также процессы, приводящие к связыванию воды за счёт адсорбционных сил (см. Адсорбция). См. также Вода.
В биологических системах при гидратации происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при гидратации гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С гидратацией связаны многие биологические процессы. Так, гидратация ионов влияет на их проникновение в клетку, а гидратация белков изменяет некоторые их свойства — в частности ферментативную активность.
Процесс, обратный гидратации, т. е. потеря связанной веществами воды, называется дегидратацией. Гидратация и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах.
ГИДРАТАЦИЯ
(от греч. hydor-вода), присоединение воды к молекулам, атомам или ионам. Может осуществляться без разрушения или с разрушением молекул воды. Г. без разрушения молекул воды приводит к гидратам. Обусловлена электростатич. и ван-дер-ваальсовым взаимодействиями, координационными и иногда водородными связями. Г. в растворе-частный случай сольватации.
Г. молекул в р-рах изучена недостаточно. Энтальпии Г. молекул, отсчитанные, как и для ионов, от их стандартных состояний в вакууме, содержат вклад, обусловленный влиянием молекул растворенного в-ва на водородные связи между молекулами воды, и обычно не превышают неск. десятков кДж/моль.
Г.-важный фактор, обусловливающий р-римость в-в в воде, электролитич. диссоциацию, распределение в-в между фазами в многокомпонентных системах, содержащих воду, кинетику и равновесие р-ций в водных р-рах, образование кристаллогидратов (см. также Растворы неэлектролитов, Растворы электролитов, Гидраты):
Г.с разрушением молекул воды широко распространена в неорг. и орг. химии. Г. оксидов элементов приводит в зависимости от их природы к образованию щелочей, к-т или амфотерных гидроксидов. Эта р-ция-основа мн. пром. процессов, напр. получения серной и азотной к-т, твердения вяжущих материалов (при этом происходит также образование кристаллогидратов). С .И. Дракин.
Г. непредельных углеводородов-важнейшая стадия во мн. процессах переработки нефтяного сырья, попутных и прир. газов. Г. используется в пром-сти для получения, напр., этанола из этилена, изопропанола из пропилена, ацетальдегида и ацетона из ацетилена, этиленгликоля из этиленоксида, уксусной к-ты и ее ангидрида из кетена. Г.-одна из стадий синтеза карбоновых к-т из олефинов. См. также Дегидратация.
Лит.: Креетов Г. А., Термодинамика ионных процессов в растворах, 2 изд., Л., 1984.
Смотреть что такое ГИДРАТАЦИЯ в других словарях:
ГИДРАТАЦИЯ
общее название, прилагаемое обыкновенно ко всем тем хим. реакциям, при которых происходит присоединение воды. Реакции эти чрезвычайно многочисленны и р. смотреть
ГИДРАТАЦИЯ
(от греч. hydor — вода) процессы связывания воды химическими веществами. Различают несколько видов Г. Г. окислов приводит к гидроокисям. смотреть
ГИДРАТАЦИЯ
гидратация ж. Физико-химический процесс взаимодействия растворенных веществ с водой.
ГИДРАТАЦИЯ
ГИДРАТАЦИЯ
ГИДРАТАЦИЯ
Гидратация — общее название, прилагаемое обыкновенно ко всем тем химическим реакциям, при которых происходит присоединение воды. Реакции эти чрезвычайно многочисленны и разнообразны, совершаются повсюду в природе и беспрестанно применяются как в лабораторной практике, так и в различных производствах. При всем их разнообразии можно ясно различить три типа реакций Г.: 1) прямые реакции соединения с водой; 2) реакции соединения, совершающиеся при участии хим. деятелей, и 3) гидролиз или разложения (образование двух или более веществ из одного + вода), производимые водой через ее присоединение, большей частью также требующие воздействия третьего тела. Прямо соединяются с водой: кислотные и основные (щелочные и щелочноземельные) ангидриды, образуя соответствующие гидраты; безводные соли, а также многие из вышеупомянутых гидратов, образуя кристаллогидраты; простые эфиры многоатомных спиртов, образуя соответствующие спирты. Все эти реакции за немногими исключениями (напр. переход метафосфорной кислоты в ортофосфорную, Г. окиси этилена и некотор. др.) идут более или менее легко и быстро либо при простом соприкосновении с водой, либо при растворении в ней, и сопровождаются отделением тепла, часто весьма значительным [Некоторые случаи Г. ангидридов соединены с распадением сложной частицы на 2 простейшие, напр. уксусный анг., соединяясь с водой, распадается с образованием 2 частиц уксусной кислоты: Тем не менее, эта и др., подобные ей, реакции по всему своему характеру принадлежат к 1-ой группе реакций Г. точно так же, как образование хлористого водорода из хлора и водорода (Н 2 + Cl2 = 2НCl) есть реакция соединения. Реакции разложения водой хлорангидридов кислот, в сущности, представляют также реакции Г., сходные с Г. смешанных кислотных ангидридов.]. Вторая группа реакций Г. обнимает собой сравнительно немногие случаи присоединения воды к непредельным соединениям, как то: Г. этиленных углеводородов в одноатомные предельные спирты и непредельных одноатомных спиртов в гликоли при нагревании их с разведенными кислотами, присоединение воды к ацетилену, пропаргиловому спирту и т. п. в присутствии бромной ртути и Г. некоторых терпенов под влиянием кислот. Несравненно более разнообразны реакции гидролиза. Сюда относятся: омыление (см.) сложных эфиров водой и основаниями, при чем происходит распадение эфиров на спирт и кислоту C2H3 O.С 2H5 O (уксусноэтиловый эфир) + Н 2O = C2H4O2 (уксусн. эт. спирт) + C 2H6O; гидролиз при кипячении с разведенными кислотами или под влиянием неорганизованных ферментов (диастаза, растворимого фермента дрожжей и друг.), глюкозидов [напр.: С 13 Н 18 О 7 (салицин) + Н 2O = C6 Н 12O6 (глюкоза) + C7H8O2 (салигенин)] и углеводов (напр. превращение крахмала при действии диастаза солода в мальтозу: (C6H10O5)n + (Н 2O)n = nC6H12O6, и инверсия сахара (C12H22O11 (сахар) + H 2O = C6H12O6 (глюкоза) + C 6H12O6 (фруктоза); Г. нитрилов, илидов, амидов и аминовых кислот, распадающихся при действии водных минеральных кислот или оснований на кислоты и аммиак (напр. С 2O2(NH2)2 (оксамид) + 2Н 2O = C2H2O4 (щавел. к.) + 2NH 3 или CNOH (циановая кисл.) + Н 2 O = СО 2 (углек.) + NH 3; Г. с помощью кислот альдоксимов, кетоксимов и гидроксамовых кислот, гидразонов и озазонов, которые разлагаются при этом на альдегиды, кетоны, кислоты, глюкозы и оксиглюкозы, с одной стороны, и гидроксиламин и фенилгидразин, с другой, и, наконец, реакции Г. амидоксимов, изонитрилов, ортоэфиров, имидоэфиров, ангидримидокислот и амидинов и некотор. др. Более сложные относящиеся сюда случаи Г. представляют белковые вещества. Таковы процессы пептонизации белков (см. Пептоны) под влиянием, напр., неорганизованного фермента желудочного сока, пепсина, в присутствии слабой соляной кислоты и процессы гниения их [Здесь Г. соединена с окислением.] под влиянием жизнедеятельности особых бактерий, сопровождающиеся постепенным распадом белковых тел с образованием сперва пептонов, лейцина и тирозина и далее аммиака, сероводорода, угольной, серной и органических (жирных и ароматических) кислот, фенолов, индола, скатола и др. тел. Вода, щелочи и кислоты также способны при нагревании различным образом гидратировать белки, расщепляя их на тела отчасти такие же, отчасти подобные тем, которые происходят при гниении. Реакции Г. 2 и 3 группы протекают по большей части медленно, не обнаруживая значительных тепловых явлений. Что касается роли третьего вещества при них, то она может быть троякой. Гидратирующее вещество реагирует с одним из продуктов Г., вступая с ним в соединение, напр., щелочь с кислотой, образующейся при омылении эфиров, или минеральная кислота с аммиаком при распадении амидов. Гидратирующее вещество, само оставаясь в конце превращения неизмененным, тем не менее принимает непосредственное участие в реакции, как, напр., серная кислота при Г. этилена, выражающейся след. 2 уравнениями: CH2.CH2 + H(HSO4) = CH3.CH2(HSO4) и СН 3.СН 2 (НSО 4) + Н 2 O = СН 3.СН 2 (НО) + H(HSO 4). Наконец, оно может действовать контактом (см). Таково, по-видимому, действие диастаза и слабых кислот на глюкозиды и углеводы и пепсина на белки. П. П. Рубцов. Δ.
ГИДРАТАЦИЯ
— 1. Процесс связывания частиц растворимого в воде вещества с молекулами воды. Г. является частным случаем сольватации — присоединения к веществам какого-либо растворителя. Г. электролитов в растворах является главной причиной их диссоциации на ионы, обусловливает устойчивость ионов в растворах и препятствует обратному соединению ионов в молекулы. Реакции гидратации б. ч. обратимы; обратная реакция называется дегидратацией. Получаемые при этом соединения называются гидратами, а входящая в них вода — гидратной. Иногда гидратная вода так прочно связана с частицами растворенного вещества, что при выделении его из раствора входит в состав образующихся к-лов, называемых кристаллогидратами, а содержащаяся в них вода называется кристаллизационной. Особенно легко образуются кристаллогидраты разл. солей, причем на единицу разл. солей приходится от 1 до 12 молекул воды. В формулах ее пишут отдельно, напр., гипс — СаSО4·2Н2О, мирабилит — Na2SO4·10H2О и др. 2. Гидратация окислов заключается в разложении воды и окислов и построении новых соединений — гидроокисей. Н и О, входившие в состав воды, занимают в структуре новых соединений разл. самостоятельные позиции. Напр., брусит — Mg(OH)2, гидраргиллит — Аl(ОН)3 и др. Такая вода называется конституционной.3. Г. называют также поглощение воды коллоидами — адсорбция поверхностью частиц и поглощение цеолитной воды — в каналах кристаллической решетки (см. Вода в минералах). Г. характерна для процессов выветривания и регрессивного метаморфизма.