Что такое гибридизация какие виды гибридизации бывают
Гибридизация атомных орбиталей

Всего получено оценок: 880.
Всего получено оценок: 880.
Гибридизация атомных орбиталей – процесс, позволяющий понять, как атомы видоизменяют свои орбитали при образовании соединений. Так, что же такое гибридизация, и какие ее типы существуют?
Общая характеристика гибридизации атомных орбиталей
Гибридизация атомных орбиталей – это процесс, при котором смешиваются различные орбитали центрального атома, в результате чего образуются одинаковые по своим характеристикам орбитали.
Гибридизация происходит в процессе образования ковалентной связи.
Гибридная орбиталь имеет фору знака бесконечности или несимметричной перевернутой восьмерки, вытянутой в сторону от атомного ядра. Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей с орбиталями (чистых или гибридных) других атомов и приводит к образованию более прочных ковалентных связей.
Впервые идею о гибридизации атомных орбиталей выдвинул американский ученый Л. Полинг. Он считал, что у вступающего в химическую связь атома имеются разные атомные орбитали (s-, p-, d-, f-орбитали), то в результате происходит гибридизация этих орбиталей. Суть процесса заключается в том, что из разных орбиталей образуются эквивалентные друг другу атомные орбитали.
Типы гибридизации атомных орбиталей
Существует несколько видов гибридизации:
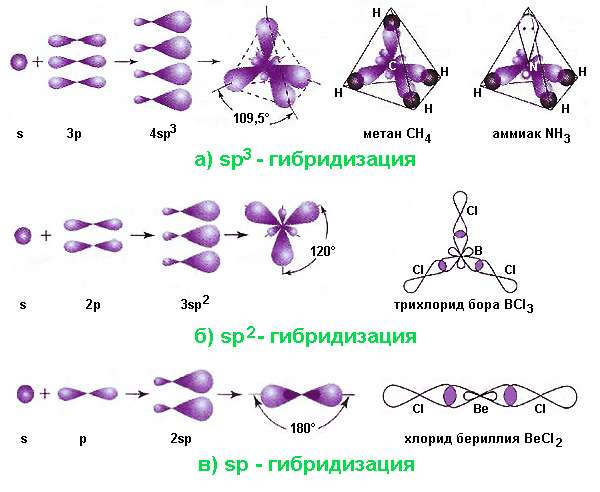
sp3-гибридизация характерна для многих элементов, например, атома углерода и других веществ IVА группы (CH4, SiH4, SiF4, GeH4 и др.)
Возможны также и более сложные виды гибридизации с участием d-орбиталей атомов.
Что мы узнали?
Гибридизация – сложный химический процесс, когда разные орбитали атома образуют одинаковые (эквивалентные) гибридные орбитали. Первым теорию гибридизации озвучил американец Л. Полинг. Выделяют три основных вида гибридизации: sp-гибридизация, sp2-гибридизация, sp3-гибридизация. Существуют также более сложные виды гибридизации, в которых участвуют d-орбитали.
Общее представление о гибридизации
Впрочем, не только биология включает данное понятие. И пусть во вступлении был рассмотрен пример с гибридами как полноценными особями непонятного биологического вида. При этом данное понятие может использоваться и в других науках. И значение данного термина будет несколько отличаться. Но при этом кое-что общее все же есть. Это слово «объединение», которое объединяет все возможные значения данного термина.
Где существует данное понятие?
Термин «гибридизация» используется в ряде наук. А поскольку большая часть существующих ныне дисциплин пересекается, то можно смело говорить об использовании каждого значения данного термина в любой науке, так или иначе связанной с естественными исследовательскими отраслями. При этом наиболее активно данный термин используется в:
Как видим, третий пункт находится на стыке двух наук. И это абсолютно нормальная практика. Один и тот же термин может образовывать на стыке двух наук абсолютно другое значение. Давайте более детально рассмотрим понятие гибридизации в этих науках.
Что такое гибрид?
Например, рассказывают о том, что появляются у кошек и собак дети, которые не являются ни одними из них. Иногда гибриды создаются специально. Например, когда к абрикосу прикрепляют вишню, мы имеем дело как раз с специальной гибридизацией.
Гибридизация в биологии
Каждая из этих разновидностей помогает не только эволюции. Ученые также активно стараются скрещивать разные виды живых существ. Лучше всего получается с растениями. Причин этому несколько:
Это причины, по которым скрещивать два растения значительно проще и эффективнее. В случае с животными, возможно, в будущем получится добиться возможности размножения. Но на данный момент официальным в биологии считается мнение, что животные-гибриды утрачивают способность размножаться, так как данные особи являются генетически нестабильными. Следовательно, неизвестно, к чему может привести их размножение.
Виды гибридизации в биологии
Понятие вегетативной гибридизации
Вегетативная гибридизация имеет ряд преимуществ. Это:
Данные плюсы делают такую разновидность скрещивания очень популярной у садоводов. Также есть такое понятие, как соматическая гибридизация. Это когда скрещивают не половые клетки, а соматические, вернее, их протопласты. Данный способ скрещивания производится тогда, когда невозможно создать гибрид стандартным половым путем между несколькими растениями.
Гибридизация в химии
Но теперь мы немного отступим от биологии и поговорим о другой науке. В химии есть свое понятие, называется оно «гибридизация атомных орбиталей». Это очень сложный термин, но если разбираться немного в химии, то ничего сложного в нем нет. Сперва нужно объяснить, что же такое орбиталь.
Это своеобразный путь, по которому движется электрон. Нас этому учили еще в школе. И если происходит такое, что данные орбитали разного типа смешиваются, получается гибрид. Существует три вида явления, называемого «гибридизация орбиталей». Это такие разновидности:
Данная тема достаточно сложная для изучения, и ее нужно рассматривать неразрывно от остальной части теории. Причем понятие гибридизации орбиталей касается больше конца данной темы, а не начала. Ведь нужно изучить само понятие орбиталей, какими они бывают и так далее.
Выводы
Итак, мы разобрались в значениях понятия «гибридизация». Это, оказывается, достаточно интересно. Для многих было открытием то, что в химии также есть данное понятие. Но если бы этого такие люди не знали, то чему бы они могли научиться? А так, есть развитие. Важно не прекращать тренировать эрудицию, так как это обязательно будет характеризовать вас с хорошей стороны.
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
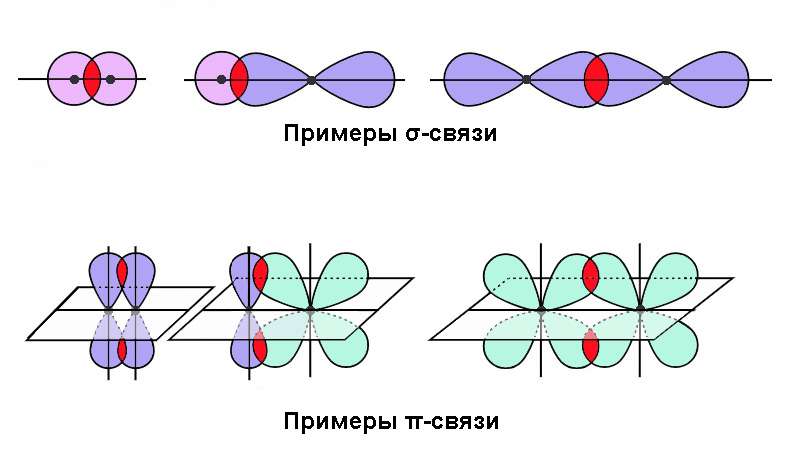
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
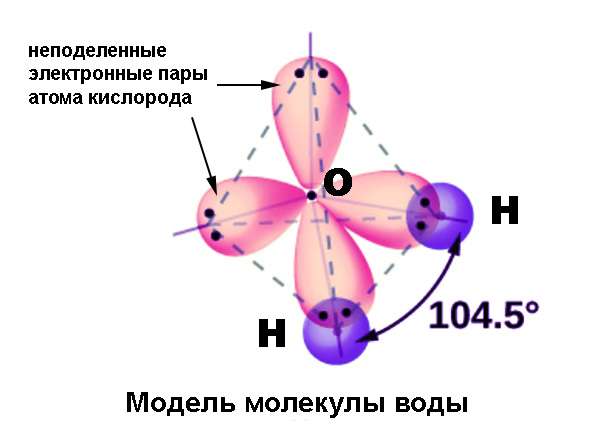
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
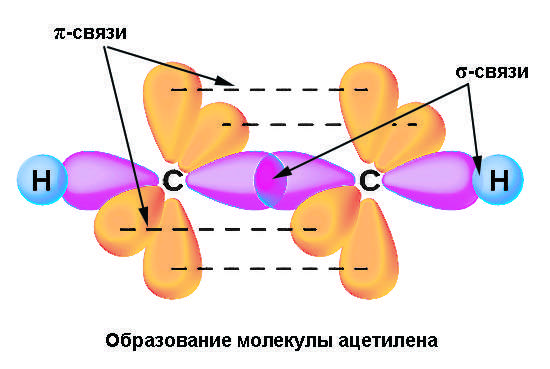
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Гибридизация (биология)
Гибридизация — процесс образования или получения гибридов, в основе которого лежит объединение генетического материала разных клеток в одной клетке.
Может осуществляться в пределах одного вида (внутривидовая гибридизация) и между разными систематическими группами (отдалённая гибридизация, при которой происходит объединение разных геномов). Для первого поколения гибридов часто характерен гетерозис, выражающийся в лучшей приспособляемости, большей плодовитости и жизнеспособности организмов. При отдалённой гибридизации гибриды часто стерильны.
Содержание
Происхождение видов путем гибридизации
При скрещивании различных видов потомство обычно бывает стерильным. Это связано с тем, что число хромосом у разных видов различно. Несходные хромосомы не могут нормально сходиться в пары в процессе мейоза, и образующиеся половые клетки не получают нормального набора хромосом. Однако, если у такого гибрида происходит геномная мутация, вызывающая удвоение числа хромосом, то мейоз протекает нормально и дает нормальные половые клетки. При этом гибридная форма приобретает способность к размножению и утрачивает возможность скрещивания с родительскими формами. Кроме того, межвидовые гибриды растений могут размножаться вегетативным путем.
Существующие в природе естественные ряды гибридных видов растений возникли, вероятно, именно таким путем. Так, известны виды пшеницы с 14, 28 и 42 хромосомами, виды роз с 14, 28, 42 и 56 хромосомами и виды фиалок с числом хромосом, кратным 6 в интервале от 12 до 54. По некоторым данным, гибридогенное происхождение имеют не менее трети всех видов цветковых растений [1].
Гибридогенное происхождение доказано и для некоторых видов животных, в частности, скальных ящериц, земноводных и рыб [2]. Некоторые виды кавказских ящериц, имеющих гибридогенное происхождение, триплоидны и размножаются с помощью партеногенеза.
Гибридное видообразование у растений
Под гибридным видообразованием обычно подразумевают возникновение в потомстве от естественного гибрида новой линии, размножающейся в чистоте и изолированной от родительских видов и от своих сибсов в гибридной популяции. Эта новая линия должна преодолеть гибридную стерильность, и разрушение гибридов.
Рекомбинационное видообразование
Его можно определить как возникновение в потомстве видового гибрида с хромосомной стерильностью нового структурно-гомозиготного рекомбинанта, плодовитого при скрещиваниях с особями своей линии, но изолированного от других линий и от родительского вида преградой, создаваемой хромосомной стерильностью.
Если число независимых транслокаций больше, то хромосомная стерильность, создающая преграды вокруг новых гомозиготных рекомбинантов, усиливается, и новая линия становится более изолированной.
Процесс рекомбинационного видообразования был обнаружен среди потомков экспериментальных гибридов представителей рода табак, у некоторых злаков и других растений. Его роль в природе остается неясной. Вероятно, такое видообразование происходит время от времени, но реже, чем аллополиплоидия.
Гибридное видообразование при участии внешних преград
В селекции
В селекции растений наиболее распространён метод гибридизации форм или сортов в пределах одного вида. С помощью этого метода создано большинство современных сортов сельскохозяйственных растений. Отдалённая гибридизация — более сложный и трудоёмкий метод получения гибридов. Основное препятствие получения отдалённых гибридов — несовместимость половых клеток скрещиваемых пар и стерильность гибридов первого и последующих поколений. Использование полиплоидии и возвратного скрещивания (беккросс) в отдельных случаях позволяет преодолеть нескрещиваемость пар и стерильность гибридов.
Гибридизация ДНК
Гибридизация атомных орбиталей: понятие и основные виды
Одна из задач химии – это изучение строения вещества, в том числе выяснение механизма образования различных соединений из простых веществ, образуемых атомами одного химического элемента. Особенности взаимодействия атомов, точнее, их разноименно заряженных компонентов – электронных оболочек и ядер, – описываются как различные типы химической связи. Так, вещества, имеющие молекулярное строение, образуются посредством ковалентной связи, для описания которой в 1931 году американским химиком Л. Полингом была предложена модель гибридизации атомных орбиталей.
Понятие о ковалентной связи

В тех случаях, когда в процессе взаимодействия происходит образование общей для двух атомов пары валентных электронных облаков, говорят о ковалентной связи. В результате ее возникновения формируется мельчайшая частица простого или сложного вещества – молекула.
Одной из особенностей ковалентной связи является ее направленность – следствие сложной формы электронных орбиталей p, d и f, которые, не обладая сферической симметрией, имеют определенную пространственную ориентацию. Еще одна важная особенность данного типа химической связи – насыщаемость, обусловленная ограниченным количеством внешних – валентных – облаков в атоме. Именно поэтому существование молекулы, например, H2O, возможно, а H5O – нет.
Типы ковалентной связи

Образование общих электронных пар может происходить различными способами. В механизме образования ковалентной связи важную роль играет характер перекрытия облаков и пространственная симметрия результирующего облака. По данному критерию Л. Полинг предложил различать следующие типы:
Эти пространственные характеристики имеют большое значение постольку, поскольку они коррелируют с энергетическими параметрами ковалентной связи.
Особенности многоатомных молекул
Концепция гибридизации атомных орбиталей была введена Полингом для объяснения одной из особенностей ковалентных связей в многоатомных молекулах. Известно, что связи, образуемые центральным атомом в таких молекулах, оказываются одинаковыми по пространственным и энергетическим характеристикам. Это происходит вне зависимости от того, какие орбитали (s, p или d) участвуют в формировании общей электронной пары.
Очень удобным и наглядным примером для иллюстрации этого явления служит атом углерода. При вступлении в химическую связь атом в возбужденном состоянии имеет 4 валентных орбитали: 2s, 2px, 2py и 2pz. Три последних отличаются от орбитали 2s по энергии и форме. Тем не менее в молекуле, например, метана CH4 все четыре связи совершенно равноценны и имеют валентные углы 109,5° (в то время как p-орбитали расположены под углами 90°). В других соединениях углерода встречаются валентные углы 120° и 180°; в молекулах, содержащих азот (аммиак NH3) и кислород (вода H2O) эти углы составляют 107,5° и 104,5°. Возникновение подобных валентных углов также потребовало объяснения.
Суть явления
Идея гибридизации состоит в образовании усредненных орбиталей путем перекрывания электронных облаков разного типа с близкими значениями энергии – s, p, иногда d. Количество результирующих – гибридных – орбиталей соответствует числу перекрывающихся облаков. Поскольку орбиталь – это волновая функция, определяющая вероятность нахождения электрона в той или иной точке атома, гибридная орбиталь представляет собой наложение волновых функций, происходящее в результате электронных переходов при возбуждении атома. Оно приводит к возникновению равнозначных волновых функций, различающихся только направленностью.
Гибридные орбитали эквивалентны по энергии и имеют одинаковую форму в виде объемной восьмерки, имеющей сильную асимметрию относительно ядра. На гибридизацию затрачивается меньше энергии, чем выделяется при образовании прочной ковалентной связи с гибридными орбиталями, поэтому такой процесс энергетически выгоден, то есть наиболее вероятен.
Основные виды гибридизации орбиталей и геометрия молекул
Возможны различные варианты перекрывания (смешения) внешних электронных облаков в атоме. Самыми распространенными являются следующие виды наложения орбиталей:
Существуют и более сложные варианты гибридизации атомных орбиталей: sp3d, sp3d2 и другие.
Роль модели гибридизации
Концепция Полинга дает хорошее качественное описание строения молекул. Она удобна и наглядна, успешно объясняет некоторые особенности ковалентных соединений, такие как величина валентных углов или выравнивание длины химической связи. Однако количественная сторона модели не может считаться удовлетворительной, поскольку не позволяет делать многие важные предсказания, касающиеся физических эффектов, связанных с особенностями строения молекул, – например, молекулярных фотоэлектронных спектров. Сам автор концепции гибридизации уже в начале 1950-х годов отмечал ее недостатки.
Тем не менее в становлении современных представлений о строении вещества модель гибридизации атомных орбиталей сыграла большую роль. На основе ее были разработаны более адекватные концепции, например, теория отталкивания электронных пар. Поэтому, безусловно, модель гибридизации явилась важным этапом в развитии теоретической химии, а при описании некоторых аспектов электронной структуры молекул она вполне применима и в настоящее время.