Что такое гетерогенные реакции пример
Гетерогенные реакции — формулы, особенности протекания и примеры задач
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.

Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
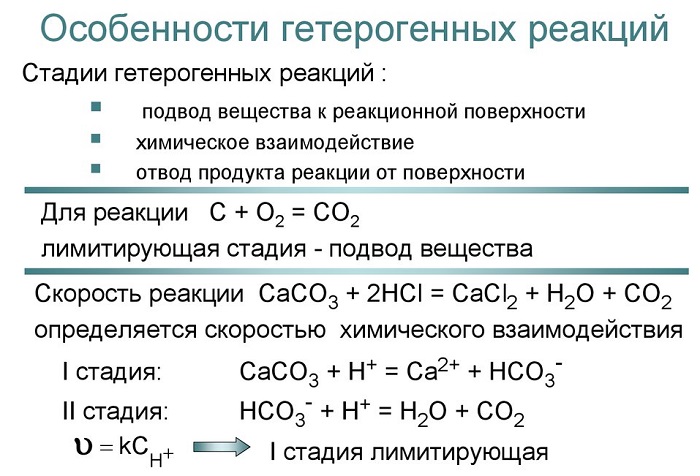
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.

Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.

Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
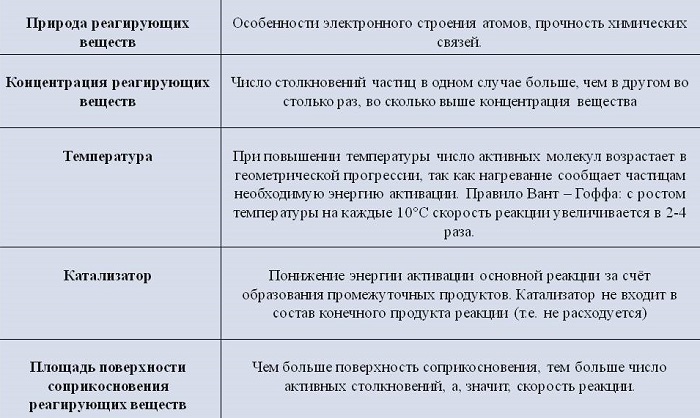
На скорость гетерогенных химических процессов влияют разные факторы.

Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.

Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
Са3(РО4)2 ↓ ↔ 3Са 2+ + 2PO4 3-.
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
ПР = [Са 2+] 3[PO4 3-]2 / [Са3(РО4)2 ].
Величина [Са3(РО4)2] = const, и ПР(Са3(РО4)2) = [Са 2+] 3[PO4 3-]2.
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.

Гетерогенные реакции — формулы, особенности протекания и примеры задач
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
ПР = [Са 2+ ] 3 [PO4 3- ] 2 / [Са3(РО4)2 ].
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ
Особенности гетерогенных реакций обусловлены участием в них конденсированных фаз. Это затрудняет перемешивание и транспорт реагентов и продуктов; возможна активация молекул реагентов на пов-сти раздела фаз. Кинетика любой гетерогенной реакции определяется как скоростью самого хим. превращения, так и процессами переноса (диффузией), необходимыми для восполнения расхода реагирующих в-в и удаления из реакц. зоны продуктов р-ции. В отсутствие диффузионных затруднений скорость гетерогенной реакции пропорциональна размерам реакц. зоны; т. наз. удельная скорость р-ции, рассчитанная на единицу пов-сти (или объема) реакц. зоны, не изменяется во времени; для простых (одностадийных) р-ций она м.б. определена на основе действующих масс закона. Этот закон не выполняется, если диффузия в-в протекает медленнее, чем хим. р-ция; в этом случае наблюдаемая скорость гетерогенной реакции описывается ур-ниями диффузионной кинетики (см. Макрокинетика).
При гетерогенных реакциях с участием одного или неск. твердых реагентов часто образуются твердофазные продукты. Такие р-ции, как правило, локализованы на пов-сти раздела фаз или в поверхностном слое и обычно протекают нестационарно. Они характеризуются периодом индукции, в течение к-рого возникают зародыши (ядра) новой фазы. Их образование связано с перестройкой атомной структуры твердого реагента и требует затраты энергии. Поэтому такие гетерогенные реакции чувствительны ко всем нарушениям структуры, облегчающим образование зародышей, и м. б. активированы термич., радиац., мех. и др. воздействиями, увеличивающими концентрацию дефектов, в первую очередь плотность дислокаций (см. Дефекты в кристаллах). Кинетич. ур-ние р-ции в этом случае отражает изменение во времени не только концентраций реагирующих в-в, но и пов-сти раздела твердых фаз реагента и продукта: по мере роста зародышей пов-сть раздела увеличивается и скорость р-ции сначала возрастает, затем проходит через максимум и снижается вследствие соприкосновения растущих зародышей и образования сплошного слоя твердого продукта (подробнее см. Топохимические реакции).
В природе гетерогенные реакции входят в комплекс процессов, приводящих к образованию осадочных пород и выветриванию. В хим. технологии гетерогенные реакции газа с жидкостью (окисление воздухом, кислородом, озоном; хлорирование и др.) обычно проводят при интенсивном перемешивании спец. мех. устройствами или самим газом (в т. наз. барботажном реакторе). Р-ции термич. разложения составляют основу фотографич. процесса, р-ции между газами или жидкостями и твердыми в-вами-основу обжига, восстановления и окисления металлов, горения, произ-ва твердых катализаторов, выщелачивания, экстракции и др. Часто сочетаются гетерогенные реакции в трех-и многофазных системах, напр. хлорирование твердых оксидов металлов газообразным хлором в присут. твердого углеродсодержащего восстановителя. Важная область использования гетерогенных реакций-получение тонких поверхностных слоев и покрытий при взаимод. твердого тела с жидкостью. При низких т-рах диффузия в глубь твердого материала протекает медленно, что позволяет получать стабильные тонкие поверхностные слои, а в отдельных случаях-двухмерные фазы, толщина к-рых по порядку величины близка к параметру кристаллич. решетки. Иногда стабильные поверхностные слои образуются самопроизвольно; таковы защитные оксидные пленки на металлах, препятствующие дальнейшему окислению (см. Газовая коррозия).
===
Исп. литература для статьи «ГЕТЕРОГЕННЫЕ РЕАКЦИИ» : Янг Д., Кинетика разложения твердых веществ, пер. с англ., М., 1969; Дельмон Б., Кинетика гетерогенных реакций, пер. с франц^ М., 1972; Розовский А.Я., Гетерогенные химические реакции, М., 1980. А.Я.Розовский.
Страница «ГЕТЕРОГЕННЫЕ РЕАКЦИИ» подготовлена по материалам химической энциклопедии.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.