Что такое гепарины низкомолекулярные гепарины
Клинико-экономический анализ применения низкомолекулярных гепаринов в рутинной клинической практике
В.В.Ряженов, С.Г.Горохова Первый МГМУ им. И.М.Сеченова
Проблемы профилактики и лечения тромбозов и тромбоэмболий являются актуальной клинической проблемой. Наиболее часто тромбоз возникает после оперативных вмешательств. В ходе проведенного клинико-экономического анализа прямых затрат на фармакотерапию венозных тромбозов и тромбоэмболий низкомолекулярными гепаринами в ортопедической практике выявлено, что препарат бемипарин имеет фармакоэкономические и клинические преимущества в сравнении с препаратом эноксапарин, и его применение позволяет снизить затраты бюджета здравоохранения.
Ключевые слова: фармакоэкономический анализ, низкомолекулярные гепарины, затраты-эффективность, бемипарин, эноксапарин.
Clinical and economic analysis of LMWHs use in day-to-day clinical practice
V.V.Ryazhenov, S.G.Gorokhova I.M.Sechenov FMSMU, Moscow
Thrombosis and embolism prevention and treatment belong to important clinical problems. Thrombosis occurs mostly after surgery. Our clinical and economic analysis of venous thrombosis and embolism using LMWGs in orthopedic practice shows benefits of bemi-parin in comparison with enoxaparine. Use of bemiparin reduces the cost of health care.
Keywords: pharmacoeconomic analysis, LMWGs, cost-effectiveness, bemiparin, enoxaparin.
В клинической практике профилактику тром-боэмболических осложнений проводят с помощью антикоагулянтных лекарственных средств. Антикоагулянты включают неоднородные по своим фармакологическим характеристикам препараты. К ним относятся нефракционированные гепарины, низкомолекулярные гепарины, а также ингибиторы фактора Ха и прямые ингибиторы тромбина, применяемые в терапии гепарин-индуцированной тромбоцитопении. Применение указанной группы препаратов в целом позволяет добиться удовлетворительного результата, в связи с чем они включены во все современные клинические рекомендации по профилактике и лечению венозных тромбозов и ТЭЛА. При этом предпочтение отдают низкомолекулярным гепаринам по сравнению с нефракцио-нированым гепарином. Это обусловлено тем, что антитромботическая активность гепарина широко варьирует в зависимости от врожденных и приобретенных особенностей синтеза антитромбина III и, соответственно, трудно предсказуема, что требует постоянного индивидуального лабораторного контроля показателей коагуляции. В 1-3% случаев на фоне введения гепарина развивается иммунная тромбоцитопения с последующим тромбозом. Группа низкомолекулярных гепаринов (с молекулярной массой менее 6 кД), таких как бемипарин, дальтепа-рин, надропарин, эноксапарин, обладают несколько иным механизмом действия, основанном на ингиби-ровании активности фактора Ха. В значительно меньшей степени препараты указанной группы влияют на активность тромбина, фактора 11а, а также незначительно связываются с белками плазмы и с клетками эндотелия. К преимуществам гепаринов с низкой молекулярной массой относится меньшая вероятность развития тромбоцитопении. Эти свойства выражаются в стабильном антитромботиче-ском эффекте и низком риске геморрагических осложнений, отсутствии необходимости в частом лабораторном мониторинге по сравнению с нефрак-ционированными препаратами.
В последнее десятилетие было проведено значительное количество сравнительных исследований по оценке эффективности и безопасности клинического применения нефракционированных и низкомолекулярных препаратов гепарина при профилактике венозных тромбозов и тромбоэмболий. Установлено, что гепарины низкой молекулярной массы значительно превосходят нефракционированные гепарины по фармакологическим и фармакокине-тическим свойствам (табл. 1), обладают большей биодоступностью при подкожном введении, более длительным периодом полувыведения, в связи с чем препараты низкомолекулярных гепаринов можно вводить 1-2 раза в сутки. В то же время лекарства этой группы различаются между собой по ряду характеристик.
Таблица 1. Преимущества и недостатки препаратов гепарина в профилактике и лечении венозных тромбозов и тромбоэмболии
Недостатки нефракционированного гепарина в профилактике и лечении тромбоза глубоких вен и ТЭЛА
Преимущества низкомолекулярных гепаринов (НМГ) перед нефракционированными гепаринами
Быстрая элиминация из организма
Более высокая клиническая эффективность
Необходимость многократного введения
Пролонгированный эффект, сокращение частоты введения
Высокая вероятность геморрагических осложнений
Отсутствие необходимости интенсивного лабораторного мониторинга
Необходимость интенсивного лабораторного мониторинга систем свертывания
Менее выраженное влияние на функции тромбоцитов
Меньшая вероятность развития осложнений и побочных эффектов
В европейских исследованиях показано фармакоэ-кономическое преимущество бемипарина по сравнению с эноксапарином, применяемым для профилактики венозных тромбоэмболий при ортопедических вмешательствах на коленных суставах, а также по сравнению с оральными антикоагулянтами и нефракционированным гепарином при лечении глубоких венозных тромбозов [3, 10, 13, 15]. Кроме того, показаны преимущества в увеличении качества жизни у больных, получавших бемипарин[3].
При различиях в механизмах действия, режимах применения, клинических результатах указанных антикоагулянтных лекарственных средств, становится важным проведение фармакоэкономического анализа разных стратегий профилактики и лечения ТЭ в российской практике. В связи с этим целью настоящей работы стала сравнительная оценка прямых затрат на фармакотерапию тромбозов и эмбо-лий низкомолекулярными гепаринами бемипарин и эноксапарин в ортопедической практике при эндо-протезировании коленного сустава.
Методология
Фармакоэкономический анализ различных стратегий лечения венозных тромбозов при эндопроте-зировании коленного сустава проводили методом моделирования с применением методики «затраты-эффективность» в рамках анализа влияния на бюджет (Budget Impact Analysis, BIA) [2, 17]. При разработке модели новой внедряемой стратегией считали стратегию терапии бемипарином (препаратом Цибор ® ), альтернативной используемой стратегией — терапию эноксапарином (препаратом Клексан).
Построение модели, определение показателя затратной эффективности проводили на основании данных многоцентрового рандомизированного двойного слепого сравнительного исследования эффективности и безопасности бемипарина и энокса-парина в профилактике венозных тромбозов и эм-болий при эндопротезировании коленного сустава у 381 пациента [18]. В ходе этого исследования оба препарата вводили подкожно 1 раз в сутки: бемипа-рин в дозе 3500 МЕ с началом введения через 6 часов после операции, эноксапарин в дозе 4000 МЕ (40 мг) с началом введения за 12 ч до операции. Временной горизонт исследования составил 10 дней с начала терапии.
Показатель «затраты-эффективность» (cost-effectiveness ratio, CER) рассчитывали по формуле: CER = C/Ef
где: С — общие прямые затраты в группе пациентов (в рублях); Ef — эффективность терапии в группах.
Ставку дисконтирования в расчеты не включали в соответствии с рекомендациями к проведению анализа влияния на бюджет.
Показателем эффективности и безопасности бе-мипарина и эноксапарина в профилактике венозных тромбозов и эмболий при эндопротезировании коленного сустава считали количество состоявшихся венозных тромбозов, определяемых по данным билатеральной венографии. В расчет затрат включали только прямые затраты на фармакотерапию препаратами НМГ, допуская отсутствие различий в сопутствующей терапии и непрямых затратах при данных стратегиях лечения.
Таблица 2. Цены на препараты Клексан и Цибор® в условиях разработанной модели
Лекарственный препарат
Стоимость упаковки лекарства, руб.
Затраты на суточную дозу лекарства, руб.
Цибор®, раствор для подкожного введения 3500 анти-Ха МЕ /0,2 мл, шприцы № 10
Таблица 3. Общие затраты и показатель «затраты-эффективность» в группах из 100 пациентов с эндопротезированием коленного сустава в условиях разработанной модели
Группа пациентов
Затраты на фармакотерапию, руб.
Результаты
Заключение
Антикоагулянты, действующие на процесс тромбообразования
Ч. 1 Тромбоэмболия легочной артерии и тромбоз глубоких вен — самые распространенные причины смертности и инвалидности при сердечно–сосудистых заболеваниях.
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Первого МГМУ им. И.М. Сеченова, к.фарм.н.
Единственным доказательным по эффективности методом профилактики тромбозов и тромбоэмболических осложнений является применение антикоагулянтов, изменяющих вязкость крови, способствующих разжижению и повышению текучести крови. Стандартная схема лечения рекомендует начинать использовать антикоагулянты сразу после диагностирования таких заболеваний. Применение антикоагулянтов с момента появления симптомов позволяет предотвратить формирование сгустка крови, его увеличение и закупоривание сосудов. Большинство антикоагулянтов оказывают влияние не на сам кровяной сгусток, а на активность свертывающей системы крови.
Низкомолекулярные гепарины для парентерального введения (селективные ингибиторы фактора Ха)
Низкомолекулярные гепарины состоят из фрагментов гепарина с молекулярной массой от 2000 до 10 000 (в среднем 4000–5000 Да), получают путем фракционирования, гидролиза или деполимеризации обычного нефракционированного гепарина. В отечественной практике используют следующие препараты низкомолекулярных (фракционированных) гепаринов:
Эти препараты неоднородны по своему составу, т.к. содержат разные фракции гепарина и отличаются друг от друга антикоагулянтной активностью, физико-химическими и фармакокинетическими свойствами, но обладают антикоагулянтным и антитромботическим действием. Антикоагулянтный эффект продолжительный и зависит от действующего вещества (от 6 до 18 час.). При выборе антикоагулянта не учитывается возраст больных, тяжесть сопутствующих заболеваний, уровень тромбоза и степень нарушения внутрисердечной гемодинамики.
Низкомолекулярные гепарины блокируют процесс свертывания крови, угнетая в большей степени преимущественно активность фактора Ха, некоторые из них незначительно оказывают влияние на снижение образования протромбиназы (активатора протромбина) и активность фактора IIа. Протромбиназа (prothrombinase complex) — сложный комплекс, состоящий из активированных факторов свертывания Ха и Vа и др. факторов, который формируется на поверхности мембран тромбоцитов в присутствии ионов кальция. В процессе свертывания крови образуется как тканевая, так и кровяная протромбиназа. При применении антикоагулянтов количество образовавшейся протромбиназы очень мало, оно недостаточно для перевода протромбина в тромбин.
Прямые антикоагулянты катализируют образование комплекса с антитромбином III, тромбином и др. активированными факторами. Образуется тройной комплекс с антитромбином III, они необратимо изменяют его конфигурацию и сокращают период его полужизни до 3–6 часов. Связывание с антитромбином III усиливает угнетающее действие на активность фактора Ха, тем самым снижается переход протромбина в тромбин. В результате нейтрализации происходит ингибирование тромбина и формирование тромбов. В отличие от гепарина низкомолекулярные гепарины не связываются с фактором фон Виллебранда, легко инактивируются на поверхности тромбоцитов, что снижает риск геморрагических осложнений, реже развивается тромбоцитопения и остеопороз.
Низкомолекулярные гепарины, так же, как и гепарин, действуют на факторы свертывания через антитромбин III, но отличаются от гепарина следующими свойствами:
Низкомолекулярные гепарины способны блокировать каскад коагуляции на более ранних его этапах, обладают быстрым, выраженным, стабильным и более предсказуемым антикоагулянтным эффектом. Они имеют меньшее сродство к фактору 4 тромбоцитов и поэтому реже, чем стандартный гепарин, вызывают побочные эффекты. Фактор 4 тромбоцитов — антигепариновый, обладает выраженной антигепариновой активностью, устраняет эффект гепарина, его влияние на образование протромбиназы и на увеличение проницаемости сосудов. Антигепариновой активностью обладают также разрушенные и интактные тромбоциты, что связано со способностью тромбоцитов адсорбировать гепарин и его фрагменты и выделять фактор 4 тромбоцитов в плазму крови.
Применяют низкомолекулярные гепарины в основном для профилактики и лечения тромбоза глубоких вен (после хирургического вмешательства), для предупреждения тромбоэмболии легочной артерии. Низкомолекулярные гепарины показаны при нестабильной стенокардии, остром ишемическом инсульте и инфаркте миокарда, для профилактики и терапии тромбозов в акушерско–гинекологической практике, колоректальной и ортопедической хирургии. Их используют для профилактики свертывания крови в системе экстракорпорального кровообращения при длительном проведении гемодиализа или гемофильтрации.
Важно! При применении низкомолекулярных гепаринов могут возникать кровотечения. В первые дни лечения возможна умеренная тромбоцитопения. Низкомолекулярные гепарины в ряде случаев повышают активность печеночных ферментов, могут вызвать аллергические реакции и при длительном применении возникает опасность развития остеопороза. При передозировке протамин сульфат полностью не устраняет эффекты низкомолекулярных гепаринов (≤ 60%). Противопоказанием к их применению является повышенная чувствительность к тому или иному препарату, тяжелая почечная дисфункция, внутричерепное кровоизлияние, беременность, кормление грудью и др.
Формы выпуска низкомолекулярных гепаринов – специальные шприцы-дозаторы разового использования (в блистере по 2 шприца одноразового применения, упак. — 10 шт.).
Доза действующего вещества выражается в международных единицах (МЕ) с активностью подавления фактора Ха в плазме крови и выпускается в виде раствора для инъекций в мл.
Выпускается в растворе для п/к и в/в введения 2,5 м/0,5 мл. 0,5 мл помещают в специальный шприц с иглой вместимостью 1 мл, снабженный автоматической системой безопасности. После подкожной инокуляции Фондапаринукс полностью всасывается из места инъекции, выводится почками в течение 3 суток.
Важно! Применяют с осторожностью при повышенном риске развития кровотечений и гиперчувствительности к препарату. Препарат не рекомендуется смешивать с другими медикаментами.
ПРЯМЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ АНТИКОАГУЛЯНТЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ
К пероральным антикоагулянтам, прямым ингибиторам фактора свертывания крови Ха (активированного фактора Стюарта–Прауэра) относят Апиксабан (Эликвис), Ривароксабан (Ксарелто).
Апиксабан (Эликвис, тб., покр. обол., 2,5 мг и 5 мг) является мощным прямым ингибитором фактора свертывания крови Xa. Он избирательно и обратимо блокирует активный центр фермента, угнетает активность протромбиназы. Для реализации его антитромботического действия не требуется наличия антитромбина III. В результате ингибирования фактора свертывания крови Xa изменяются значения показателей системы свертывания крови: удлиняется активированное тромбопластиновое время и протромбиновое время. Препарат опосредованно влияет на агрегацию тромбоцитов, оказывая антиагрегантный эффект. Апиксабан быстро всасывается из желудочно–кишечного тракта. Абсолютная биодоступность при приеме 10 мг достигает 50%, максимальная концентрация достигается в течение 3 час. после приема внутрь. Период полувыведения (Т½) составляет около 12 час. Прием пищи не оказывает влияния на фармакокинетические показатели. С белками плазмы крови связывается на 87%. Основным путем выведения является кишечник.
Важно! При временном перерыве в терапии Апиксабаном (преднамеренном или случайном) возрастает риск тромбоза. Пациентов следует проинструктировать о необходимости избегать таких перерывов. При временной остановке антикоагуляционного лечения по любым причинам оно должно быть возобновлено как можно скорее.
Не рекомендуется применять у пациентов с заболеванием печени и с повышенным риском кровотечений, во время беременности и в период грудного вскармливания.
Ривароксабан (Ксарелто, тб., покр. обол., 2,5 мг, 10 мг, 15 мг, 20 мг) — высокоселективный дозозависимый прямой ингибитор фактора Ха. Активация фактора X с образованием фактора Ха через внутренний и внешний пути свертывания играет центральную роль в коагуляционном каскаде. Высокая биодоступность (80–100%) наблюдается при приеме в дозе 10 мг, которая не зависит от приема пищи. При приеме натощак 20 мг препарата биодоступность составляла всего F=66%. Максимальная концентрация достигается через 2–4 час. после приема. Большая часть Ривароксабана (92–95%) связывается с белками плазмы крови.
Ривароксабан, 2,5 мг, применяют с целью профилактики смертности вследствие сердечно–сосудистых осложнений, инфаркта миокарда у пациентов после острого коронарного синдрома; 10 мг — в профилактике венозной тромбоэмболии у пациентов, которым проводят обширные ортопедические хирургические вмешательства на нижних конечностях, 15 и 20 мг – для лечения тромбоза глубоких вен и тромбоэмболии легочной артерии, а также с целью профилактики их рецидивов и для профилактики системной тромбоэмболии и инсульта у пациентов с фибрилляцией предсердий неклапанного происхождения.
Важно! Не рекомендуется применять препарат во время беременности, в период грудного вскармливания, детям и подросткам до 18 лет, при наличии болезней почек, при наличии злокачественных новообразований и гиперчувствительности у пациентов.
Низкомолекулярные гепарины: возможности применения при беременности
Существует целый ряд заболеваний, результаты лечения которых трудно предсказуемы. Невынашивание беременности относится именно к таким заболеваниям, однако, непредсказуемость результатов лечения в случае этой патологии имеет особое драматическое значение.
Об эффективности применения низкомолекулярных гепаринов (НМГ) при невынашивании беременности мы беседуем с главным акушером-гинекологом ПФО, заведующей кафедрой акушерства и гинекологии № 1 ГБОУ ДПО КГМА Минздрава России, профессором Ларисой Ивановной Мальцевой.
— Что такое низкомолекулярные гепарины?
— Гепарин является основным препаратом прямого антикоагулянтного или антитромботического действия. Его эффекты опосредуются несколькими протеинами плазмы: антитромбином III, гепариновым кофактором II, TFPI (ингибитор внешнего пути свертывания). Обычный (нефракционированный) гепарин (НГ) является высокомолекулярным соединением, его молекулярная масса — 15-20 тысяч Да, при этом биодоступность составляет всего 30%. Это определено гетерогенностью структуры, способностью связываться с различными белками и клетками-макрофагами, клетками эндотелия и др. Кроме того, нефракционированнный гепарин подвержен влиянию антигепаринового фактора тромбоцитов, образуя с ним специфический комплекс, который может вызвать гепариновую иммунную тромбоцитопению и тромбоз. Большие дозы гепарина снижают уровень антитромбина III, что может вызвать гиперкоагуляцию и также стать причиной тромбоза. Таким образом, наряду с множеством плюсов обычный гепарин обладает рядом нежелательных эффектов, которых лишен низкомолекулярный гепарин (НМГ). НМГ имеет молекулярную массу в 3-4 раза меньшую, чем нефракционированный гепарин и 100% биодоступность, благодаря чему препараты этой группы дольше циркулируют в крови, обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Изменение структуры молекулы гепарина, то есть уменьшение молекулярной массы почти в три раза, повлекло за собой изменения в фармакодинамике и фармакокинетике препарата. Одно из важнейших качественных отличий НМГ от НГ — способность существенно не удлинять такие показатели как АЧТВ и ТВ, что связано преимущественно с воздействием на фактор Ха (а не на антитромбин III) и ингибицией внешнего пути свертывания. Меньшая зависимость НМГ от активности антитромбина III позволяет применять препараты НМГ у больных с дефицитом этого фактора. НМГ не вызывают гипокоагуляции и практически не требуют лабораторного контроля при своем использовании. В последнее время активно изучается способность НМГ блокировать системный воспалительный ответ, который является основой таких состояний в акушерстве, как преэклампсия, сепсис, антифосфолипидный синдром, невынашивание беременности. При невынашивании беременности препараты НМГ используются очень широко.
— С чем это связано?
— Дело в том, что более чем в 50% случаев, по некоторым данным, причиной невынашивания беременности являются различные формы тромбофилий, среди которых доминирует антифосфолипидный синдром (АФС). Его роль в невынашивании и недонашивании беременности доказана, и этот очевидный факт уже широко известен в акушерском сообществе. Основным средством лечения являются препараты НМГ. Другие причины невынашивани: острые и хронические инфекционные заболевания, генетические факторы, эндокринная патология, аномалии развития половых органов — имеют меньший удельный вес (особенно при привычном невынашивании), чем тромбофилии.
— Есть ли противопоказания к применению низкомолекулярных гепаринов?
В России зарегистрированы несколько препаратов НМГ, применяемых в акушерстве: надропарин, эноксипарин, дельтапарин. Противопоказанием для их применения являются наследственные или приобретенные тромбоцитопении и/или тромбоцитопатии, дефекты плазменного звена гемостаза — болезнь Виллебранда, носительство гемофилии А или В, редкие геморрагические дефекты (дефицит фактора V, V и VIII, VII, X, XI, XIII, II). Заподозрить патологию гемостаза можно при анализе анамнеза женщины: кровотечения после родов/абортов меноррагии, носовые, десневые кровотечения, при операциях, в т.ч. минимальных (тонзилэктомия, экстракция зуба и др.). Противопоказаны НМГ при кровотечении любого происхождения, высоком артериальном давлении, патологии печени с коагулопатией. В акушерском и гинекологическом отделениях РКБ № 2 широко применяются препараты НМГ для лечения невынашивания беременности и другой патологии, связанной с риском тромботических осложнений.
— Какие исследования в этом направлении ведутся на кафедре?
— Сфера научных интересов кафедры связана с оптимизацией лечения привычного невынашивания беременности, преждевременных родов и плацентарной недостаточности. Нами было установлено, что АФС часто сочетается с хроническими воспалительными заболеваниями половых органов: хроническим эндометритом, цервицитом, кольпитом. Антифосфолипидные антитела поддерживают воспалительный процесс, усиливая аутоиммунный компонент воспаления и не всегда НМГ могут снизить уровень воспалительного ответа. Отсюда, по нашему мнению, неэффективность лечения невынашивания в ряде случаев при доказанном АФС. Включение в комплекс лечения натурального прогестерона и аспирина в небольших дозах, а также обоснованной терапии иммуноглобулинами для внутривенного введения достоверно снижает уровень провоспалительных цитокинов, продуктов деградации фибрина, повышая эффективность лечения. Кроме того, различные препараты обладают неодинаковой противовоспалительной активностью. Исследования продолжаются.
Таким образом, созданные в 1995 году НМГ оказались практически незаменимыми препаратами при определенной патологии в акушерстве и гинекологии. Альтернативные методы лечения АФС при невынашивании беременности в виде плазмафереза, больших доз имунноглобулина для внутривенного введения, аспирина значительно уступают НМГ как по эффективности, так и по безопасности. Вместе с тем врач должен четко представлять себе, что применение НМГ требует навыков и четких знаний.
Современные антикоагулянтные препараты
(лекция)
Modern anticoagulants (lecture)
Благовестова А.П., Дуюнова Е.В., Эрметов В.К
Самарский государственный медицинский университет
Тольяттинский медицинский консилиум. 2017, № 5-6
Резюме
В статье представлен обзор антикоагулянтов, использующихся в современной медицине, представлены классификация, механизмы действия, показания, противопоказания к использованию и режимы дозирования.
Ключевые слова: антикоагулянты, антагонисты витамина К, низкомолекулярные гепарины, варфарин
Антикоагулянты – препараты, блокирующие реакции плазменного гемостаза – в настоящее время очень широко используются в клинической медицине. Современная классификация, предложенная в 2013 году рабочей группой по тромбозам Европейского общества кардиологов [1], в первую очередь подразделяет все антикоагулянты по пути введения в организм человека – парентеральные или для приёма per os. Далее, согласно механизму действия, внутри каждой из этих групп выделяются непрямые и прямые антикоагулянты. Препараты, которые не оказывают непосредственного действия на факторы свёртывания крови, а являются кофакторами антитромбина или блокаторами витамина К, относятся к антикоагулянтам непрямого действия. Лекарственные средства, обладающие способностью непосредственно блокировать активные центры IIа или Xа факторов свёртывания крови (F), и не требующие для реализации антитромботического действия дополнительных веществ, являются прямыми антикоагулянтами. Подробно механизмы действия представителей каждой из перечисленных групп препаратов будут рассмотрены ниже.
Таким образом, современная классификация антикоагулянтов выглядит следующим образом:
В Российской Федерации в настоящее время наиболее широко распространены парентеральные непрямые и оральные (как непрямые, так и прямые) антикоагулянты.
Парентеральные непрямые антикоагулянты
В 1916 году J.M. Lean выделил из печени собак антикоагулянтную субстанцию, которая в первое время использовалась в качестве лабораторного реактива для предотвращения свертывания крови. Впоследствии этот антикоагулянт был назван гепарином (греч. hepar – печень). C. Best (1930) разработал метод экстракции гепарина из легких крупного рогатого скота, L. Roden (1935) окончательно установил его структуру.
Первое клиническое испытание гепарина провел Masson (1924) у волонтера, получив значительное удлинение времени свертывания крови. Однако в качестве лекарственного препарата для предотвращения тромбозов гепарин стал широко использоваться лишь в годы Второй Мировой войны. В 1949 году в институте Choay (Франция) на основе гепарина был разработан антитромботический препарат «кальципарин», высокая концентрация которого позволяла вводить его подкожно (п/к). Тем не менее, в течение многих лет гепарин назначался внутривенно и только в начале 70-х годов исследования, выполненные сотрудниками института Choay доказали эффективность использования препарата в малых дозах у большого числа пациентов в послеоперационном периоде.
Нефракционированный гепарин (НФГ) – гликозаминогликан, содержащийся почти во всех тканях и органах организма и состоящий из смеси фракций полисахаридов с молекулярной массой в пределах от 3 000 до 30 000 Да. Основным свойством НФГ является «прямое» антикоагуляционное действие на систему свертывания крови, заключающееся в потенцировании ингибиторного действия антитромбина (АТ) на F II, F IXa, F Xa, F XIa и F XIIa. Активность АТ в присутствии НФГ возрастает в 1 000-100 000 раз. Основой антикоагуляционного эффекта является образование тройных комплексов: [F IIa : АТ : НФГ] и [F Xa : АТ : НФГ]. Проявление антикоагуляционной активности НФГ возможно только при достаточном уровне АТ. В случае снижения концентрации последнего в крови введение НФГ бесполезно без возмещения потерь АТ.
НФГ в больших дозах угнетает агрегацию тромбоцитов. Помимо этого, НФГ принимает участие во многих процессах метаболизма, влияя на углеводный, белковый и жировой обмен. НФГ обладает сосудорасширяющим действием, улучшает микроциркуляцию, оказывает гипогликемическое и местное противовоспалительное действие. Он опосредованно тормозит реакцию антиген-антитело, обладает антиаллергическими свойствами. НФГ способен регулировать ангиогенез и пролиферацию эндотелиальных клеток [2].
Для медицинского использования гепарин выпускается в виде натриевой и кальциевой соли. Активность препарата выражается в единицах действия. Раствор гепарина для инъекций выпускается с активностью 5 000, 10 000 и 20 000 МЕ в 1 мл. НФГ действует быстро, но кратковременно. Метаболизируется НФГ главным образом печенью, но около 20% выводится почками. При дозе 100 ЕД/кг T1/2 составляет один час, при более высоких дозах его содержание снижается нелинейно. Выраженность эффекта зависит от пути введения препарата. При инфузионном введении эффект развивается сразу же, поддерживается непрерывно на необходимом уровне. При прекращении введения или уменьшении его скорости, эффект НФГ быстро угасает. При болюсном в/в введении действие препарата длится 4-5 часов, а после п/к инъекции эффект развивается через 40-60 минут и продолжается 8-12 часов.
При использовании терапевтических доз препарата антикоагулянтный эффект НФГ мониторируется с помощью активированного парциального тромбинового времени (АПТВ), которое рекомендуется увеличивать в 1,5-2,5 раза по сравнению с нормальной плазмой. Определение АПТВ должно проводиться каждые 6 часов с коррекцией скорости введения гепарина до тех пор, пока два последующих измерения не будут соответствовать целевым значениям, а состояние больного не будет стабильным. После этого АПТВ определяется 1 раз в 12-24 часа. Для оценки эффективности проводимой терапии возможно определение уровеня D-димера [3].
В условиях массивной гепаринизации во время операций с искусственным кровообращением или вмешательств на коронарных артериях применение высоких доз НФГ основано на стандартных протоколах, учитывающих массу тела больного и вид хирургического вмешательства. В таких ситуациях мониторинг за действием НФГ осуществляется с помощью активированного времени свертывания (АВС) [3, 4].
Наиболее серьёзными осложнениями при применении НФГ являются кровотечения и гепарин-индуцированная тромбоцитопения. Основными причинами развития кровоточивости могут быть иммуноопосредованная тромбоцитопения, а также факторы риска, обусловленные сопутствующими заболеваниями (заболевания печени, почек, инвазивные вмешательства, септические состояния, травма).
В 1-5% случаев при применении НФГ развивается гепарин-индуцированная тромбоцитопения (ГИТ), которая возникает на 4-6 сутки лечения гепарином и в 30% случаев осложняется рикошетными тромбозами. Различают два типа тромбоцитопении, обусловленной гепарином:
I тип – развивается у больных, ранее получавших НФГ. ГИТ-1 встречается в 5-6% случаев лечения НФГ, характеризуется бессимптомным течением, ранним снижением количества тромбоцитов до 100·109 /л. Препараты гепарина при этом типе тромбоцитопении не противопоказаны, однако рекомендуется более тщательный дальнейший контроль за динамикой числа тромбоцитов крови.
II тип – развивается у больных, ранее не получавших НФГ. ГИТ-2 обусловлена выработкой аутоантител к комплексу [НФГ : тромбоцитарный фактор 4] и возникает обычно через 6-14 дней лечения, при этом доза НФГ может быть минимальной, как, например, при промывании гепарином венозных катетеров. ГИТ-2 характеризуется выраженным и стабильным снижением числа тромбоцитов в крови (на 30% и более от исходного) и проявляется коагулопатией с высоким риском развития как кровотечений, так и тромбоэмболических осложнений. При возникновении ГИТ-2 противопоказано продолжение лечения гепарином во всех его формах. Если продолжение антитромботической терапии необходимо, то назначают антикоагулянты, не образующие комплекс с фактором 4 тромбоцитов (пентасахариды, гликозаминогликаны, производные гирудина, пептидные антитромбины). Риск развития ГИТ-2 значительно возрастает при наличии у пациента фонового иммунного заболевания (антифосфолипидный синдром (АФС), системная красная волчанка, узелковый периартериит и др.).
Низкомолекулярные гепарины (НМГ) – фрагменты НФГ, полученные путем химической или ферментативной деполимеризации со средней молекулярной массой 4 000-8 000 дальтон. В 1976 году V. Kakkar [5] установил, что уменьшение молекулярной массы гепарина приводит к снижению его способности ингибировать тромбин. Именно блокада тромбина является основной причиной развития кровоточивости при гепаринотерапии. При этом уменьшение молекулярной массы не влияет на основной механизм антикоагулянтного действия гепарина – способность блокировать F Xa. Патент на низкомолекулярный гепарин (надропарин кальция) был получен институтом Choay в 1978 году, его успешная клиническая апробация была выполнена V. Kakkar в 1982 году и с 1985 года было разрешено производство этого препарата с торговым названием «Фраксипарин». В настоящее время известны около десяти препаратов этого класса.
Уменьшение молекулярной массы НМГ способствует улучшению их фармакокинетических характеристик: НМГ имеют большую биодоступность и быструю всасываемость из депо по сравнению с НФГ, более длительный T0,5, выводятся из организма преимущественно почками. При этом НМГ меньше влияют на тромбоциты, что сопровождается снижением частоты геморрагических осложнений. У препаратов этой группы более удобный режим введения (дважды в сутки, фраксипарин форте – один раз в сутки), при их использовании отсутствует необходимость лабораторного мониторинга. Недостатком НМГ является их высокая стоимость. Однако необходимо помнить, что различные представители НМГ различаются по физико-химическим, биологическим и фармакокинетическим характеристикам, то есть не являются взаимозаменяемыми. Каждый представитель НМГ имеет свой спектр антитромботического действия, показания к клиническому использованию. Поэтому необходимым является соблюдение конкретного способа применения, рекомендованного для каждого препарата.
Вводятся НМГ п/к в участок живота снаружи от края прямой мышцы ниже пупка. Введение в/в допустимо, однако такую методику используют редко – в случае необходимости получения срочного антитромботического эффекта. Внутримышечное введение НМГ запрещено.
Контроль за терапией НМГ осуществляется по их способности к блокированию F Xa – анти-Xa активность плазмы по Международному стандарту низкомолекулярных гепаринов. При этом важно соблюдать время получения пробы – через 3-4 часа после инъекции для профилактических доз при однократном введении и в середине между двумя инъекциями при двукратном терапевтическом применении. Исследование анти-Xa активности должно быть проведено в течение 1-2 часов с момента забора крови. Однако проведение исследования анти-Xa активности для большинства лабораторий недоступно в связи с высокой стоимостью исследования, поэтому обычно используются терапевтические дозы НМГ в соответствии с весом больного на основании рекомендаций фирмы-производителя.
Контроль за уровнем тромбоцитов крови обязателен при использовании любых гепаринов и проводится до начала введения препарата, а затем – один раз в 3-5 дней. Эффект от применения НМГ оценивается по купированию признаков тромбинемии (D-димер) [4, 6].
Фондапаринукс (торговое название – «Арикстра», производитель – GlaxoSmithKline) по химической структуре относится к группе синтетических пентасахаридов, механизм действия которого заключается в угнетении активности F Xа. Связываясь с АТ, пентасахариды приблизительно в 300 раз усиливают нейтрализацию F Xa, что прерывает цепь реакций свертывания крови и, следовательно, предотвращает тромбообразование. В отличие от гепаринов пентасахариды не конъюгируют с другими белками, в том числе с 4 фактором тромбоцитов, в связи с чем они не способны провоцировать ГИТ. Пентасахариды также не инактивирует тромбин.
Фондапаринукс рекомендован к использованию для:
Препарат выпускается в шприцах по 0,5 мл, содержащих 2,5 мг фондапаринукса. В этой дозе препарат не влияет на показатели коагулограммы и не требует лабораторного контроля. После п/к введения фондапаринукс быстро и полностью всасывается, максимальная концентрация в плазме достигается через 2 часа после введения, T1/2 составляет около 17-20 часов. Выведение препарата осуществляется почками.
Курс лечения продолжается, как правило, 5-9 суток.
С осторожностью препарат следует использовать у пациентов с повышенным риском развития кровотечений. Не рекомендуется одновременное применение с другими средствами, вызывающими гипокоагуляцию (фибринолитиками, блокаторами рецепторов IIb-IIIa, НФГ, НМГ). При сочетании с АСК, тиенопиридинами, НПВС необходимо соблюдать осторожность и проводить соответствующий контроль.
Парентеральные прямые антикоагулянты
Механизм действия прямых антикоагулянтов, как уже было указано ранее, заключается в целенаправленной блокаде активных центров факторов свёртывания крови (IIа или Xа), что приводит к нейтрализации их коагуляционных свойств и развитию состояния гипокоагуляции.
Прямые ингибиторы тромбина (F IIа). Прототипом для этих препаратов послужил нативный гирудин. С лечебной целью пиявки (Hirudo medicinalis) использовались ещё в Древней Греции, однако антикоагулянтное действие их слюны впервые было описано J.Haycraft в 1884 году. В 1955 году F.Markwardt удалось выделить в чистом виде вещество, названное “гирудин”, а в 80-е годы XX века, после определения его химической структуры, стало возможным промышленное производство этого препарата в культуре дрожжей ДНК-рекомбинантным методом. Дальнейшие исследования, базировавшиеся на изучении структуры гирудина, привели к появлению семейства гирудино-подобных пептидов (гиругенов и гирулинов). Синтетическим путём были получены аргатробан и производные бороаргинина.
Однако, вопреки ожиданиям, представители данного лекарственного класса не оказывают существенного влияния на результаты терапии и прогноз у пациентов с острыми коронарными синдромами в сравнении с гепарином. Значимое снижение частоты неблагоприятных исходов при терапии прямыми ингибиторами тромбина наблюдается только в раннюю фазу и практически не распространяется на период после прекращения введения препаратов. При этом высокая стоимость прямых ингибиторов тромбина существенно ограничивает их применение в клинике.
Прямые ингибиторы F X. Отамиксабан – экспериментальный прямой селективный ингибитор фактора свёртываемости крови Ха с быстрым началом/окончанием действия в форме инъекций. В исследовании III фазы ТАО проводилась сравнительная оценка эффективности отамиксабана с НФГ +/- ингибитор GP IIb/IIIa в отношении снижения риска смерти или нового инфаркта у пациентов с ОКС бп ST. Однако, согласно последним данным, клинические испытания отамиксабана прерваны из-за его неэффективности – в ходе клинических испытаний выяснилось, что он не имеет существенного преимущества перед традиционной терапией [7].
Таким образом, прямые антикоагулянты для парентерального введения к настоящему моменту не нашли широкого применения в клинической практике.
Оральные непрямые антикоагулянты
Антагонисты витамина К – препараты этой группы угнетают синтез факторов свертывания крови, не вмешиваясь непосредственно в коагуляционный процесс. Именно поэтому их ещё называют антикоагулянтами непрямого действия. По механизму действия они являются антагонистами витамина К (АВК), активная форма которого участвует в заключительных стадиях синтеза факторов свертывания крови II, VII, IX и X, а также естественных антикоагулянтов протеина C и S (ПрС, ПрS). АВК блокируют фермент витамин К-редуктазу, восстанавливающую окисленную форму витамина К в его активную форму (рис. 1). Нарушение активации витамина К сопровождается синтезом неактивных форм витамин К-зависимых факторов свертывания крови, способность которых к коагуляционным реакциям значительно снижена (PIVKA-протеины – Proteins, Induced in Vitamin K Absence). Развивается состояние гипокоагуляции, препятствующее образованию тромбина, формированию фибринового сгустка и, следовательно, развитию и прогрессированию тромбообразования.
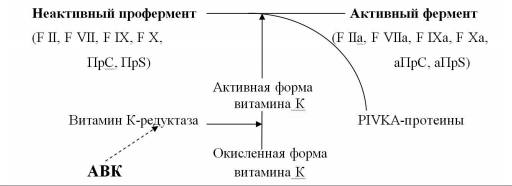 |
| Рис. 1 Механизм действия антикоагулянтов непрямого действия трансформация, активация, ингибиция (Вавилова Т.В., 2005, в модификации |
Скорость снижения активности факторов свертывания крови под влиянием АВК неодинакова. Первым уменьшается активность F VII, T1/2 которого в плазме составляет 4-6 часов; затем – F IX и F X, T1/2 которых равен 48 часам; последней снижается активность F II – примерно через 3-4 суток от начала приема препарата. В том же порядке происходит и восстановление уровня факторов после отмены АВК: быстро нормализуется F VII, позже – F IX и F X, и только через несколько дней – F II. В настоящее время установлено, что для получения выраженного антитромботического эффекта первостепенное значение имеет снижение содержания в плазме именно F II. Поэтому при переводе больного с НФГ или НМГ на терапию АВК, последние важно назначать за 4-5 дней до отмены гепарина. В противном случае возникает промежуток времени, в течение которого больной остается без воздействия антикоагулянтов, что сопровождается усилением процессов тромбообразования.
При назначении АВК необходимо помнить, что уже на начальном этапе лечения развивается выраженное снижение активности естественных антикоагулянтов – ПрС и его кофактора ПрS. Затем наступает стабилизация их активности и даже частичное восстановление ее уровня, в то время как депрессия факторов свертывания крови продолжается. Исходя из этого, следует воздерживаться от назначения АВК при тромбофилиях, обусловленных дефицитом указанных антикоагулянтов, а также при ДВС-синдроме, когда активность ПрС снижена иногда до очень низкого уровня [8].
Основным преимуществом препаратов этой группы перед прямыми антикоагулянтами является наличие таблетированных форм, что делает удобным длительное использование АВК. Их достоинством является и отсутствие необходимости взаимодействия с АТ для проявления гипокоагуляционного действия, поэтому применение АВК возможно на фоне дефицита АТ.
В настоящее время в мировой практике и в России наиболее широко применяется препарат группы монокумаринов – варфарин (кумадин). В 2001 г. препарат зарегистрирован в России фирмой Nikomed. Форма выпуска – пластиковые флаконы, каждый из которых содержит 50 или 100 таблеток Варфарин Никомед по 2,5 мг.
АВК применяются при необходимости длительной (иногда пожизненной) и непрерывной антикоагулянтной профилактики и терапии при наличии высокого риска развития тромбозов и системных тромбоэмболий, в том числе кардиогенных. Однако использование этих препаратов требует регулярного контроля за показателями протромбинового времени (ПВ), соблюдения определенных правил питания, осторожности при наличии сопутствующих заболеваний и их лечении.
Успех применения АВК зависит от адекватности дозы препарата и грамотной организации лабораторного контроля за уровнем гипокоагуляции. Перед назначением АВК необходимо оценить противопоказания к его приему; выявить факторы, влияющие на колебания антикоагулянтного эффекта и предполагаемую продолжительность терапии; исследовать общий анализ крови (включая подсчет тромбоцитов), общий анализ мочи, ПВ, АПТВ, функциональное состояние печени (билирубин, активность трансаминаз) и почек (мочевина, креатинин).
Если во время терапии варфарином возникло кровотечение, необходимо оценить степень его тяжести, показания МНО, уточнить режим приема препарата и других лекарств. Развившееся кровотечение может быть купировано введением свежезамороженной плазмы или использованием препаратов витамина К1 (не викасола!). Сложность купирования кровотечения в такой ситуации заключается в том, что в России не производится и не зарегистрирован препарат витамина К1. В настоящее время доступен препарат «Протромплекс 600», содержащий факторы протромбинового комплекса (II, VII, IX, X) и антикоагулянты (ПрC и АТ) в точных дозировках.
Величина поддерживающей дозы варфарина и стабильность гипокоагуляционного эффекта зависят от ряда врожденных и приобретенных факторов:
Снижение чувствительности к варфарину отмечается при микседеме, хроническом алкоголизме, АФС.
Таким образом, применение препаратов из группы АВК требует обучения пациента и постоянного контакта с ним, тщательного выявления факторов риска развития кровотечений и регулярного лабораторного контроля за уровнем гипокоагуляции. В целях оптимизации применения АВК в масштабах страны целесообразным представляется организация выпуска препарата витамина К1 или закупка последнего у фирм-производителей.
Оральные прямые антикоагулянты
Несколько лет назад, благодаря инновационным разработкам ведущих мировых фармацевтических компаний, в арсенале врачей появились прямые антикоагулянты для приёма per os. Эти препараты избирательно ингибируют только один фактор свертывания крови – или F IIа (тромбин), или F Xа. Возможность их использования в широкой клинической практике – прорыв в современной медицине, так как впервые за многие десятилетия появилась реальная альтернатива варфарину [9]. При этом прямые пероральные антикоагулянты (ПОАК) имеют целый ряд преимуществ перед антагонистами витамина К: не требуют рутинного лабораторного контроля и соблюдения диеты, демонстрирует ограниченное число взаимодействий с другими лекарственными средствами [10]. Вследствие этого ПОАК всё более широко используются во врачебной практике [11, 12, 13]. Кроме того, этим лекарственным средствам, в отличие от гепаринов и фондапаринукса, для осуществления антикоагулянтного действия не нужно образовывать комплекс с антитромбином. Кроме того, данные препараты, в отличие от гепаринов, не связываются с 4-м тромбоцитарным фактором, не являются антигенами и не вызывают иммунную тромбоцитопению [10].
В Российской Федерации в настоящий момент для применения зарегистрированы следующие ПОАК – апиксабан, дабигатрана этексилат и ривароксабан. Данные препараты применяются в следующих клинических ситуациях [14, 15, 16, 17]:
Однако практическим врачам необходимо чётко понимать, что названные выше лекарственные средства принципиально различаются между собой:
| Таблица 1 Режим дозирования ПОАК в зависимости от клинической ситуации |
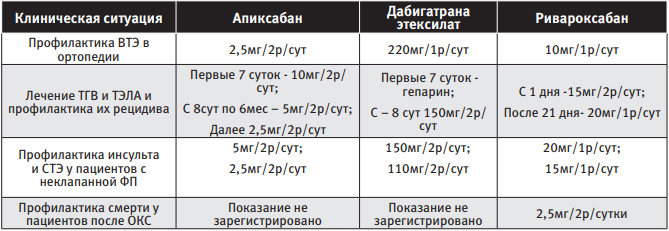 |
Блокатор F IIа – дабигатрана этексилат (торговое название – «Прадакса ® », производитель – Boehringer Ingelheim International) – пролекарство, которое после приёма внутрь быстро трансформируется сывороточной эстеразой в дабигатран – прямой ингибитор F II (тромбина). Фармакокинетический профиль дабигатрана в плазме крови здоровых добровольцев характеризуется быстрым увеличением концентрации в плазме с достижением максимальной концентрации (Сmax) в пределах 0,5-2 часов. После достижения Cmax плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный T1/2 в среднем составляет около 14-17 часов у молодых людей и 12-14 часов у пожилых. При этом T1/2 не зависит от дозы. Пища не влияет на биодоступность дабигатрана этексилата. Биодоступность дабигатрана составляет 6,5%. При назначении данного препарата очень важно учитывать состояние почек пациента, так как дабигатран экскретируется преимущественно почками (80% от принятой дозы), и его накопление в организме повышает риск кровоточивости.
Блокаторы F Xа
Апиксабан (торговое название – «Эликвис ® », производитель – Bristol-Myers Squibb Company). Препарат обратимо и селективно блокирует активный центр F X. Апиксабан не оказывает непосредственного прямого влияния на агрегацию тромбоцитов, но опосредованно ингибирует агрегацию, индуцированную тромбином. Абсолютная биодоступность апиксабана достигает 50% при его применении в дозах до 10 мг. После приёма внутрь апиксабан быстро всасывается из ЖКТ, Cmax в крови достигается в течение 3–4 часов. Приём пищи не оказывает влияния на показатели Cmax апиксабана. Приблизительно 25% принятой дозы выводится в виде метаболитов. Основной путь выведения – через кишечник. Почечная экскреция апиксабана составляет приблизительно 27% от его общего клиренса, T1/2 – около 12 часов. Нарушение функции почек, возраст (≥80 лет) и вес пациента (≤60 кг) – это те факторы, наличие которых требует снижения дозы у пациентов с ФП.
Заключение
Таким образом, на современном этапе развития медицины практическому врачу доступен целый ряд антикоагулянтов, блокирующих процессы тромбообразования. При их использовании, в первую очередь, необходимо соблюдать существующие показания и противопоказания к их применению, а также ориентироваться в особенностях фармакодинамики и фармакокинетики каждого из этих препаратов. Кроме того, чрезвычайно важным является выявление индивидуальных особенностей пациента (возраст, вес, наследственность, личный анамнез, сопутствующая патология), что позволяет применять данные лекарственные препараты не только эффективно, но и безопасно.