Что такое геномный импринтинг
Что такое геномный импринтинг
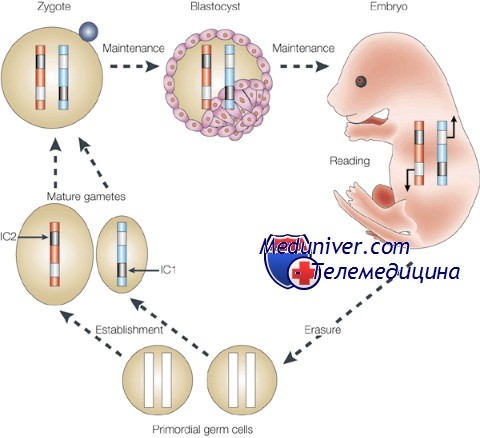
Кроме регуляции на уровне транскрипции и трансляции, на экспрессию специфических генов влияют эпигенетические регуляторные механизмы ооцита, сперматозоида и раннего эмбриона. Эта регуляция осуществляется через процесс геномного импринтинга, а также всю молекулярную программу через глобальные изменения степени метилирования и структурного ре-моделирования хроматина. Последнее связано с существенными изменениями архитектоники ядра в процессе роста и созревания ооцита.
Хромосомы живых ооцитов мышей можно наблюдать при использовании культуральной среды, содержащей краситель Hoechst — химическое вещество, образующее хелатные соединения с малой бороздкой ДНК и испускающее синее флюоресцентное излучение при поглощении ультрафиолетовых лучей. Изначально в примордиальных и первичных фолликулах центромеры и околоцентромерный гетерохроматин располагаются на периферии ядра ооцитов. Затем, по мере роста ооцита, они распределяются по всему ядру, впоследствии скапливаясь по периферии ядрышка. Этот перинуклеолярный гетерохроматиновый ободок, или кариосфера, выглядит как яркий ореол вокруг ядрышка.
Несмотря на то что этот ареол связывают с тотальным угнетением транскрипционной активности и высокой готовностью к мейозу и развитию эмбриона, сегодня хорошо известно, что ремоделирование хроматина и угнетение транскрипции — отдельные процессы, регулируемые разными механизмами. Как и в соматических клетках, важную роль в масштабном ремоделировании хроматина больших ооцитов играют гистондеацетилазы, так как их ингибирование приводит к разрушению архитектоники кариосферы и нарушениям конфигурации мейотических хромосом и веретена деления.
Другой важный установленный механизм эпигенетической регуляции — контроль активации и угнетения транскрипционной активности через процессы деметилирования и метилирования соответственно. В то время как геном предшественников соматических клеток подвергается реметилированию уже перед гаструляцией к 6,5 дпк, геном предшественников ППК остается деметилированным еще к 12,5 дпк. К 15,5 дпк происходит частичное метилирование, завершающееся к 18,5 дпк. Геном эмбриона инактивен вплоть до двухклеточной стадии развития у мышей (восьмиклеточной у человека), после чего он активируется при помощи тотального деметилирования.
Такие глобальные изменения метилирования следует отличать от Х-инактивации и геномного импринтинга. Если коротко, Х-инактивация — сложный и во многом случайный процесс, при котором одна из Х-хромосом у самок млекопитающих (с генотипом XX) инактивируется, чтобы обеспечить эквивалентное количество Х-сцепленных генов у эмбрионов с женским XX- и мужским XY-генотипом. Инициация этого процесса контролируется локусом, именуемым центром Х-инактивации (Xic), расположенным на Xql3. Этот локус содержит специфический транскрипт Х-инактивации (Xist), на котором записана некодирующая мРНК, покрывающая Х-хромосому в цис-положении, и запускает инактивацию.
Геномный импринтинг
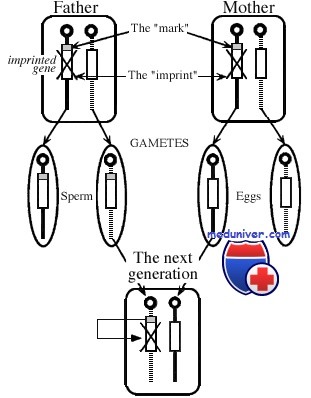
И наконец, более геноспецифичный механизм эпигенетической регуляции — геномный импринтинг, с помощью которого осуществляется предопределенный дифференциальный сайленсинг материнских и отцовских аллелей. В процессе гаметогенеза определенные гены аутосом гиперметилируются (сайленсинг) в зависимости от их родительской принадлежности. Будучи однажды установленными, эти метки (импринты), как предполагают, становятся защищенными от тотального деметилирования генома.
Импринтинг для разных генов может происходить в разное время в процессе оогенеза, сперматогенеза и эмбриогенеза. Зачастую врожденные синдромы и раковые опухоли возникают в результате неэффективного сайленсинга или инактивации аллеля соответствующего родителя.
Механизмы импринтинга — поле для перспективных исследований, особенно необходимых в репродуктологии, так как в последнее время появились сообщения о связи ВРТ с потенциально высоким риском возникновения дефектов импринтинга у эмбрионов. Кроме того, имеются предположения, основанные на моделях мышей, что созревание ооцита и культивирование эмбриона in vitro нарушает процесс импринтинга. Тем не менее статистическая значимость этих исследований сомнительна, так как дефекты импринтинга редки как в общей популяции, так и у детей, зачатых с помощью ВРТ. Следовательно, вопрос о закономерности этой связи остается до сих пор открытым.
Если предположить, что ВРТ достоверно связаны с дефектами импринтинга, следует изучить все возможные причины их появления, включая контролируемую гиперстимуляцию яичников, культивирование эмбрионов и сами клинические состояния, послужившие причиной бесплодия, так как дефекты импринтинга могут сами являться причиной бесплодия. Понятно, что необходимы дальнейшие интенсивные исследования в этой области, которые позволят понять, могут ли таким образом механизмы импринтинга влиять на развитие ВРТ.
Роль импринтинга генов при внутриутробной задержке роста плода
1ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва 2ФГБУ Эндокринологический научный центр Минздрава России, Москва 3Первый МГМУ им. И.М. Сеченова, кафедра эндокринологии и диабетологии (педиатрический факультет), Москва, Россия
Цель исследования. Провести анализ литературных данных о влиянии эпигенетических изменений, в частности геномного импринтинга, на развитие и функционирование плаценты и регуляцию роста и развития плода.
Материал и методы. Проведен поиск в базе данных NSBI Pub Med за последние 30 лет о влияние эпигенетических изменений на регуляцию роста плода.
Результаты. Описаны механизмы импринтинга генов, отличительной чертой, которых является их экспрессия только из одной аллели; она может наследоваться как по отцовской, так и по материнской линии.
Заключение. Предполагается, что механизм экспрессии может контролировать поток питательных веществ от матери к плоду, как увеличивая его, так и уменьшая. Такая дизрегуляция может приводить к нарушениям развития плода. Испытания репродуктивных технологий на животных показали, что изменения эпигенома зародыша на ранней стадии развития приводят к импринтингу, что может, как провоцировать, так и ограничивать внутриутробную задержку роста плода.
Эпигенетический механизм
Эпигенетический механизм относится как к наследственным, так и к потенциально обратимым механизмам генома, являясь фундаментальным аспектом генной регуляции ДНК. Существуют 2 типа данной регуляции в зависимости от действия на ДНК и хроматин: активирующие хроматин (усиливают генную экспрессию) и дезактивирующие (подавляют экспрессию). Метилирование нуклеотида с цитозином, комплементарным гуанину (ЦпГ-метилирование), и метилирование аденина (ЦпА-метилирование) являются единственными механизмами эпигенетического действия на ДНК. ЦпГ-метилирование генов-промоутеров и регуляторных элементов негативно влияют на генную экспрессию через выработку белковых репрессивных комплексов и специфических модификаций гистонов [1]. Синтезирование ковалентных модификаций к гистонам является более сложной формой эпигенетических процессов. Классифицируют данный процесс: по типу (метилирование, фосфорилирование, ацетилирование, а также убиквитинация), позиции (в том числе лизин 4, 9, 27 и 36) и числу замещений в нуклеотидах (моно-, ди- или триметилирование). Гистоновый код, отражающий последовательность гистоновых модификаций, включая тип, позицию и число, может находиться как в активном, репрессированном, так и в бивалентном состоянии хроматина, что приводит к синтезу в спирали ДНК репрессорных протеиновых комплексов [2]. Эпигенетическая регуляция играет центральную роль в геномном импринтинге и по-разному ассоциирует между собой сочетания родительских генов для их экспрессии. Таким образом, геномный импринтинг осуществляется разнообразными эпигенетическими модификациями в материнских и отцовских хромосомах. Они предопределены уникальными структурами, которые устанавливают «зародышевую линию» развития плода на всех стадиях. Гены, наиболее часто подвергающиеся импринтингу, обнаруживаются обычно в кластерах и содержат, как правило, область контроля ЦпГ (ICR), устанавливающую характер импринтинга на участке цепи. Они являются особо важными регуляторными элементами, управляющим аллельной экспрессией генов [1].
Геномный импринтинг
Открытие геномного импринтинга произошло в результате исследований, целью которых было изучить причину присутствия партеногенеза у отдельных особей. При помощи серии экспериментов с пересадкой ядер в клетки мышей было обнаружено, что зиготы, сгенерированные из хромосом, взятых у обоих родителей (материнские и отцовские хромосомы), или только из отцовского материала, не выживали [3].
Внутриутробное развитие эмбрионов с материнским набором хромосом было ограничено, их плацента была бедна сосудами, а общая масса эмбриональных тканей была снижена. Однако при отцовском наборе хромосом наблюдали трофобластическую неоплазию с низкой долей эмбрионального компонента и патологически увеличенной плацентой, что продемонстрировало отсутствие эквивалентности между материнским и отцовским генетическим материалом, уникальность обоих компонентов и невозможность их взаимозаменяемости. Дальнейшие исследования данного феномена имеют свое начало от исследований мышей с однородительской дисомией. Мыши-носители гетерозиготной транслокации были скрещены друг с другом для тестирования некомплементарности отцовских аллелей. В результате была получена первая геномная карта мышей с обозначением участков хромосом 2, 8 и 17 [1]. Были выявлены места участков импринтинга генов: материнская специфичная экспрессия гена Igf2r и Н19 на 17-й хромосоме и отцовская специфичная экспрессия гена Igf2r на 7-й хромосоме [1, 4]. Обнаруженные гены дали ключ к пониманию механизмов, регулирующих геномный импринтинг.
Интересно, что плацентарные млекопитающие и злаковые растения имеют геномный импринтинг, в то время как у рептилий и птиц он отсутствует. Даже если имеется рудиментарная плацента, как у сумчатых, это является доказательством наличия плаценты у животного [5, 6]. Такая близкая корреляция между наличием импринтинга и наличием плаценты, органа-контролера потока питательных веществ от матери к плоду, привела к появлению гипотез об импринтинге как источнике эволюции генов. Самой общепринятой гипотезой является конфликт родительских генов, согласно которой импринтинг-гены облегчают поступление веществ от матери к плоду и усиливают рост в эмбриональном и постнатальном периоде [1]. «Конфликт» родительских генов между собой приводит к нормализации экспрессии плацентарных генов, что обеспечивает нормальный рост плода. Однако внешние факторы могут нарушить баланс и вести к развитию внутриутробной задержки роста плода (ВЗРП) или микросомии плода, или к макросомии плода («крупный плод»). Даже при наличии таких убедительных гипотез в силе остаются ключевые вопросы: какие механизмы регулируют дифференциальную экспрессию отцовских и материнских аллелей и какой физиологический эффект они о.
Научная электронная библиотека
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
2.9. Эпигенетические процессы и наследственные болезни
В исследованиях генетических процессов, связанных с патогенезом заболеваний, особое внимание уделяется не только изменениям последовательностей ДНК, но также и транскрипционной активности ДНК в клетке. Вариация активности генома (экспрессия генов) как в отдельно взятой клетке, так и во всем организме достигается за счет различных эпигенетических процессов. Эпигенетические процессы представляют собой наследуемые изменения в экспрессии генов, нарушающие законы Менделя, без количественного или качественного (мутационного) изменения последовательности ДНК. В настоящее время описан целый ряд эпигенетических феноменов и процессов, таких как инактивация хромосомы Х, геномный импринтинг, унипарентальная дисомия, изменение порядка репликации ДНК, метилирование ДНК, биохимическая модификация гистонов и другие. Изучает подобные процессы особое направление в генетике – эпигенетика. Наиболее изученными эпигенетическими процессами являются модификация химической структуры ДНК за счет метилирования цитозина ЦГ динуклеотидов в 5′-положении, приводящее к транскрипционной инактивации генов, а также различные биохимические модификации гистоновых белков, образующих хроматин, которые могут, как приводить к инактивации, так и к активации генов. Следует отметить, что эпигенетические механизмы лежат в основе нормальной активности клетки, тогда как нарушение этих процессов приводит к целому ряду функциональных аномалий различных тканей организма, среди которых наиболее часто встречаются пороки развития центральной нервной системы. Наиболее подробно изученным эпигенетическим феноменом является процесс инактивации хромосомы Х.
Несмотря на то, что вклад каждой хромосомы Х (отцовской и материнской) должен составлять примерно 50 %, у значительного числа женщин наблюдается инактивация преимущественно одной из родительских хромосом Х – неравная Х-инактивация или сдвиг Х-инактивации. Известны следующие механизмы инактивации хромосомы Х, приводящие к случайной (равной) [1] и неравной Х-инактивации [2, 3]:
1) процесс, приводящий к случайной Х-инактивации, следующий: отцовская или материнская хромосома Х независимо инактивируется в каждой клетке на ранних стадиях развития плода. Инактивация генов сохраняется за счет метилирования цитозина на неактивной хромосоме Х. Таким образом, достигается практически эквивалентная (50:50) экспрессия генов отцовской и материнской хромосом Х в организме.
2) процесс, приводящий к неслучайной Х-инактивации, следующий: одна из хромосом Х (отцовская или материнская) имеет летальную мутацию, что препятствует дальнейшему развитию клеток, в которых хромосома Х с мутацией активна. В результате чего, в организме присутствуют преимущественно клетки, в которых мутированная хромосома Х неактивна, и, таким образом, в организме наблюдается неравная Х-инактивация.
3) процесс, приводящий к неслучайной Х-инактивации, может быть следующий: мутации в гене XIST приводит к тому, что выбор активной хромосомы Х неслучайный.
Неравная инактивация хромосомы Х представляется одной из особенностей ряда наследственных заболеваний. Болезни, связанные с ней, могут быть вызваны генными или хромосомными (геномными) мутациями, а также внешними факторами, при которых наблюдается неравная инактивация хромосомы Х без мутаций. Эта группа заболеваний включает в себя болезни, связанные с Х-сцепленными рецессивными мутациями, большую часть которых составляет Х-сцепленная умственная отсталость, а также ряд мультифакторных заболеваний (например, аутизм).
Известным эпигенетическим феноменом, имеющим особое значение для медицинской генетики – генетики нервных и психических болезней, является полиморфизм генов или SNP (single nucleotide polymorphisms), приводящий к изменению последовательности ДНК, связанному
с нарушением функциональной активности закодированного им белка. В настоящее время описано несколько подобных генов, полиморфные варианты которых имеют повышенную частоту среди больных нервными и психическими болезнями, например, гены, кодирующие серотониновые и допаминовые рецепторы при шизофрении. Несмотря на то, что этот феномен все же связан с изменением последовательности ДНК, тот факт, что они являются синонимическими мутациями, позволяет рассматривать подобные вариации экспрессии генов в рамках эпигенетики.
Определенные участки гомологичных хромосом не являются функционально одинаковыми. Локусы в таких участках могут показывать различия их активности в зависимости от материнского и отцовского происхождения. Так, определенные гены в зависимости от того, на какой хромосоме (материнской или отцовской) они расположены, вносят различный вклад в развитие эмбриона. Такие специфические различия в регуляции генов в зависимости от родительского происхождения определяются как геномный импринтинг.
Геномный импринтинг может вовлекать генные локусы либо отцовского, либо материнского происхождения. Так, в соматических клетках человека, как у мужчин, так и у женщин отцовская последовательность ДНК гомологичных хромосом может быть активна, в то время как материнская последовательность ДНК инактивирована. Геномный импринтинг и унипарентальная дисомия (см ниже) являются причиной ряда таких заболеваний, как синдром Прадера-Вилли и Ангельмана, связанных с локусами длинного плеча (q) хромосомы 15. Геномный импринтинг также зависит от особенностей метилирования в зависимости от родительского происхождения хромосом (различное метилирование локусов родительских хромосом). Например, если ген материнского происхождения метилирован (инактивирован), а этот же ген отцовского происхождения не является метилированным, то только отцовский ген будет экспрессироваться. Так как импритинг стирается в половых клетках, то гомологичные гены становятся метилированными в женских половых клетках, а в мужских половых клетках – неметилированными, в результате чего в зиготе наблюдается различие в метилировании аллелей импринтированных генов. Особенно хорошо демонстрирует феномен геномного импринтинга один из участков хромосомы 7 у мыши. Если одна третья часть обеих хромосом 7 в эмбрионе мыши отцовского происхождения, то мышь будет иметь большие размеры тела. Напротив, если материнского, то эмбрионы будут иметь маленькие размеры по сравнению с нормой и погибнут в ходе эмбрионального развития. Это объясняется различиями инактивации гена инсулин-подобного фактора роста-2 (IGF2), который расположен в этом участке и является особенно значимым для роста в эмбриональном развитии. Этот участок хромосомы 7 у мыши является гомологичным определенному участку короткого плеча хромосомы 11 у человека. Однородительская дисомия этого участка предрасполагает к наследственным синдромам, которые характеризуются клиникой синдрома Беквита-Видеманна (большой размер тела и опухоль Вилмса). Другим примером однородительской дисомии являются синдромы Прадера-Вилли и Ангельмана, при которых наблюдается потеря функций одного из хромосомных участков в зависимости от родительского происхождения. Синдромы Прадера-Вилли и Ангельмана являются клинически различными заболеваниями с нарушениями развития и поведения. Они вызваны потерей функции двух хромосомных участков, локализованных вблизи друг от друга на хромосоме 15. Эти два заболевания различаются клинической картиной вследствие потери функции участка хромосомы либо отцовского, либо материнского происхождения. Это синдромы одного и того же участка одной хромосомы. Делеция этой части хромосомы 15 обнаруживается до 70 % пациентов с синдромами Прадера-Вилли или Ангельмана. Если делеция затрагивает отцовскую хромосому, то это приводит к синдрому Прадера-Вилли и, наоборот, если материнскую – к синдрому Ангельмана. Для синдрома Прадера-Вилли характерны неонатальная гипотония, задержка развития, гиперфагия и ожирение, короткий рост, маленькие верхние и нижние конечности, гипогонадизм и гипопигментация. При cиндроме Ангельмана делеция хромосомы 15 имеет материнское происхождение. Для этой болезни характерны следующие признаки: умственная отсталость с нарушением развития речи, дружеское расположение (ласковый смех без видимых причин), гиперактивное поведение, судороги, специфические изменения в ЭЭГ и гипопигментация. Имеются ДНК маркеры, позволяющие установить родительское происхождение делеции молекулярно-генетическими методами. При синдроме Прадера-Вилли отсутствует отцовский аллель, а при cиндроме Ангельмана – материнский. Примерно 30–35 % пациентов с синдромом Прадера-Вилли и 20–30 % с синдромом Ангельмана не имеют делеции. В этих случаях часто обнаруживают однородительскую дисомию у 30 % детей с синдромом Прадера-Вилли и у 2 % –
с синдромом Ангельмана. У 1–2 % пациентов с синдромом Прадера-Вилли и у 20 % с синдромом Ангельмана не обнаруживают ни делеции, ни однородительской дисомии. В этих случаях болезнь может иметь семейное происхождение. Эти два синдрома являются примером геномного импринтинга у человека. Генные локусы этих синдромов, следовательно, являются объектами геномного импринтинга. Импринтинговые локусы в этом участке затрагивают большое число генов и, по-видимому, контролируются общим центром импринтинга, расположенном в этом районе. Мутации в центре импринтинга могут передаваться половыми клетками одного из родителей.
Унипарентальная или однородительская дисомия является феноменом, определяемым присутствием двух гомологичных хромосом (или хромосомных сегментов), унаследованных только от одного родителя и отсутствием соответствующей хромосомы (или сегмента), унаследованных от другого родителя. Различают два типа унипарентальной дисомии: изодисомия и гетеродисомия. Термин изодисомии относится к наличию двух копий одной и той же родительской хромосомы; гетеродисомия означает, что каждая из двух гомологичных хромосом передалась от одного родителя. Однородительская дисомия может являться причиной различных заболеваний у человека, включая мультифакторные болезни, связанные с нарушениями психики.
Геномный импринтинг
Геномный импринтинг — эпигенетический процесс, при котором экспрессия определенных генов осуществляется в зависимости от того, от родителя какого пола поступил аллель гена. Это ненаследуемый процесс, который не подчиняется наследованию по Менделю. Импринтинг генов вызывает экспрессию аллелей гена, полученных от матери в случае генов H19 или CDKN1C и от отца в случае гена IGF2. Импринтинг некоторых генов в составе генома показан для насекомых, млекопитающих и цветковых растений.
Содержание
Обзор
У диплоидных организмов соматические клетки несут две копии генома. Поэтому каждый аутосомный ген представлен двумя копиями, аллелями, полученными от материнского и отцовского организмов в результате оплодотворения. Для преобладающего числа генов экспрессия идёт с обеих аллелей одновременно. Однако у млекопитающих менее одного процента генов импринтированы, то есть экспрессируется только один аллель. [1] Какой аллель будет экспрессироваться, зависит от пола родительского организма, предоставившего аллель. Например, для гена IGF2 (Инсулино-подобного фактора роста) экспрессируется только аллель, наследуемая от отца. [2]
Слово «импринтинг» было впервые использовано для описания явлений, наблюдаемых у насекомого Pseudococcus nipae. [3] У псевдококцид (Homoptera, Coccoidea) самцы и самки развиваются из оплодотворённых яиц. У самок все хромосомы остаются эухроматиновыми и функционируют, в то время как у самцов один гаплоидный набор хромосом становится гетерохроматиновым после шестого деления зиготы и остаётся таким в большинстве тканей, поэтому самцы являются функционально гаплоидными. [4] [5] [6] У насекомых явления импринтинга обычно означают сайленсинг генома у самцов и поэтому вовлечены в процессы определения пола. У млекопитающих процессы геномного импринтинга вовлечены в функциональное неравенство между родительскими аллелями генов. [7]
История открытия
Первые опыты, обнаружившие различие в хромосомах, полученных от отца или от матери, были проделаны практически одновременно учёными, работавшими в Филадельфии [8] и Кембридже [9] в 1984 году.
Механизм
Импринтинг генов осуществляется с помощью процесса метилирования ДНК. Если по каким-то причинам импринтинг не сработает, это может привести к появлению генетических нарушений (например, синдром Прадера-Вилли). [13]
СОДЕРЖАНИЕ
Обзор
Запечатленные гены у млекопитающих
Партеногенетические / гиногенетические эмбрионы имеют вдвое больший нормальный уровень экспрессии, чем материнские гены, и не имеют экспрессии отцовских генов, в то время как обратное верно для андрогенетических эмбрионов. В настоящее время известно, что у людей и мышей существует не менее 80 импринтированных генов, многие из которых участвуют в росте и развитии эмбриона и плаценты. Гибридное потомство двух видов может показывать необычный рост из-за новой комбинации импринтированных генов.
Было показано, что у домашнего скота однонуклеотидные полиморфизмы в импринтированных генах, влияющих на рост и развитие плода, связаны с экономически важными производственными признаками крупного рогатого скота, овец и свиней.
Генетическое картирование импринтированных генов
Отпечатывающие механизмы
Недавно в новом исследовании был предложен новый механизм наследственного импринтинга у людей, который будет специфическим для плацентарной ткани и не зависит от метилирования ДНК (основной и классический механизм геномного импринтинга). Это наблюдалось у людей, но не у мышей, что предполагает развитие после эволюционного расхождения людей и мышей,
Регулирование
Функции импринтированных генов
Контроль экспрессии конкретных генов с помощью геномного импринтинга уникален для терианских млекопитающих ( плацентарные млекопитающие и сумчатые ) и цветковых растений. Отпечаток целых хромосом был зарегистрирован у мучнистых червецов (род: Pseudococcus ). и грибной комар ( Sciara ). Также было установлено, что инактивация Х-хромосомы происходит импринтированным образом во внеэмбриональных тканях мышей и во всех тканях сумчатых, где всегда замалчивается отцовская Х-хромосома.
Было обнаружено, что большинство импринтированных генов у млекопитающих играют роль в контроле эмбрионального роста и развития, включая развитие плаценты. Другие импринтированные гены участвуют в постнатальном развитии, играя роль, влияющую на сосание и метаболизм.
Гипотезы о происхождении импринтинга
Однако наше понимание молекулярных механизмов геномного импринтинга показывает, что именно материнский геном контролирует большую часть импринтинга как собственных генов, так и генов, полученных от отца, в зиготе, что затрудняет объяснение того, почему материнские гены добровольно отказываются от их доминирование над генами отцовского происхождения в свете гипотезы конфликта.
Другая предложенная гипотеза заключается в том, что некоторые импринтированные гены действуют коадаптивно, улучшая как развитие плода, так и обеспечение матери питанием и уходом. В нем подмножество отцовских генов коэкспрессируется как в плаценте, так и в гипоталамусе матери. Это могло произойти за счет выборочного давления со стороны коадаптации родителей и младенцев с целью улучшения выживаемости младенцев. Отцовски экспрессируемый 3 ( PEG3 ) является геном, к которому может применяться эта гипотеза.
Другие подошли к своему исследованию происхождения геномного импринтинга с другой стороны, утверждая, что естественный отбор работает на роли эпигенетических меток как механизма распознавания гомологичных хромосом во время мейоза, а не на их роли в дифференциальной экспрессии. Этот аргумент основан на существовании эпигенетических эффектов на хромосомы, которые не влияют напрямую на экспрессию генов, но зависят от того, от какого родителя произошла хромосома. Эта группа эпигенетических изменений, которые зависят от родительского происхождения хромосомы (включая как те, которые влияют на экспрессию генов, так и те, которые не влияют), называются эффектами родительского происхождения и включают такие явления, как отцовская инактивация X у сумчатых, неслучайное распределение родительских хроматид в папоротники, и даже переключение типа вязки у дрожжей. Это разнообразие организмов, которые демонстрируют эффекты родительского происхождения, побудило теоретиков поставить эволюционное происхождение геномного импринтинга до последнего общего предка растений и животных более миллиарда лет назад.
Отпечатанные фенотипические подписи локусов
К сожалению, взаимосвязь между фенотипом и генотипом импринтированных генов носит исключительно концептуальный характер. Идея основана на использовании двух аллелей в одном локусе и содержит три различных возможных класса генотипов. Класс реципрокных гетерозиготных генотипов способствует пониманию того, как импринтинг повлияет на взаимосвязь между генотипом и фенотипом. Реципрокные гетерозиготы имеют генетический эквивалент, но фенотипически неэквивалентны. Их фенотип может не зависеть от эквивалентности генотипа. В конечном итоге это может увеличить разнообразие генетических классов, увеличивая гибкость импринтированных генов. Это увеличение также приведет к более высокому уровню возможностей тестирования и ассортименту тестов для определения наличия импринтинга.
Статистические рамки и модели картирования используются для определения эффектов импринтинга на гены и сложные признаки. Аллельный родитель-источник влияет на вариации фенотипа, происходящие от импринтинга классов генотипа. Эти модели картирования и выявления эффектов импринтинга включают использование неупорядоченных генотипов для построения моделей картирования. Эти модели продемонстрируют классическую количественную генетику и эффекты доминирования импринтированных генов.
Расстройства, связанные с импринтингом
Аллель гена «callipyge» (от греческого «красивые ягодицы»), или CLPG, у овец дает большие ягодицы, состоящие из мышц с очень небольшим количеством жира. Фенотип с большой ягодицей возникает только тогда, когда аллель присутствует в копии хромосомы 18, унаследованной от отца овцы, а не в копии хромосомы 18, унаследованной от матери этой овцы.
Мужское бесплодие
Прадер-Вилли / Ангелман
DIRAS3 (NOEY2 или ARH1)
Другой
Запечатленные гены у других животных
Исследования домашнего скота, такого как молочный и мясной скот, выявили причастность импринтированных генов (например, IGF2) к ряду экономических признаков, включая продуктивность молочного скота голштино-фризского скота.