Что такое геномное редактирование
CRISPR для чайников, или Краткая справка по быстрому редактированию ДНК
Возможность изменять фрагменты ДНК всегда была святым Граалем биотехнологии и медицины. CRISPR позволяет делать это с невиданной ранее скоростью и эффективностью. Считайте, что биологи раньше работали на пишущей машинке, а благодаря CRISPR в одночасье пересели на MacBook. Не зря открытие этого метода в 2020 году удостоилось Нобелевской премии по химии.
Резка молекулы ДНК с помощью CRISPR-Cas9 (рис. Джанет Иваса)
Под катом — рассказ о появлении CRISPR, принципах работы и применении в настоящем и будущем. Да, вы все верно поняли, это про редактирование коров, синюю клубнику и арбузы размером со сливу с Aliexpress.
Эта статья — переработанная версия лекции Бориса Климовича, научного сотрудника Университетской клиники Тюбингена и Немецкого центра исследований рака (DKFZ), которая прошла в конце ноября при поддержке Точки кипения ЯрГУ.
Признание к CRISPR пришло в 2012 году — после публикации нобелевской работы. Но, как это обычно бывает в науке, открытие — не личная заслуга пары авторов. В этот раз участников событий было много, и началось все вовсе не с генетики.
Все началось с «грязекопателя»
Аббревиатура CRISPR появилась в конце 80-х в ходе исследований солончаков рядом с испанским городом Аликанте. Аспирант Франсиско Мохика изучал архебактерий, живущих в соленой воде, и наткнулся на странные палиндромные последовательности в их геноме.
Фрагменты длиной около 30 нуклеотидов повторялись много раз и отделялись друг от друга уникальными участками ДНК примерно такой же длины.
Упрощенно обнаруженная структура выглядела так:
На тот момент никто не понимал, зачем нужны эти структуры. Сошлись на том, что они необходимы для некой регуляции (стандартное «объяснение» в биологии, когда ничего не понятно). Структурам сначала дали название SRSR (Short Regularly Spaced Repeats), а потом переименовали в CRISPR (Clustered Regularly Interspaced Palindromic Repeats).
Продолжив работу в том же направлении, Мохика нашел похожие повторы у многих других бактерий. И эта закономерность привлекла внимание.
В 2002 году рядом с CRISPR-массивами у всех бактерий выявили похожие на них структуры — группу белок-кодирующих генов, которую назвали «очень оригинально» — CAS (CRISPR-Associated Genes).
Продвинуться дальше помог своего рода «генетический Google»: GenBank, куда ученые складируют все прочитанные последовательности ДНК. К началу 2000-х годов там накопилось уже достаточно информации, чтобы при помощи алгоритмов BLAST найти, в каких организмах встречаются похожие CRISPR-последовательности.
GenBank — открытая аннотированная база генетической информации. На июнь 2019 года в ней содержалась информация о 329 млрд пар оснований и 213 млн последовательностей. Источник — American Health Information Management Association
Поиск выявил интересную вещь: фрагменты CRISPR встречаются в ДНК бактериофагов — вирусов, которые инфицируют бактерии и убивают их. Получается, что бактерии хранят внутри себя фрагменты ДНК своих злейших врагов.
Так возникла ключевая догадка о том, что CRISPR — это иммунная память бактерий, сохраняющих информацию о вирусах, которыми болели.
Сформулировав эту теорию, Мохика сел писать статью, которую отправил в самый престижный биологический журнал — Nature. Статью отклонили. Затем он пытался ее пристроить в четыре других журнала, но успеха добился лишь через 18 месяцев.
Кстати, в этом он далеко не рекордсмен. В свое время работу Линн Маргулис, предложившую популярную нынче гипотезу симбиогенеза, отклоняли 15 раз! Можно сказать, что Мохика повезло. Его работу опубликовали быстрее, а идея нашла своих сторонников.
Основная функция CRISPR
Следующий шаг в развитии технологии сделал микробиолог Филипп Хорват. В своей докторской работе он исследовал закваски к эльзасской квашеной капусте, а если точнее — молочнокислые бактерии, которые ее квасят.
С появлением CRISPR закваска капусты стала беспроблемным делом (нет, саму капусту не трогали)
После докторской он ушел в молочную промышленность, где столкнулся с проблемой бактериофагов. Они сильно вредили заквасочным культурам, производители молочных продуктов несли огромные убытки. Ховарт искал способы сделать закваски устойчивыми к бактериофагам и наткнулся на работы о CRISPR. Исследуя эту тему, он доказал, что устойчивые к вирусам бактерии перенимают часть их ДНК.
Бактериальная клетка, которая перенесла инфекцию бактериофагом и не умерла, нарезает его геном на мелкую «вермишель», встраивает в CRISPR-массивы и передает эту информацию своим потомкам, которые становятся устойчивыми к бактериофагу.
Позже компанию, в которой работал Хорват, купила корпорация DuPont. А поскольку она производит примерно 40% заквасок для современной молочной промышленности, вы практически наверняка сталкивались с CRISPR в составе йогуртов, пиццы или сыра.
Работы Хорвата показали, что CRISPR-массивы — это действительно иммунная система бактерий.
Это работает так: кусочки ДНК бактериофагов сохраняются в ДНК бактерий в виде CRISPR-массивов. Затем они превращаются в РНК. В этом же куске генома у бактерий кодируется так называемая тракр-РНК (tracrRNA). Вместе они формируют guideRNA, или наводящую РНК, которая затем объединяется с белком Cas9.
Cas9 — это нуклеаза, фермент, который умеет резать ДНК. При помощи guideRNA этот фермент наводится на специфический сегмент в ДНК бактериофага, садится на него и разрезает, как ножницами, чем нарушает размножение вируса.
Нобелевская статья по редактированию генов
Когда две замечательные женщины-ученые Эммануэль Шарпантье и Дженнифер Даудна встретились на конференции в Коста-Рике, предназначение CRISPR уже было известно. Им пришла в голову смелая идея: приспособить эту систему для резки любой ДНК. Они объединили силы своих лабораторий и в 2012 году в журнале Science опубликовали результаты работы.
Иллюстрация из оригинальной статьи
Им удалось объединить две РНК в одну single guide RNA и показать, что механизм резки работает.
Тут надо пояснить, что резка — это и есть основной этап редактирования ДНК. А CRISPR — генетические ножницы. Все детали ниже.
За эту работу в 2020 году они получили Нобелевскую премию по химии.
Эммануэль Шарпантье и Дженнифер Даудна
Это событие уникально по двум параметрам.
Во-первых, это первая премия, которую получили две женщины без сопровождающей мужской компании.
Во-вторых, эта премия очень «быстрая». С момента публикации до ее присуждения прошло всего восемь лет.
Влияние технологии CRISPR проще всего проиллюстрировать, показав частоту упоминаний этой аббревиатуры в научной литературе, которая после 2012 года растет как на дрожжах.
Число упоминаний CRISPR в научной литературе
Второй показатель — количество патентов.
Эта статистика показывает, насколько все изменилось. Технологии редактирования генома предлагались и ранее, но ни одна из них не достигла такого успеха.
Как происходит редактирование ДНК
Первая нобелевская статья демонстрировала редактирование ДНК в пробирке. Перед учеными стояла амбициозная задача — повторить процесс в клетках человека. Фэн Чжан из MIT оптимизировал процесс, сделав его совместимым с живыми клетками, у которых есть ядра.
Фэн Чжан перенес технологию из пробирки в живые клетки
В 2013 году после публикации работы Чжана эта тема стала доминирующей. Появились сообщения о том, что отредактировали геном человека, мыши, дрожжей, ниматод, дрозофилы, резуховидки Таля, рыбки данио-рерио — всех имеющихся у биологов модельных объектов.
Важно понимать, что ДНК — это очень стабильная молекула. Ее можно кипятить или оставлять лежать в земле на сотни тысяч лет.
Самая старая секвенированная ДНК на сегодняшний день имеет возраст 1,7 млн лет.
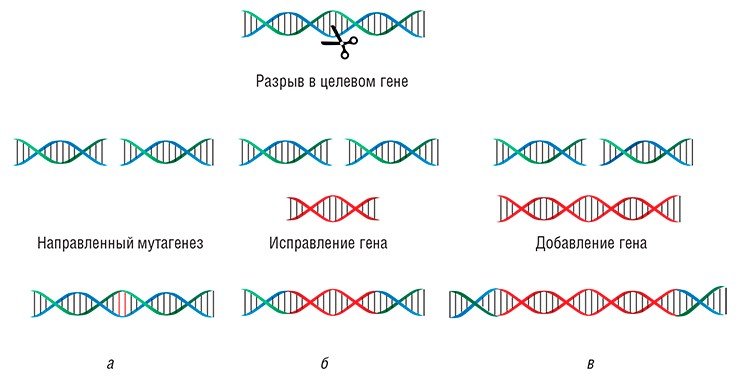
Однако молекула ДНК очень чувствительна к разрывам. Если это случается, клетка запускает процесс починки ДНК. Он может идти двумя путями:
Не гомологичный вариант — когда место разрыва устраняется с дефектами. В результате в ДНК может появиться маленькая вставка или произойти потеря фрагмента. Генетический код — это типлеты, то есть три нуклеотида кодируют одну аминокислоту. Если вы вырезали два или вставили четыре нуклеотида, нарушится последовательность, кодирующая белок. Возникнет сдвиг рамки считывания, в результате которого ген фактически перестанет выполнять свою функцию, так как клетка не сможет использовать его информацию, чтобы синтезировать функциональный белок.
Сломать ген можно было и раньше, просто это довольно трудоемко: надо облучать гены радиацией, месяцами искать мутации. Благодаря CRISPR процесс стал гораздо проще.
Гомологичная рекомбинация. У всех животных в клетках как минимум две копии каждой хромосомы. Если возникает разрыв, клетка может использовать вторую хромосому и на ее основании достроить поврежденный участок — скопировать его в поврежденную хромосому. В этой ситуации клетку можно обмануть и подсунуть ей вместо второй хромосомы похожий фрагмент ДНК, но с мутацией. Тогда клетка починит разрыв, встроив в него то, что мы подсунули, — так называемую матрицу.
За счет прицельно вносимого разрыва, который делает CRISPR, появилась возможность очень просто и эффективно заменять фрагменты в геноме — вносить строго определенные мутации и чинить сломанные гены. Но есть проблема: репарация чаще всего проходит по не гомологичному пути. Существуют разные методы, позволяющие сдвинуть процесс в сторону гомологичной репликации, но пока они работают не очень хорошо.
Левая ветвь — не гомологичный вариант замены, приводящий к разрушению гена, правая — успешная починка подходящим фрагментом
Технологии редактирования генома существовали и ранее. Но они требовали сборки так называемых кастомных белков — под заказ. Для каждой операции нужно было собирать новый белок. Это занимало несколько недель и даже месяцев. Стоил каждый такой белок несколько тысяч евро. А CRISPR-реагенты стоят 10‒20 евро — в сотни раз меньше. Стало возможным проводить эксперименты гораздо быстрее и в огромных масштабах. Если вам в воскресенье пришла хорошая идея, то через неделю у вас уже будет клеточная линия с готовой мутацией, — и идею можно будет проверить.
Естественно, это подтолкнуло развитие биотехнологий и промышленности. Появились тысячи компаний, которые пытаются коммерциализировать CRISPR. Параллельно идет патентная война между MIT и Университетом Беркли, где работает Дженнифер Даудна.
Применение CRISPR-Cas9
Что можно сделать с помощью CRISPR? Можно сломать, починить, заменить практически любой ген в геноме. Факт: биологи любят ломать гены, чтобы выяснить, как они работают.
Можно сделать хромосомную перестройку. Это очень важно в онкологии, где ряд заболеваний вызывают хромосомные перестройки.
На следующем этапе технологию улучшили, лишив Cas-нуклеазу активности — сделали ее не режущей. Одновременно «пристегнули» к ней другие ферменты. В итоге она просто садится на строго определенный фрагмент ДНК и может его редактировать, не вызывая повреждений. Например, менять азотистые основания без внесения разрывов в ДНК, что очень важно для биомедицинских задач.
Ученые уже научились активировать или репрессировать работу гена — редактировать эпигеном. Известно, что некоторые гены в организме метилированные, кроме того, существуют специальные белки — гистоны, которые связаны с ДНК. Все это определяет, как ведет себя клетка. CRISPR позволяет влиять и на это.
Редактируем коров, собак и помидоры
Для чего еще используется подобное редактирование? Например, пятна у породы коров сделали из черно-белых серо-белыми. Считается, что так они лучше переносят жару.
Собакам породы бигль добавили мышц. Практический смысл этой, несомненно, большой работы мне неясен. Но работу выполняли китайцы. Возможно, у них свое представление о прекрасном.
Человеческих органов для пересадки всегда не хватает, поэтому пересаживают органы свиней. Но тут есть проблема: у них в геноме присутствует много спящих ретровирусов, которые после пересадки могут активироваться и угрожать здоровью пациента. У свинок на фото эти фрагменты в геноме инактивировали.
Еще пример: с помощью CRISPR отредактировали количество ветвлений на томатной ветке. А также размеры плодов. Все это на фото выше.
Отредактированных растений уже очень много. О масштабах можно судить по количеству публикаций в научных журналах.
Теперь вы знаете, откуда на Aliexpress семена синей клубники, черных помидоров и арбузов размером со сливу
Но в магазинах (по крайней мере в Европе) CRISPR-модифицированных продуктов нет. Это связано исключительно с осторожностью регулятора, на мой взгляд, излишней.
Раньше генетически модифицированные продукты в Европе запрещали, потому что не знали, что произойдет, если эти модифицированные растения попадут в дикую природу. Может быть, если генно-модифицированная кукуруза «ворвется» в леса, там вымрут все березы. Также не знали, как они повлияют на здоровье человека в долгосрочной перспективе, потому что при модификации использовали генетические элементы из других организмов.
CRISPR позволяет вносить мутации, не оставляя следов, поскольку внедряемые РНК и белок в клетке деградируют. От них ничего не остается, сохраняется только сама мутация. Фактически CRISPR делает то же самое, что происходит при селекции. Несмотря на это, суперосторожные регуляторы решили, что разрешать CRISPR пока не стоит.
Например, вывести засухоустойчивые или более продуктивные сорта растений, которые позволят использовать меньше пахотных земель, не применять пестициды или удобрения.
CRISPR в биомедицине
Самый волнующий вопрос — применение CRISPR в биомедицинских исследованиях для улучшения жизни больных людей (а может, и здоровых — в перспективе). Главная сложность тут — в доставке «генетических ножниц» в клетки человека. Допустим, нам нужно починить неработающий ген, который вызывает болезнь. Но чинить его надо в целом органе или даже во всем теле.
К примеру, мутацию, вызывающую диабет, надо чинить во всей поджелудочной железе. Это непросто, потому что клетки прекрасно себя защищают от вторжения чужеродной ДНК. Поэтому исследователи начали с тех вещей, которые можно из человека вынуть, отредактировать в пробирке, затем размножить и вернуть обратно, — с костного мозга и крови.
Здесь показано, как с помощью CRISPR лечат бета-талассемию и серповидноклеточную анемию.
Эти болезни вызваны двумя разными мутациями в гене бета-гемоглобина.
Больным бета-талассемией нужны частые переливания крови. У больных серповидноклеточной анемией эритроциты забивают сосуды. Качество жизни у них низкое, и есть риск ранней смерти.
Что в такой ситуации позволяет сделать CRISPR? У человека есть третий ген гемоглобина — фетальный гемоглобин, который активен только у эмбрионов до рождения. После рождения он выключается, работают взрослые альфа- и бета-гемоглобины. CRISPR позволяет включить ген фетального гемоглобина — выключив ген, который его контролирует.
У двух больных женщин забрали клетки костного мозга и при помощи вируса внедрили в них CRISPR-конструкцию, которая инактивировала ген BCL11A. В этих клетках заработал фетальный гемоглобин. Правильно отредактированные, отселектированные и размноженные клетки вернули пациентам обратно — пересадили им их же костный мозг. После этого пациентке с бета-талассемией, которой нужно было в среднем 16 переливаний крови в год, в течение года не понадобилось ни одной процедуры. То же произошло и с больной серповидноклеточной анемией — их реально вылечили.
Эти работы перешли на следующую стадию клинических испытаний — в ближайшее время этот метод может войти в повсеместную практику.
Следующее направление работы — терапия ВИЧ. Есть люди, которые не заражаются вирусом иммунодефицита человека за счет мутации в гене CCR5 — делеции в 32 нуклеотида. Если у человека обе копии гена мутированы, вирус просто не может проникнуть в их клетки.
У части пациентов на фоне ВИЧ развивается лимфобластный лейкоз (рак крови). Если другие методы терапии не помогают, больным лимфобластным лейкозом часто пересаживают костный мозг. В этом случае взяли костный мозг у донора, который подходил для лечения лейкемии.
Перед пересадкой клетки отредактировали с помощью CRISPR, выключив в них ген CCR5, — повторили мутацию, которая существует в природе. Пересадка вылечила пациента и от лейкоза, и от ВИЧ.
На мой взгляд, это одна из самых ярких демонстраций возможностей CRISPR.
CRISPR и этика
Говоря о ВИЧ, нельзя не вспомнить о самом нашумевшем случае использования CRISPR. Это история 2018 года. Виновник событий — Цзянькуй Хэ, китайский ученый, который провел эксперимент с редактированием человеческих эмбрионов.
За редактирование ДНК человека Цзянькуй Хэ получил три года тюрьмы
Он занимается ЭКО. Получив эмбрионы от пар, где отцы были инфицированы ВИЧ, он попытался с помощью CRISPR выключить в них ген CCR5. В результате эксперимента родилось трое внешне здоровых детей.
Однако произошло лишь частичное редактирование. У одной девочки первая копия гена получилась с 15-нуклеотидной делецией, чего оказалось недостаточно, чтобы ген перестал функционировать. А вторая копия гена — без изменений. В итоге никакой защиты девочка не получила. Со второй девочкой получилось лучше, но ген все равно остался частично функциональным.
Проблема этого эксперимента — в нарушении этических норм и законов. Как выяснилось, Цзянькуй Хэ фальсифицировал разрешение этической комиссии, которая не одобрила это исследование. Во всех странах у нормальных ученых это означает полный запрет, но он его проигнорировал. Кроме того, эксперимент был плохо подготовлен, исследователь не взвесил возможные риски. Редактирование толком не получилось, а последствия этих экспериментов могут проявить себя позже. CRISPR не обладает стопроцентной точностью, он может вносить мутации где-то еще в геноме. И где он их внесет, предсказать сложно.
Если бы все дети с ВИЧ умирали, это меняло бы дело. Но с современными препаратами ВИЧ-инфицированные матери рожают ВИЧ-негативных детей более чем в 90% случаев. Поэтому эксперимент был еще и бессмысленный.
Ни один ученый в мире не сомневался, что технически метод CRISPR позволяет редактировать эмбрионы, то есть научной новизны в этом эксперименте тоже не было. Но это надо было делать с соблюдением всех норм и другим уровнем подготовки. А главное, технология еще недостаточно созрела, чтобы со стопроцентной гарантией отредактировать только нужное место в геноме и ничего не сломать в остальных.
Гражданин Хэ подорвал веру в ученых, получив вал критики, почти полмиллиона долларов штрафа и три года лишения свободы.
Я думаю, до широкой практики редактирования человеческих эмбрионов нам далеко. Но, безусловно, когда-то мы к этому придем, и при помощи CRISPR будут лечить тяжелые наследственные заболевания.
Кому сейчас доступен CRISPR
Поработать с CRISPR могут «не только лишь все»©. В интернете за небольшие деньги можно купить набор, где есть все необходимое.
Некоторые экспериментируют прямо на собственной кухне
Если у вас есть мало-мальски оборудованная лаборатория для простейших молекулярно-биологических экспериментов, начать работать с CRISPR будет легко. И это действительно фантастический инструмент, который невероятно ускорил прогресс биомедицинской науки.
Вся эта история учит нас тому, что даже ковыряясь — буквально — в грязи, можно сделать невероятные открытия. Ну и еще тому, что наука интернациональна.
Нет никакой российской науки, немецкой науки, есть интернациональная наука.
Та же Эммануэль Шарпантье работала сначала в Нью-Йорке, потом в Мемфисе, в Вене, в Швеции, в Ганновере, а прямо сейчас работает в Берлине. Поэтому задача ученого — знать хотя бы один международный язык и пытаться развивать собственную мобильность — двигаться, искать связи и сотрудников, новых коллег. Шарпантье и Даудна встретились на конференции, заинтересовались общей проблемой и в итоге получили Нобелевскую премию. Кто знает, как бы сложилась история CRISPR, не будь этой встречи.
«Редакторы геномов». От «цинковых пальцев» до CRISPR
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений
Но чтобы успешно вторгаться в «святая святых» клетки – ее наследственный материал, необходимы технологии, позволяющие расщеплять и соединять молекулы ДНК в заданных участках. Поистине революционный прорыв в этой области произошел всего несколько лет назад, когда на основе механизмов «бактериального иммунитета» был разработан простой метод генетической инженерии CRISPR/Cas, обеспечивающий точное воздействие на заданные участки ДНК. Этот метод открыл принципиально новые возможности для манипуляций на уровне генома высших организмов, позволяя вносить точечные мутации, исправлять, встраивать или удалять фрагменты и даже целые гены.
Чтобы успешно вторгаться в «святая святых» клетки – ее наследственный материал, необходимы технологии, позволяющие расщеплять и соединять молекулы ДНК в заданных участках.
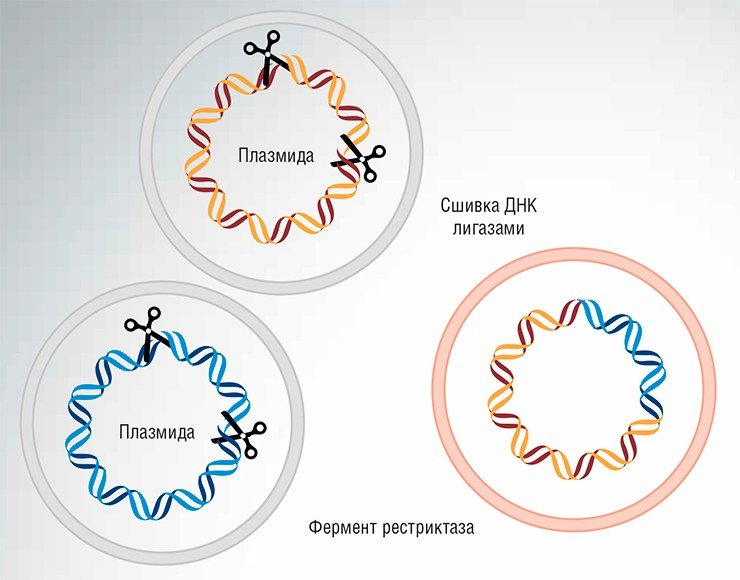
Для этих целей можно использовать рестриктазы – ферменты, способные узнавать определенные короткие нуклеотидные последовательности и расщеплять по ним молекулу ДНК. Для соединения нуклеотидных фрагментов используют ферменты ДНК-лигазы, которые входят в состав природных ферментных комплексов, исправляющих (репарирующих) повреждения в структуре ДНК. «Сшивку» ДНК можно осуществлять также ферментными комплексами системы рекомбинации, благодаря которой происходит обмен гомологичных фрагментов в составе геномных ДНК в процессе образования половых клеток.
Открытие ферментов рестрикции и ДНК-лигаз в 1960—1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
Однако с помощью такого набора инструментов оказалось крайне трудно манипулировать большими сложными геномами высших организмов. Проблема заключалась в том, что ферменты рестрикции могут «узнавать» только относительно короткие последовательности ДНК. Такой специфичности вполне достаточно для работы с короткими ДНК вирусов и бактерий, поскольку в пределах той же бактериальной ДНК конкретные короткие нуклеотидные последовательности встречаются не слишком часто. Поэтому практически всегда можно подобрать рестриктазу, которая расщепит бактериальную ДНК на достаточно небольшой набор фрагментов, из которых можно затем выбрать нужные. Если повезет, то можно будет даже подобрать фермент, который расщепит ДНК в одном, точно определенном месте.
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
Сначала были химеры
Первые попытки создания методов редактирования сложных геномов связаны с конструированием «искусственных ферментов» в виде олигонуклеотидов (коротких нуклеотидных последовательностей), которые могли бы избирательно связываться с определенными последовательностями в структуре целевой ДНК и несли бы на себе химические группы, способные расщеплять ДНК (Кнорре, Власов, 1985). Однако до сих пор эффективных методов расщепления ДНК на такой основе создать не удалось.
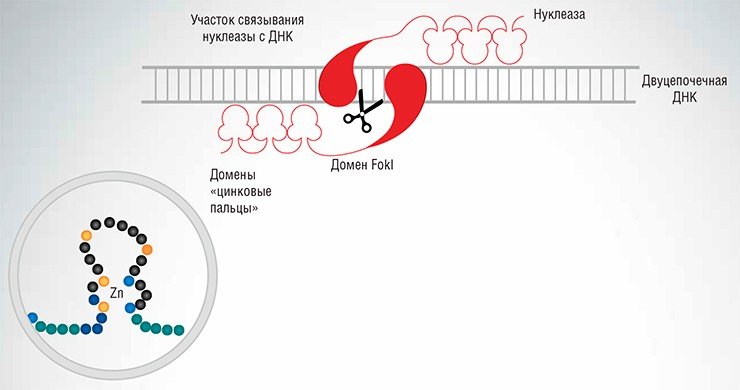
Реально работающим подходом оказалось конструирование химерных нуклеаз – сложных белков, содержащих две структурные единицы, одна из которых катализирует расщепление ДНК, а вторая способна избирательно связываться с определенными нуклеотидными последовательностями в составе целевой молекулы, направляя на этот участок действие нуклеазы. Подобные химерные нуклеазы можно «производить» непосредственно в клетке: для этого в нее вносят соответствующие генно-инженерные конструкции (векторы), кодирующие нуклеазы. Такие векторы снабжаются сигналом ядерной локализации – белковой структурой, обеспечивающей поступление конструкции в ядро клетки к геномной ДНК.
Первыми среди химерных нуклеаз стали zinc-finger нуклеазы, в состав которых в качестве адресующих структур входят так называемые «цинковые пальцы». Последние представляют собой белковые домены (достаточно стабильные и независимые элементы третичной структуры белка), содержащие молекулу цинка и по форме действительно напоминающие палец (Kim et al., 1996). Каждый «цинковый палец» способен «узнать» и специфично связаться с определенной последовательностью ДНК из трех нуклеотидов.
Нужно сказать, что домены «цинковые пальцы» встречаются в составе человеческих факторов транскрипции – белков, регулирующих процесс синтеза РНК с матрицей ДНК. При создании искусственных нуклеаз можно сконструировать цепочку из «цинковых пальцев» так, что она будет узнавать определенный участок ДНК. Если такая цепочка будет достаточно длинной, она может распознавать относительно протяженные последовательности ДНК, состоящие из ряда тринуклеотидных фрагментов. Это означает реальную возможность точечного воздействия на заданные участки в составе больших сложных геномов.
Однако у метода «цинковых пальцев» обнаружились и серьезные недостатки: во-первых, это не вполне строгое распознавание тринуклеотидных повторов, что приводит к заметному числу расщеплений ДНК в «нецелевых» участках. Во-вторых, метод оказался весьма трудозатратным и дорогостоящим, поскольку для каждой последовательности ДНК необходимо создать свою оптимизированную белковую структуру zinc-finger нуклеазы. Поэтому система «цинковые пальцы» широкого распространения не получила.
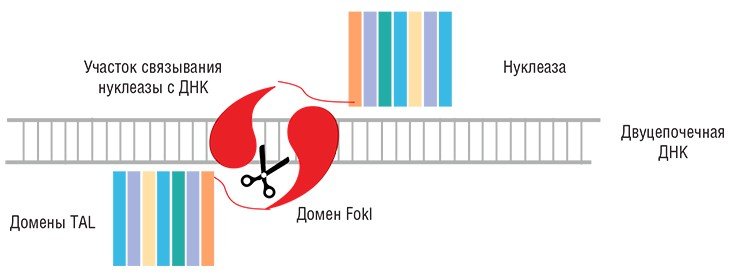
Более перспективным средством избирательного воздействия на ДНК оказались конструкции на основе химерных нуклеаз, названные TALENs (от Transcription Activator-like Effector Nucleases) (Sanjana et al., 2012). Роль ДНК-распознающих структур в них играют белковые домены, каждый из которых «узнает» только один нуклеотид. Природным прототипом таких доменов явились белки (TAL-effectors) некоторых бактерий, паразитирующих в клетках сельскохозяйственных растений. Эти бактериальные белки, попадая в ядро растительной клетки, имитируют транскрипционные факторы и связываются с определенными участками ДНК, активируя таким образом гены, необходимые для выживания паразита.
Поскольку механизм «узнавания» ДНК в данном случае однозначен и прост (один нуклеотид распознается одним белковым доменом), то получение конструкции, специфично распознающей нужную исследователю нуклеотидную последовательность, – относительно простая задача. Соединяя такую направляющую конструкцию с ферментом, расщепляющим ДНК (как правило, для этих целей используется FokI – каталитический домен фермента рестрикции), мы получаем систему с высокой специфичностью действия.
Здесь нужно отметить, что для успешного разрезания молекулы ДНК с помощью FokI необходимо две субъединицы этого фермента. Поэтому все химерные нуклеазы, в составе которых имеется FokI, работают парами: каждая из них узнает свой специфический участок на разных цепочках молекулы ДНК. Эти целевые сайты выбираются так, чтобы они находились на небольшом (10—20 нуклеотидов) расстоянии, достаточном для димеризации доменов FokI, в результате которой формируется каталитически активная структура. Поскольку каждый из блоков такой бинарной нуклеазы связывается с ДНК независимо, точность расщепления ДНК повышается, а воздействие на «нецелевые» последовательности минимизируется.
Бактериальное ноу-хау
С помощью искусственных нуклеаз TALENs оказалось теоретически возможным внести двунитевой разрыв в любой участок генома. В 2011 г. методы геномной инженерии, в первую очередь использование TALENs, были названы авторитетным журналом «Nature Methods» «методом года» благодаря колоссальному спектру возможных применений в самых разных областях фундаментальной и прикладной науки, от функциональной геномики и биологии развития до сельскохозяйственной биотехнологии.
Однако в 2012—2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
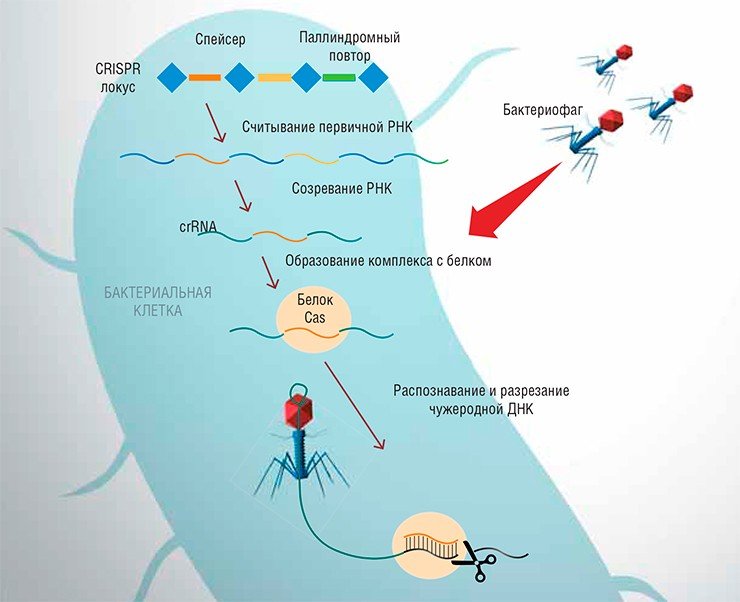
В отличие от химерных нуклеаз, в CRISPR/Cas структурами, узнающими ДНК, являются не белки, а короткие РНК. Идея создания такой системы родилась при изучении механизмов, которые бактерии используют для защиты от своих патогенных вирусов (бактериофагов). Конкретно речь идет о своеобразных «иммунных» реакциях бактерий на проникновение определенного бактериофага, которая выражается в избирательном расщеплении его геномной ДНК.
Работа этого механизма обеспечивается специальными участками бактериального генома – CRISPR локусами (от Clustered Regularly Interspaced Short Palindromic Repeats – короткие палиндромные повторы, регулярно расположенные группами). Как видно по названию, этот локус состоит из стандартных повторенных некодирующих последовательностей бактериальной ДНК, а разделяют эти повторы спейсеры – короткие фрагменты чужеродной (вирусной или плазмидной) ДНК. Последние встраиваются в бактериальный геном после того, как ДНК бактериофага, попавшего в клетку бактерии, рекомбинирует с ее геномом. Состав и порядок расположения спейсеров указывает на число «атак» различных вирусов, успешно пережитых самой бактериальной клеткой и (или) ее родительскими поколениями.
Как это работает? При повторном проникновении в бактериальную клетку уже «известного» ей вируса происходит синтез протяженной первичной РНК, закодированной в CRISPR-локусе. В результате «созревания» этой первичной ДНК образуется ряд коротких фрагментов (crRNA), каждый из которых состоит из специфического участка, соответствующего спейсеру, и универсальных участков, соответствующих палиндромным повторам бактериальной ДНК. Бактериальная ДНК отвечает за привлечение уже упоминавшихся Cas-белков, а спейсер играет роль наводчика: он связывается с определенным, комплементарным ему участком вирусной ДНК, после чего белки Cas разрезают ее, обеспечивая уничтожение бактериофага. Благодаря своей высокой специфичности и способности к быстрой «настройке» система CRISPR/Cas работает очень эффективно, обеспечивая бактерии и ее потомству надежную защиту от патогенов.
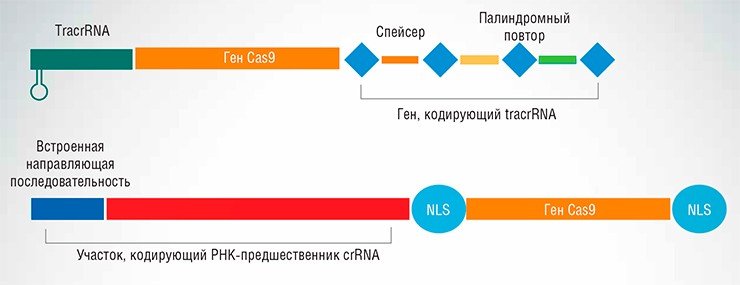
К настоящему времени детально описаны несколько типов защитных систем CRISPR, функционирующих в клетках различных бактерий. Наиболее «популярной» оказалась система CRISPR/Cas типа II-А, обнаруженная у бактерии Streptococcus pyogenes, которая состоит из трех генов, кодирующих crRNA, трансактивирующую РНК (tracrRNA) и белок Cas9. На основе этой системы и были созданы универсальные генетические конструкции, кодирующие элементы искусственного «редактора генома» CRISPR/Cas.
Был создан и упрощенный вариант системы, функционирующей в виде комплекса из белка Cas9 и единой направляющей РНК, состоящей из трансактивирующей CRISPR РНК и короткой «зрелой» crRNA. Направляющая последовательность опознает целевой участок ДНК и комплементарно связывается с ним, а Сas9 – разрезает ДНК в нужном месте.
С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Система CRISPR может быть использована для получения как генетически модифицированных клеток, выращиваемых в культуре, так и живых организмов. В первом случае в клетки вводят плазмиды или вирусные векторы, которые обеспечивают высокий и устойчивый синтез элементов системы CRISPR/Cas. Во втором случае в одноклеточные эмбрионы животных путем микроинъекции вводят уже «готовые» crRNA и мРНК, с которой происходит синтез белка Cas9. Для получения генетически модифицированных растений, клетки которых имеют прочную оболочку, используют выращиваемые в культуре протопласты (растительные клетки без внешней оболочки) и плазмиды, кодирующие элементы CRISPR/Cas. Другой подход, применяемый для растений, – использование агробактерий, природных «генных инженеров», несущих специальную плазмиду.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
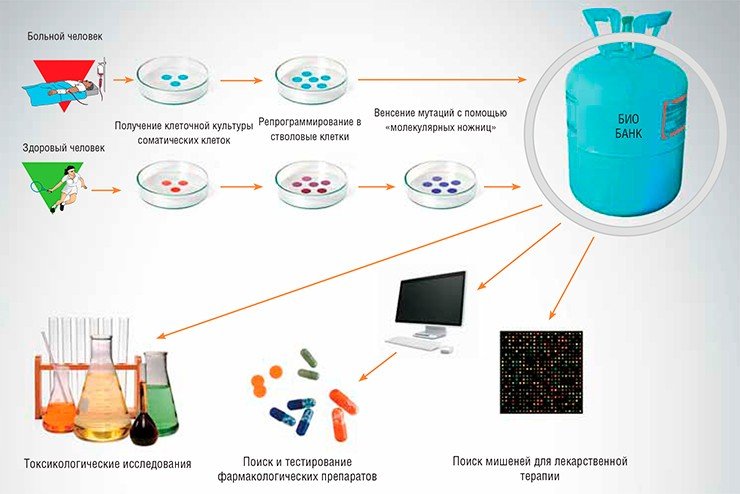
Одной из важнейших задач современной биомедицины является создание клеточных моделей для поиска и доклинического исследования новых лекарств. Внося направленные модификации в геном стволовых клеток человека, мы получаем линии клеток-моделей наследственных заболеваний, вызванных нарушениями функций определенных генов. Такие клеточные линии являются, по сути, неограниченным источником «пациентов в пробирке», на которых можно проводить тестирование десятков тысяч различных химических соединений – потенциальных лекарств.
Большие надежды на CRISPR/Cas возлагаются и в связи с развитием генотерапии. Несмотря на многолетние широкие исследования, до настоящего времени не удалось разработать приемлемых методов введения в клетки генов, замещающих дефектные. Главная причина неудач – применение генетических конструкций, содержащих «лишнюю» ДНК (бактериальную или вирусную), к тому же встраивались они неуправляемо, в произвольные участки генома. Все это приводило к различным нарушениям работы генетического аппарата, в том числе к злокачественному перерождению клеток. Однако CRISPR/Cas позволяет вводить гены в геном с хирургической точностью, что делает генотерапию безопасной.
Более того, с помощью этого метода можно не вводить извне «чужие», но редактировать собственный генетический аппарат, сохраняя «свои» системы регуляции. Так уже удалось отредактировать аномальный ген в стволовых клетках пациента, страдающего муковисцидозом (Schwank et al., 2013). Такие клетки с «отремонтированным» геномом могут быть трансплантированы обратно в организм больного, где они заменят больные клетки и восполнят утраченную ими функцию.
К важнейшим задачам современной биотехнологии и биомедицины, нуждающихся в развитии технологий редактирования геномов, относятся:
• создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
• получение мутантных модельных животных для исследования заболеваний человека;
• разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
• создание клеточных моделей для поиска и доклинического исследования новых лекарств
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Современные средства терапии, к сожалению, не способны воздействовать на вирусную ДНК, находящуюся в составе человеческой ДНК. Системы, функционирующие по механизму CRISPR, возможно, позволят в будущем радикально излечивать подобные хронические заболевания, вызываемые вирусами, встраивающимися в геном человека (вирусами гепатита В, герпеса, ВИЧ и др.). Так, известен случай излечения от СПИДа так называемого «берлинского пациента» Т. Брауна в результате пересадки ему стволовых клеток крови от донора, несущего мутацию «невосприимчивости» к ВИЧ. С помощью технологии CRISPR/Cas возможно внести мутацию в этот ген в клетках, которые могут быть затем трансплантированы в организм зараженного.
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека – весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Компоненты системы в виде готовых наборов производятся компанией «Life Technologies», недавно слившейся с компанией «Thermo Fisher» (США), и доступны для исследователей. Крупнейшие фармацевтические фирмы, такие как «Takeda», формируют с помощью технологии CRISPR банки генетически модифицированных стволовых клеток – клеточных моделей заболеваний.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности – приоритетных направлений развития научно-технического потенциала страны.
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека – клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.
Клеточные линии и культуры будут храниться в жидком азоте, – в таком состоянии они могут оставаться жизнеспособными в течение десятилетий и использоваться по мере необходимости. Все хранящиеся в биобанке клеточные культуры и линии будут детально охарактеризованы: для каждой будет составлен «паспорт», содержащий сведения о ее происхождении и характеристиках. Такие клеточные линии могут быть предоставлены в распоряжение как академических институтов для проведения фундаментальных исследований по изучению механизмов развития болезней, так и частным компаниям, занимающимся поиском, разработкой, производством и тестированием новых лекарств.
Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // НАУКА из первых рук. 2014. № 1 (55). С. 38—50.
Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. T. 54, № 9. С.1420—1447.
Медведев С. П. Как отредактировать наследственность // НАУКА из первых рук. 2014, № 1 (55). С. 10—14.
Сong L., Ran F.A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339.
Kim Y.G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A 93, 1156—1160.
Moghaddassi S., Eyestone W., Bishop C.E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin. PLoS One 9, e89631.
Schwank, G., Koo, B.K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13, 653—658.
Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell 13, 659—662.