Что такое генетическая терапия
Что такое генетическая терапия
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
Генная терапия — метод лечения заболеваний, основанный на переносе в клетки организма определённых генов. Основная проблема генной терапии — разработка эффективного и безопасного способа переноса необходимых генов в дефектные клетки организма. В качестве «средств доставки» генов используют различные векторы, наиболее часто — различные вирусы (см. ниже). В настоящее время разработки генной терапии касаются только соматических клеток.
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
В 1992 г. в США осуществили введение в клетки печени человека гена белка-рецептора, адсорбирующего липопротеины низкой плотности в гепатоциты женщины, страдающей выраженным атеросклерозом (патология была связана с дефицитом липопротеинов вследствие генных нарушений). Посредством трансфекции ген был введён в гомогенизированные клетки печени, которые затем переносили в печень пациентки. После такой процедуры состояние женщины улучшилось, хотя до пересадки «генно-инженерной печени» она перенесла инфаркт (в 16 лет) и операцию на сердце (в 26 лет).
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Генная терапия против рака
иллюстрация автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Благодаря стремительному развитию медицины создаются инновационные техники, лекарства, оборудование, направленные на лечение сложных заболеваний, таких как рак. В последнее время большое внимание уделяется генной терапии как перспективному методу лечения онкозаболеваний, который в будущем станет особо важным инструментом для предотвращения и снижения смертности от рака. В данной статье кратко рассматриваются пути развития болезни, а также применение инновационных техник генной терапии в онкологии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Благодаря Гиппократу и его наблюдательности (именно он увидел сходство опухоли и щупалец рака) в древних врачебных трактатах появился термин «карцинома» (грец. carcinos), или «рак» (лат. cancer). В медицинской практике по-разному классифицируют злокачественные новообразования: карциномы (из эпителиальных тканей), саркомы (из соединительной, мышечной тканей), лейкемия (в крови и костном мозге), лимфомы (в лимфатической системе) и другие (развиваются в других типах клеток, например, глиома — рак головного мозга). Но в быту более популярен термин «рак», который подразумевает любую злокачественную опухоль.
Мутации: погибнуть или жить вечно?
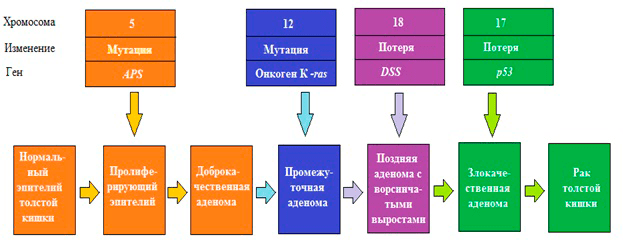
Многочисленные генетические исследования выявили, что возникновение раковых клеток — это результат генетических изменений. Ошибки в репликации (копировании) и репарации (исправлении ошибок) ДНК приводят к изменению генов, в том числе и контролирующих деление клетки. Основными факторами, которые способствуют повреждению генома, а в дальнейшем — приобретению мутаций, — являются эндогенные (атака свободных радикалов, образующихся в процессе обмена веществ, химическая нестабильность некоторых оснований ДНК) и экзогенные (ионизирующее и УФ-излучение, химические канцерогены). Когда мутации закрепляются в геноме, они способствуют трансформации нормальных клеток в раковые. Такие мутации в основном случаются в протоонкогенах, которые в норме стимулируют деление клетки. В результате может получиться постоянно «включенный» ген, и митоз (деление) не прекращается, что, фактически, означает злокачественное перерождение. Если же инактивирующие мутации происходят в генах, которые в норме ингибируют пролиферацию (гены-супрессоры опухолей), контроль над делением утрачивается, и клетка становится «бессмертной» (рис. 1).
Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].
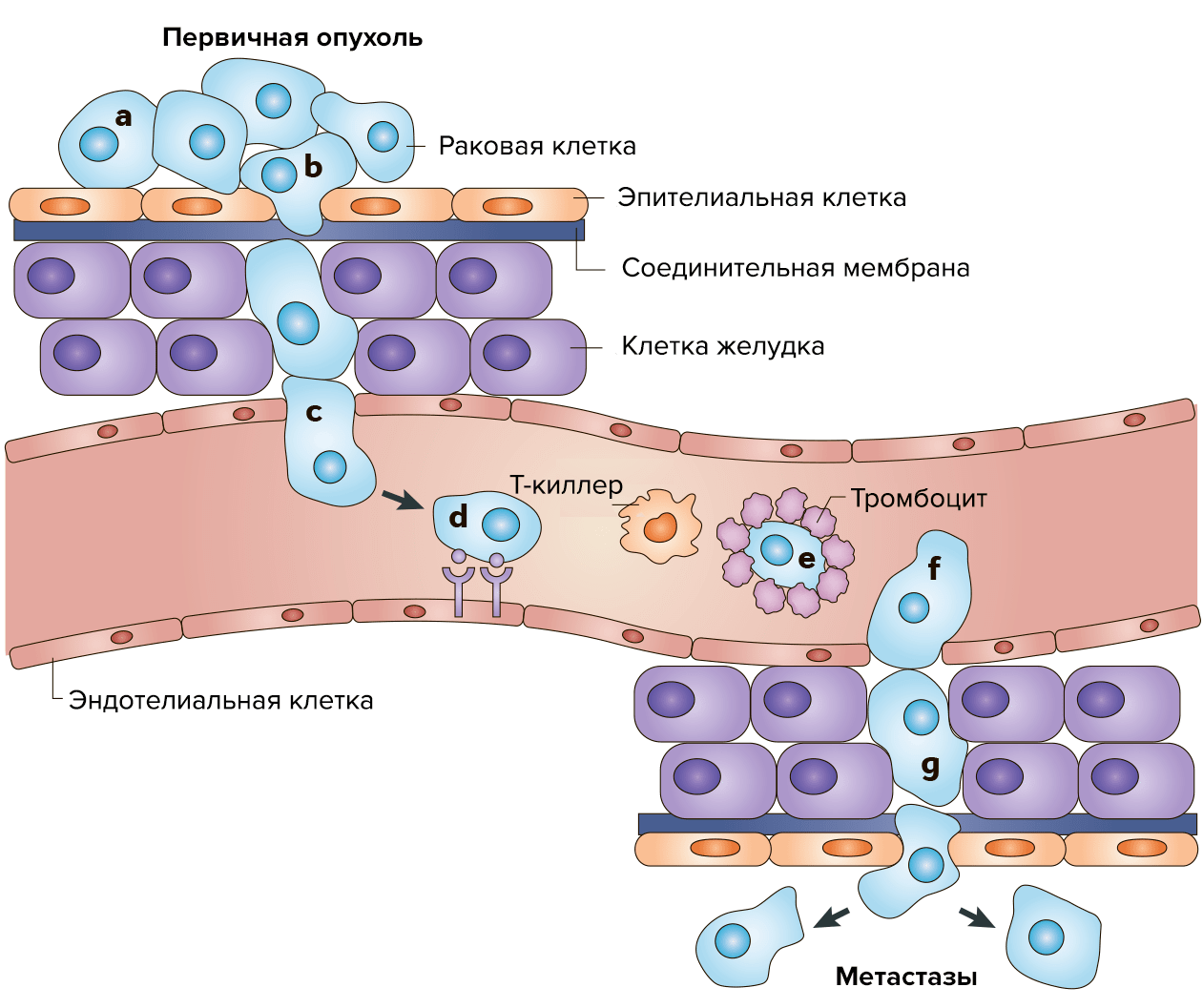
Результатом сбоя работы генов становится неконтролируемое деление клеток, а на последующих стадиях — метастазирование в различные органы и части тела по кровеносным и лимфатическим сосудам. Это достаточно сложный и активный процесс, который состоит из нескольких этапов. Отдельные раковые клетки отделяются от первичного очага и разносятся с кровью по организму. Затем с помощью специальных рецепторов они прикрепляются к эндотелиальным клеткам и экспрессируют протеиназы, которые расщепляют белки матрикса и образуют поры в базальной мембране. Разрушив внеклеточный матрикс, раковые клетки мигрируют вглубь здоровой ткани. За счет аутокринной стимуляции они делятся, образуя узел (1–2 мм в диаметре). При недостатке питания часть клеток в узле погибает, и такие «дремлющие» микрометастазы могут достаточно долго оставаться в тканях органа в латентном состоянии. В благоприятных условиях узел разрастается, в клетках активируются ген фактора роста эндотелия сосудов (VEGF) и фактора роста фибробластов (FGFb), а также инициируются ангиогенез (формирование кровеносных сосудов) (рис. 2).
Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
Традиционные методы и их недостатки
Если системы защиты организма не справились, и опухоль все-таки начала развиваться, спасти может только вмешательство медиков. На протяжении длительного периода врачами используются три основные «классические» терапии:
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
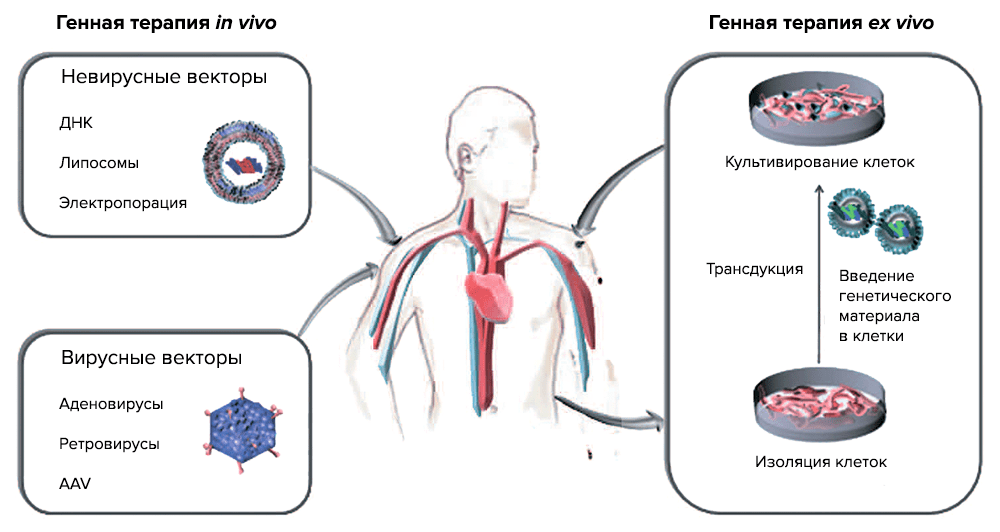
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).
Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые клетки или в ткани, которые окружают опухоль [9]. Генная терапия ex vivo состоит из выделения раковых клеток из пациента, встраивания терапевтического «здорового» гена в раковый геном и введения трансдуцированных клеток обратно в организм пациента. Для таких целей используются специальные векторы, созданные методами генной инженерии. Как правило, это вирусы, которые выявляют и уничтожают раковые клетки, при этом оставаясь безвредными для здоровых тканей организма, или невирусные векторы.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Для переноса трансгенных ДНК также применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц — используются для доставки препаратов с низкой молекулярной массой, например, олигонуклеотидов, пептидов, миРНК. Благодаря небольшим размерам, наночастицы поглощаются клетками и могут проникать в капилляры, что очень удобно для доставки «лечебных» молекул в самые труднодоступные места в организме. Данная техника часто используется для ингибирования ангиогенеза опухоли. Но существует риск накопления частиц в других органах, например, костном мозге, что может привести к непредсказуемым последствиям [11]. Самыми популярными невирусными методами доставки ДНК являются липосомы и электропорация.
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Базируется на введении в опухолевую ткань «суицидных» генов, в результате работы которых раковые клетки погибают. Данные трансгены кодируют ферменты, активирующие внутриклеточные цитостатики, ФНО-рецепторы и другие важные компоненты для активации апоптоза. Суицидная комбинация генов пролекарства в идеале должна соответствовать следующим требованиям [17]: контролируемая экспрессия гена; правильное превращение выбранного пролекарства в активное противораковое средство; полная активация пролекарства без дополнительных эндогенных ферментов.
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Широкое разнообразие вирусных и невирусных векторов для трансгенов позволяет экспериментировать над различными типами иммунных клеток (например, цитотоксическими Т-клетками и дендритными клетками) для ингибирования иммунного ответа и регрессии раковых клеток. В 1990-х годах было высказано предположение, что опухолевые инфильтрирующие лимфоциты (TIL) являются источником цитотоксических Т-лимфоцитов (CTL) и естественных киллеров (NK) для раковых клеток [19]. Так как TIL можно легко манипулировать ex vivo, они стали первыми генетически модифицированными иммунными клетками, которые были применены для противораковой иммунотерапии [20]. В Т-клетках, изъятых из крови онкобольного, изменяют гены, которые отвечают за экспрессию рецепторов для раковых антигенов. Также можно добавлять гены для большей выживаемости и эффективного проникновения модифицированных Т-клеток в опухоль. С помощью таких манипуляций создаются высокоактивные «убийцы» раковых клеток [21].
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Мощным инструментом генной терапии является использование стволовых клеток в качестве векторов для передачи терапевтических агентов — иммуностимулирующих цитокинов, «суицидных» генов, наночастиц и антиангиогенных белков [23]. Стволовые клетки (СК), кроме способности к самообновлению и дифференцировке, имеют огромное преимущество по сравнению с другими транспортными системами (нанополимерами, вирусами): активация пролекарства происходит непосредственно в опухолевых тканях, что позволяет избежать системной токсичности (экспрессия трансгенов способствует разрушению только раковых клеток). Дополнительным позитивным качеством является «привилегированное» состояние аутологичных СК — использованные собственных клеток гарантирует 100%-совместимость и повышает уровень безопасности процедуры [24]. Но все же эффективность терапии зависит от правильной ex vivo передачи модифицированного гена в СК и последующего переноса трансдуцированных клеток в организм пациента. Кроме того, прежде чем применять терапию в широких масштабах, нужно детально изучить все возможные пути трансформации СК в раковые клетки и разработать меры безопасности для предупреждения канцерогенного преобразования СК.
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Особенно перспективным методом лечения онкозаболеваний является генная терапия. На данный момент активно проводятся клинические испытания, которые часто подтверждают эффективность ГТ в тех случаях, когда стандартное противораковое лечение — хирургия, лучевая терапия и химиотерапия — не помогает. Развитие инновационных методик ГТ (иммунотерапии, онколитической виротерапии, «суицидной» терапии и др.) сможет решить проблему высокой смертности от рака, и, возможно, в будущем диагноз «рак» не будет звучать приговором.
Видео. Рак: узнать, предупредить и устранить болезнь
Что такое генетическая терапия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Генная терапия — новое направление в медицине
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(2): 64-72
Безбородова О. А., Немцова Е. Р., Якубовская Р. И., Каприн А. Д. Генная терапия — новое направление в медицине. Онкология. Журнал им. П.А. Герцена. 2016;5(2):64-72.
Bezborodova O A, Nemtsova E R, Iakubovskaia R I, Kaprin A D. Gene therapy is a new area in medicine. P.A. Herzen Journal of Oncology. 2016;5(2):64-72.
https://doi.org/10.17116/onkolog20165264-72
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
В обзоре приведены сведения об истории и направлениях развития генной терапии. Обсуждены типы трансгенов, применяемые в лечении различных заболеваний, специфические и конституциональные промоторы, обеспечивающие экспрессию терапевтических трансгенов в клетках-мишенях, способы доставки генных конструкций в целевые клетки и механизмы внедрения генетического материала в ядро клетки. Рассмотрены преимущества и недостатки вирусных и невирусных векторов различных типов. Приведены данные последних лет о клиническом применении официнальных препаратов для генной терапии, зарегистрированных для лечения больных со злокачественными опухолями головы и шеи (Gendicine и Oncorine, Китай), с моногенным заболеванием — дефицитом липопротеиназы (Glybera, Нидерланды) и с ишемией нижних конечностей атеросклеротического генеза (неоваскулген, Россия), а также о клинических испытаниях препаратов для генной терапии в различных областях медицины.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, картирование генов на хромосомах млекопитающих, их идентификация и клонирование, обнаружение мутаций в генах, ассоциированных с наследственными и приобретенными заболеваниями, наряду с бурным ростом в области биотехнологий, клеточных технологий и успехами генной инженерии привели к тому, что в конце прошлого века начался бум в исследованиях по анализу молекулярно-биохимических дефектов, ассоциированных с определенной патологией, который привел к пониманию того, что большинство грозных заболеваний человека сопровождается серьезными изменениями в генетическом аппарате клетки. Особенно выражены и наиболее исследованы эти изменения при злокачественных новообразованиях. Из этих данных следует логичный вывод о том, что наиболее радикальным способом борьбы с заболеваниями, вызываемыми изменениями в генетическом аппарате клеток, должны быть мероприятия, направленные непосредственно на причину заболевания, а не ее последствия.
Генная терапия — это лечение наследственных, мультифакториальных и ненаследственных (инфекционных, злокачественных и др.) заболеваний путем введения генов в соматические клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых свойств.
История развития генной терапии началась в 1972 г., когда в США, в Стэндфордском университете, Стэнли Коэн и Герберт Бойер обнаружили явление прямого переноса фрагментов ДНК от одной бактерии кишечной палочки к другой при непосредственном контакте этих клеток. А уже в 1974 г. в США была учреждена первая в мире биотехнологическая компания «Genetech», где выращивали новые бактериальные культуры с чужими генами.
В 1976 г. в Университете Пенсильвания, США, Уильям Андерсон предложил использование вирусов в качестве носителей ДНК, а в 1990 г. этот исследователь в клинике Университета Пенсильвания ввел больной Ашанти ДеСильва с синдромом комбинированного иммунодефицита (СКИД) генетически модифицированные геном аденозиндезаминазы ее собственные лимфоциты, в последующие 3 года провел 23 внутривенных трансфузии и получил длительную ремиссию, а затем выздоровление.
В то же время метод генной терапии все шире распространялся по миру и к настоящему моменту в мире проведено и проводится более 2210 клинических испытаний по генной терапии. География их широка и разнообразна. Это — Америка (63,9%), Европа (24,1%), Азия (6,0%), Австралия (1,5%), международные (4,2%) [1]. По странам имеется распределение, свидетельствующее о том, что эта технология наиболее развита в США и ряде Европейских стран.
Спектр заболеваний, при которых проводятся клинические испытания по генной терапии, также чрезвычайно широк (табл. 1). Независимо от нозологии, в области соматической генной терапии имеются общие задачи. Это:

— выбор наиболее эффективного для лечения гена;
— разработка способов доставки требуемого гена в нужные клетки;
— изучение и обеспечение эффективных подходов и способов нужной регуляции гена;
— вопросы длительности существования и экспрессии введенного гена;
— обеспечение безопасности больного.
Типы генов, используемых при генной терапии, разнообразны, и их выбор определяется патогенетическими механизмами развития заболевания, идентификацией наиболее болезнетворных генов.
Наиболее простая задача в выборе гена стоит при моногенных наследственных заболеваниях, то есть там, где показано, что определенный дефект в данном гене вызывает патологический процесс. Совершенно другая задача по степени сложности в выборе гена для терапии стоит при многофакториальных заболеваниях, таких как злокачественные новообразования, кардиоваскулярные болезни, при которых в патогенезе заболеваний, во-первых, пока много неясного, во-вторых, задействован ряд генов.
Типы генов, описанные для клинических исследований, варьируют очень широко. Среди них 20,2% относятся к генам антигенов, 16,2% — цитокинов, 9,4% — различных рецепторов, 8,6% — факторов иммунодефицита, 7,4% — к «суицидным» генам, 7,4% — к генам факторов роста, 4,2%— ингибиторов репликации, 2,5% — маркеров, 13,2% — к генам других категорий белков, 2,5% — к неизвестным генам [1].
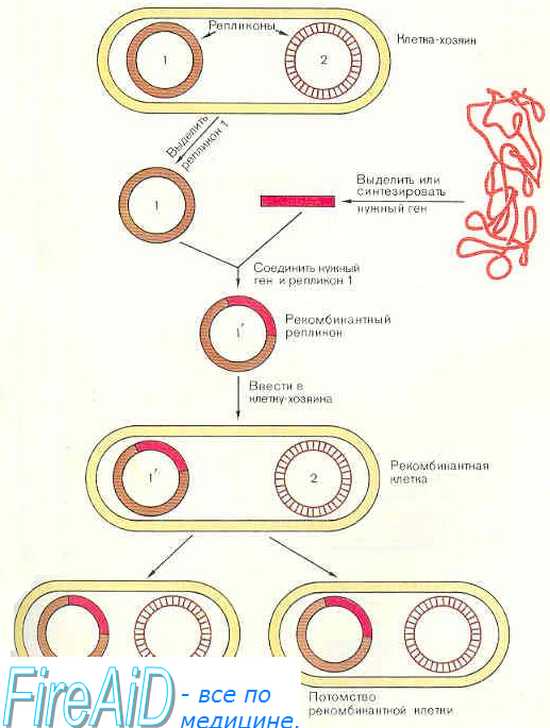
Для эффективной работы выбранный терапевтический ген снабжают сигнальными (регулирующими) элементами, которые необходимы для синтеза полноценной мРНК и целевого белка, а также позволяют управлять специфичностью экспрессии в определенном типе клеток или ткани, длительностью функционирования и нужной регуляцией гена в клетке (рис. 1) [2, 3].

Специфичность экспрессии генов в заданной клетке достигается конструированием векторов, несущих терапевтические гены под контролем промоторов, работающих только в данном типе клеток. К настоящему моменту выявлен ряд тканеспецифичных промоторов, обеспечивающих селективную экспрессию терапевтических трансгенов в клетках определенных органов. В экспериментальной генной терапии сердечно-сосудистых заболеваний в настоящее время используют промоторы, которые обеспечивают преимущественную экспрессию трансгена в миокарде (SM22α-промотор и др.) [4]. Разработан целый ряд тканеспецифичных промоторных систем, в которых использованы гены, высокоэкспрессированные, главным образом, в опухолевых клетках: простатспецифический и простатспецифический мембранный антигены при раке предстательной железы [5], гены, кодирующие сурфактантные белки, А и В, при раке легкого [6, 7], ген мембранно-связанного муцина MUC1/DF3 при раке молочный железы, трахеи, легкого, тонкого или толстого кишечника [8], ген α-фетопротеина — белка, синтезируемого в печени, при раке печени [9], промоторы гена сурвивина человека (hSurv) и гена обратной транскриптазы теломеразы человека (hTERT), обеспечивающих экспрессию трансгена в клетках широкого спектра опухолей [10, 11] (табл. 2).

Поскольку тканеспецифичные промоторы обладают общим недостатком — низким уровнем экспрессии гетерологичных генов, а также ограниченной областью применения, обусловленной их тканеспецифичностью, в настоящее время идет активный поиск промоторов генов человека, не обладающих тканевой специфичностью — универсальных или гибридных промоторов, направленных исключительно на пролиферирующие клетки и не затрагивающих нормальные дифференцированные клетки.
Одной из сложнейших проблем в генной терапии является доставка требуемого гена в нужные ткани при минимизации его контакта с биологическими средами организма до достижения клетки-мишени, а также обеспечение доставки гена в нужную клетку с целью его эффективной и безопасной работы в ней.
В настоящее время генетический материал доставляется в клетку либо в виде «голой» ДНК («naked DNA»)/плазмиды, в том числе в составе наночастиц и липосом, либо с использованием векторов вирусной и невирусной природы, защищающих ДНК от разрушения и имеющих тропность к определенным тканям (рис. 2) [12].

Самым простым способом доставки трансгенов является доставка «голой» ДНК/плазмиды. При этом для целей доставки генетического материала в ядро клетки используется арсенал различных средств. Это может быть физический метод доставки ДНК с применением таких приемов, как прямая инъекция «голой» ДНК, электропорация клеток и доставка ДНК через поры в обработанных мембранах, бомбардировка частицами с ДНК с использованием гидродинамической пушки [13].
На долю «голой» и плазмидной ДНК приходится всего 17,4% протоколов клинических испытаний в области генной терапии, что обусловлено их низкой трансфицирующей способностью. Это обстоятельство является большим ограничением для использования такого генетического материала в разработке метода генной терапии, несмотря на наличие у него ряда неоспоримых преимуществ: отсутствие инфекционности, низкая иммуногенность, высокая технологичность (доступность в получении в высокоочищенном состоянии в больших количествах, стандартность, стабильность при хранении и т. д.).
Альтернативным способом доставки терапевтических генов является использование векторов вирусной, бактериальной и химической природы. Вектор должен эффективно и специфически трансфицировать/трансдуцировать делящиеся и неделящиеся таргетные клетки, экспрессировать трансген в адекватных количествах в течение длительного времени, производиться легко и рентабельно по количеству и качеству, не быть иммуногенным и использоваться для повторного введения гена, являться безопасным при введении и не иметь побочных эффектов.
В качестве векторов для доставки генетического материала в клетку-мишень используют самые разнообразные вирусы, но наиболее распространены векторы на основе аденовируса (ADV), аденоассоциированного вируса, ретро- (RV), лентивируса (LV) и вируса простого герпеса (HSV) (табл. 3). При этом нативные полные вирусные частицы никогда не используются в качестве векторов, так как в этом случае есть опасность встраивания их генетического материала в клетки хозяина с целью приобретения метаболических и биосинтетических продуктов для вирусной транскрипции и репликации. Поэтому вирусы предварительно подвергаются существенной генетической модификации, приводящей к утере их репликационной способности и повышению тропизма к тканям и клеткам.

Вирусные векторы достаточно хорошо изучены, они имеют высокую эффективность трансфекции in vivo, для их наработки существуют коммерческие паковочные клеточные линии. Векторы на основе аденовируса и аденоассоциированных вирусов не встраиваются в геном клетки, а остаются эпихромосомными. Это уменьшает опасность мутагенеза, который может быть индуцирован при внедрении вируса в геном. При конструировании специфически направленных аденовирусных векторов эффективной оказалась замена вирусных промоторов, контролирующих основные транскрипционные области, так называемыми транскрипционными регуляторами, в результате чего экспрессия гена и репликация вируса происходят преимущественно в целевых клетках [14, 15].
Ретровирусные векторы интегрируют в геном хозяина, что при генной терапии обеспечивает стабильность и стойкую экспрессию трансгена в дочерних клетках, однако несет риск инсерционного мутагенеза, который может вызывать инактивацию генов-супрессоров опухолевого роста или активации онкогенов [16].
Необходимо отметить, что вирусные векторы обладают и другими недостатками. Так, они могут нести лишь небольшое количество генетического материала (до 30 кб). Кроме того, аденовирусные векторы 1-го поколения, в которых присутствуют все вирусные гены, обладают выраженной иммуногенностью, которая обусловливает развитие как клеточного, так и гуморального иммунного ответа, что приводит к разрушению не только самого вектора, но и клеток, трансдуцированных ими, и как следствие к ограничению срока экспрессии трансгена в 2—3 нед после трансдукции [17]. В настоящее время проблема иммуногенности таких векторов для генной терапии решается путем разработки конструкций, практически полностью лишенных вирусных генов, так называемых «gutless» вирусов или хелперзависимых (HD)/Ad векторов [18]. Исследования in vivo показали перспективность использования HD/Ad векторов для трансдукции клеток сосудистой системы и миокарда [19].
Несмотря на описанные недостатки, вирусный метод доставки трансгенов в клетки успешно развивается и в настоящее время является доминирующим: около 70% клинических исследований посвящено изучению генетических конструкций, снабженных вирусными векторами.
В то же время в последние годы активно разрабатываются невирусные системы доставки генетического материала с использованием высокомолекулярных химических соединений для конденсации с ДНК: липидсвязанные комплексы — липоплексы либо поликатионные комплексы, имитирующие поверхность вируса — полиплексы (табл. 4). Эти наночастицы защищают плазмидную ДНК в межклеточном пространстве от деградации нуклеазами и облегчают проникновение в клетки-мишени. Положительно заряженные комплексы связываются со специфическими рецепторами (при наличии на их поверхности макромолекул, обладающих свойствами специфического лиганда) или непосредственно с поверхностью клетки. Комплексы проникают в клетку по механизму эндоцитоза. После высвобождения из эндосомы и разборки комплекса нуклеиновая кислота проникает через поры в ядро клетки [20].

Невирусные системы на основе катионных липидов или полимеров имеют ряд преимуществ перед вирусными системами доставки: большой объем несущей ДНК, отсутствие какой-либо вирусной составляющей, а следовательно, низкая иммуногенность, высокая технологичность производства. Однако низкая трансфицирующая способность невирусных векторов и недостаток информации о безопасности у человека тормозят развитие исследований в этом направлении, только 5,2% приходится на клинические испытания, где в качестве системы доставки терапевтических генов используют липоплексы или полиплексы.
К настоящему моменту сформировалось два типа геннотерапевтического воздействия: индивидуализированный подход ex vivo — трансфекция стволовых гемопоэтических клеток, полученных из периферической крови и трансплантированных затем больному, и in vivo — трансфекция клеток внутри организма, куда генетический материал в составе вектора доставляется в результате внутривенной или внутриартериальной (в печеночную артерию) инфузии, внутримышечного, подкожного, интратуморального, интраназального или сублингвального введения. В практике лечения сердечно-сосудистых заболеваний испытываются прямые игольные инъекции конструкций в миокард, введение вирусных векторов при помощи разнообразных катетеров, использование стентов с покрытиями, обеспечивающими дозированный выход лекарственного средства. В онкологии используют, как правило, внутриопухолевое введение целевого гена в составе различных векторов.
На долю заболеваний, для которых разрабатываются методы генной терапии, большая часть приходится на злокачественные новообразования. Злокачественная трансформация клетки происходит в результате накопления генетических дефектов, приводящих к их аномальному росту, непосредственной причиной которых является дисбаланс в пролиферации и гибели клеток. Поэтому разработка способов коррекции этих дефектов является основой генной терапии злокачественных новообразований. Подходы к генной терапии рака включают в себя три основные стратегии: введение нормального гена в опухолевые клетки для замены «мутантного» гена, генетическую модификацию, преследующую цель заглушить «мутантный» ген, и генетические подходы, направленные на запуск гибели опухолевых клеток (табл. 5).

Представления о патогенезе злокачественных новообразований, в основе которого, в том числе, лежат активация онкогенов и инактивация генов-супрессоров опухолевого роста, позволяют искать пути подавления или восстановления функции этих генов.
К настоящему моменту известно более 24 генов-супрессоров, среди них наиболее изученным является ген р53, контролирующий клеточный цикл и поврежденный в ≈50% опухолей человека [21]. Так, коррекционная замена мутантного гена p53 в опухолевых клетках геном дикого типа (не содержащим мутаций) с помощью методов генотерапии приводила к восстановлению функций белка p53 и инициации процессов, запускающих программированную гибель злокачественных клеток. Клинические испытания аденовирусного вектора Ad-p53 показали, что восстановление дикого типа р53 путем доставки гена при помощи дефектного по репликации Ad приводило к значительному противоопухолевому эффекту на фоне низкой общей токсичности [22]. Более того, восстановление р53 сопровождалось увеличением чувствительности опухолевых клеток к химио- и радиотерапии [23].
Технология «молчащих» генов — одна из новейших технологий в генотерапии рака, направлена на сайленсинг (silence — молчание) генов, отвечающих за рост и/или деление раковых клеток, так называемых онкогенов. «Заглушить» гены можно за счет адресной доставки малых интерферирующих двухцепочечных РНК (siRNA), которые блокируют экспрессию гена в результате гомологичной рекомбинации (РНК-интерференция) [24, 25]. Также малые РНК, образующие «шпильки» во вторичной структуре (shRNA), могут быть использованы для подавления экспрессии генов путем РНК-интерференции.
Направленная доставка siRNA была апробирована в клинических испытаниях: CALAA-01 («Calando Pharmaceuticals») для пациентов с меланомой [26] и ALN-VSPOI («Alnylam Pharmaceuticals») для лечения рака печени и других солидных опухолей [27]. Предварительные результаты исследования CALAA-01 и ALN-VSPOI показали безопасность и хорошую переносимость siRNA, что является подтверждением целесообразности продолжения испытаний для продвижения данного подхода к лечению заболеваний онкологического профиля.
Одним из активно развивающихся направлений генной терапии рака является энзиматическая терапия (Gene-Directed Enzyme Prodrug Therapy, GDEPT), основанная на запуске гибели опухолевых клеток за счет придания им способности превращать вводимый в организм препарат-предшественник в токсичный метаболит. Это достигается введением «суицидных» генов, кодирующих фермент вирусного или бактериального происхождения, который в клетках, где он экспрессируется, конвертирует свой субстрат, превращая его из нетоксичного пролекарства в токсичный для клетки метаболит [28]. Наиболее изученными системами «суицидный» ген/пролекарство являются: ген тимидинкиназы вируса простого герпеса (HSVtk)/ганцикловир, ген цитозиндезаминазы (CD)/5-фторцитозин, цитохром P450 (p450)/циклофосфамид и другие [29]. Основная проблема, препятствующая применению этой стратегии в клинической практике, — довольно низкая эффективность доставки терапевтических генов. Несмотря на это, число проведенных клинических испытаний GDEPT растет с каждым годом [1]. Среди препаратов, предназначенных для GDEPT, можно выделить Sitimagene ceradenovec (Cerepro, «Ark Therapeutics Group Plc», Великобритания и Финляндия) на основе аденовирусного вектора со встроенным «суицидным» геном HSVtk. Этот препарат прошел I/II фазы клинических испытаний (глиома), в которых показана безопасность внутриопухолевой доставки вирусной тимидинкиназы в глиальные клетки, при этом отмечена стабилизации процесса у пациентов [30, 31].
Генная терапия рака, направленная на разрушение опухолевых клеток, возможна с использованием вирусов, которые с помощью специальных генетических манипуляций становятся онколитическими, т. е. селективно воздействуют только на опухолевые клетки, вызывают лизис инфицированных клеток и последующую трансдукцию окружающих опухолевых клеток, что в несколько раз увеличивает их терапевтический индекс. Существуют две основные стратегии получения онколитических вирусов: путем делеции (мутации) основных вирусных генов, функции которых могут быть восполнены только в опухолевых, но не в нормальных клетках (делеционные мутанты), и путем регуляции экспрессии основных вирусных генов за счет помещения их под ткане- или опухолеспецифичные транскрипционные регуляторные элементы (транскрипционная регуляция). Препараты на основе онколитических вирусов разрабатывают с использованием РНК- и ДНК-содержащих вирусов, таких как аденовирус, реовирус, вирус простого герпеса, поксвирус. Так, клинические испытания онколитических вирусов ONYX-015 и Н101 на основе мутантных аденовирусов с делецией в гене Е1В и с делецией в генах Е1В и Е3 соответственно, которые селективно реплицируются в опухолевых клетках с дефектным р53, показали безопасность и эффективность при интратуморальном введении в терапии ряда опухолей [32, 33]. В настоящее время проходят клинические испытания препарата REOLYSIN («Oncolitic Biotech. Inc.», Канада), полученного на основе штамма Т3D реовируса человека. В этих исследованиях показана низкая токсичность при внутриопухолевом и внутривенном его введении в режиме монотерапии, а в сочетании с противоопухолевыми препаратами, такими как гемцитабин для рака поджелудочной железы и легкого, доцетаксел для рака мочевого пузыря, предстательной железы и легкого, паклитаксел с карбоплатином для меланомы, рака легкого и яичников, показана высокая противоопухолевая эффективность [34].
Наиболее успешным онколитическим препаратом является OncoVexGMCSF на основе вируса простого герпеса, который проходит II/III фазы клинических испытаний для лечения меланомы, рака молочной железы, опухолей головы и шеи. В геноме этого вируса сохранен ген тимидинкиназы для проведения GDEPT, но удалены обе копии ICP34.5 гена, отвечающего за вирусную репликацию в нормальных клетках, а в область ICP47 встроен ген GM-CSF. Продуцируемый GM-CSF привлекает дендритные клетки (DC) и может стимулировать выброс цитотоксических Т-лимфоцитов [35].
Следует отметить, что современная стратегия развития иммунотерапии рака на фоне расширяющихся знаний о функционировании иммунной системы и формировании иммунного ответа является главной предпосылкой для усовершенствования подходов к лечению с привлечением инновационных лекарственных средств, созданных методами генной инженерии, таких как генные вакцины.
Исследования в этой области ведутся в трех направлениях: модификация опухолевых клеток для придания им большей иммуногенности, введение генов опухолеассоциированных антигенов в дендритные клетки, геномодификация лимфоцитов для повышения цитотоксического ответа.
К настоящему моменту разработана «платформа», представляющая собой два рекомбинантных вектора: на основе поксвирусов коровьей оспы (RV) для первичной вакцинации и птичьей оспы (RF) для ревакцинации с тремя костимуляторными молекулами [В7.1 (CD80), ICAM-1 (CD54) и LFA-3 (CD58), обозначаемыми TRICOM] для повышения иммунного ответа [36—38]. Каждый из этих векторов может содержать трансген для одного или нескольких опухолевых антигенов, например, таких как гены, кодирующие простатспецифический антиген (PSA), раково-эмбриональный антиген (СЕА), мембранно-связанный муцин (MUC-1) и другие. Разработаны вакцины PROSTVAC (RV-, RF-PSA-TRICOM) для иммунотерапии рака предстательной железы [39, 40] и PANVAC (RV-, RF-СЕА-MUC1-TRICOM) для иммунотерапии рака молочной железы, прямой кишки, яичников. Полученные на сегодняшний день результаты применения вакцин выглядят обнадеживающими в плане их переносимости. Однако в плане эффективности наблюдается лишь непродолжительная стабилизация процесса. Несмотря на это, синергизм иммунотерапии и химиотерапии, полученный в ряде клинических испытаний, является подтверждением целесообразности применения вакцин в сочетании с другими методами лечения [41].
Метод, известный как технология химерных антигенных рецепторов, или CAR-технология (от англ. chimeric antigen receptor), в настоящее время является одним из наиболее перспективных и быстро развивающихся направлений в области иммунотерапии злокачественных новообразований [42]. Эта технология заключается в выделении из периферической крови пациента Т-лимфоцитов и их двухкомпонентной модификации в условиях ex vivo: присоединение к их поверхности рецептора, распознающего экспрессируемый большинством лейкемических клеток белок CD19, и введение мощного внутриклеточного механизма, запускающего активный рост и деление клеток в ответ на их взаимодействие с белком-мишенью. Такие генномодифицированные Т-лимфоциты возвращают в кровоток пациента. Предварительные результаты исследований свидетельствуют о том, что этот подход позволяет получить хорошие результаты у 2/3 пациентов, не ответивших на традиционные методы лечения [43—45].
Микроокружение опухоли играет важную роль в прогрессии и метастазировании. Оно включает в себя строму с фибробластами и эндотелиальными клетками сосудов. Вмешательство в эту микросреду также может привести к регрессии опухоли. Наиболее важной «точкой приложения» является ангиогенез. В условиях опухолевого роста активируется выброс проангиогенных цитокинов, таких как сосудистый эндотелиальный фактор роста (VЕGF) и фактор роста фибробластов (FGF). Эти факторы стимулируют рост микрососудов вокруг опухоли с последующей прогрессией и метастазированием. Альтернативой терапии рекомбинантным (гуманизированным) моноклональным антителом бевацизумаб, которое селективно связывает и ингибирует активность VEGF, может стать генная терапия. Предварительные результаты клинических испытаний показали, что доставка антиангиогенных генов, кодирующих белки ангиостатин и эндостатин с помощью аденоассоциированного вектора, вызывает регрессию опухоли с минимальными побочными эффектами [15].
Таким образом, генная терапия достигла определенных успехов: разработаны подходы, сконструировано более 2 тыс. препаратов, прошедших доклинические исследования, проведены клинические испытания в ряде областей медицины. К настоящему моменту в мире уже зарегистрировано четыре препарата для генной терапии (табл. 6). Гендицин (Shenzhen SiBiono GenTech) и Oncorine (H101) (Sunway Biotech Co) — это первые генно-терапевтические препараты, допущенные к клиническому применению в Китае в 2003 и 2005 г. соответственно, для лечения плоскоклеточного рака головы и шеи [46]. Препарат Glybera (uniQurо), созданный на основе аденоассоциированного вектора, в геном которого встроен вариант гена липопротеиназы LPL s447x для лечения моногенного заболевания — дефицита липопротеиназы, вызванного мутацией в гене, кодирующем выработку этого фермента, допущенный к применению в 2012 г. Европейским агентством по оценке лекарственных препаратов (EMA) [47]. Препарат неоваскулген, представляющий собой высокоочищенную сверхскрученную плазмиду с геном VEGF165, кодирующий эндотелиальный фактор роста сосудов под контролем цитомегаловирусного промотора, предназначен для лечения пациентов с ишемией нижних конечностей атеросклеротического генеза и зарегистрирован в России в 2011 г. [48].

В настоящий момент в России, так же как и за рубежом, продолжается развитие этого метода. Так, во II фазе клинических испытаний находятся цельноклеточные генномодифицированные вакцины аллоген (из клеточной линии меланомы человека mel P/tag7) и мелавак (из клеточной линии меланомы mel Ког/GM-CSF), показавшие безопасность и эффективность при лечении меланомы [49]. На стадии клинических испытаний находится препарат канцеролизин, разработанный на основе аденовируса 5-го типа, у которого был полностью делетирован ген белка Е1 В по аналогии с известным штаммом ONYX-015 (ФГУН ГНЦ «Вектор», Россия) [50]. I фазу клинических испытаний проходит препарат АдеЛакт («НТфарма», Россия), представляющий собой рекомбинантные псевдоаденовирусные частицы, несущие ген лактоферрина человека (hLf). Этот препарат, предназначенный для терапии токсикозов различного генеза III и IV степени, проходил доклинические испытания в Московском научно-исследовательском онкологическом институте им. П.А. Герцена — филиале ФГБУ «НМИРЦ» Минздрава России [51]. На этой же базе идут доклинические испытания АнтионкоРАН-М — препарата для противоопухолевой «суицидной» терапии на основе рекомбинантной ДНК, кодирующей гены тимидинкиназы вируса простого герпеса (HSVtk) и колониестимулирующего фактора (GM-CSF) с невирусной системой доставки, разработанного в результате совместных исследований, проведенных в ФГБУН ИМГ РАН, ФГБУН ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и МГУ им. М.В. Ломоносова [52].
Заключение
Таким образом, использование метода генной терапии может быть результатом уже не столь отдаленного будущего, но говорить о реальных перспективах этого направления в медицине, по-видимому, пока преждевременно. Несмотря на то, что большинство клинических испытаний свидетельствует об относительной безопасности геннотерапевтических препаратов, требуется время для окончательного доказательства их эффективности. Возможно, в будущем метод генной терапии станет основным в лечении наследственных заболеваний, а для заболеваний онкологического профиля генная терапия будет рассматриваться как часть комплексного противоопухолевого лечения.