Что такое гемостатический препарат
Гемостатические средства
Гемостатические средства — лекарственные средства, способствующие остановке кровотечений. Все гемостатики, в зависимости от механизма действия, подразделяются на три большие группы:
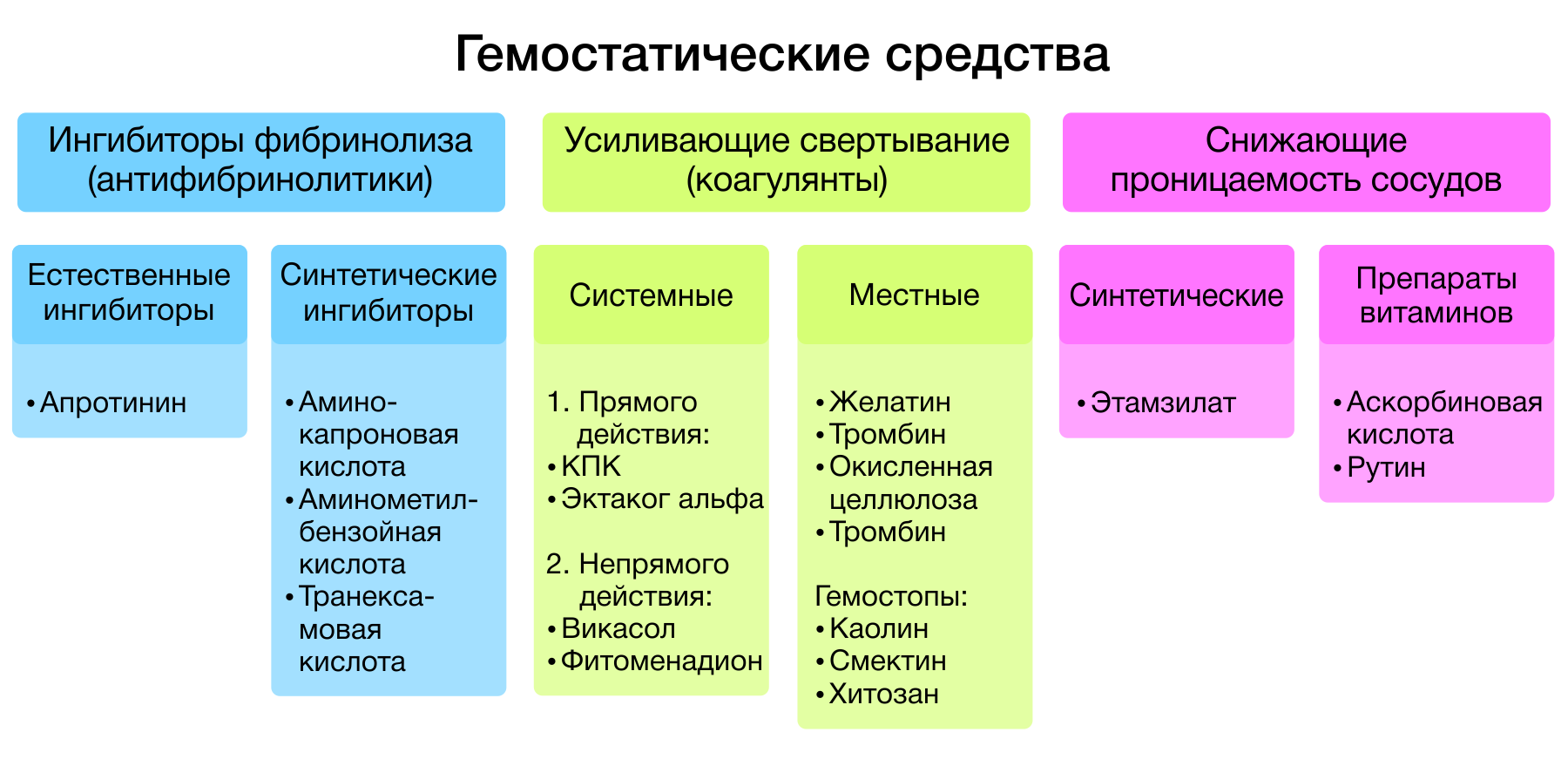
Рисунок 1 | Классификация гемостатиков.
1. Ингибиторы фибринолиза.
В клинической практике широкое распространение получили две группы препаратов ингибиторов фибринолиза: естественные ингибиторы фибринолиза (апротинин и его аналоги) и синтетические ингибиторы фибринолиза (аминокапроновая кислота, аминометилбензойная кислота, транексамовая кислота).
Апротинин — полипептид, получаемый из легких, поджелудочной и околоушной желез крупного рогатого скота, действующий аналогично α2-антиплазмину. Апротинин разрушает свободный плазмин, практически не взаимодействует со связанным плазмином, а также угнетает активацию тромбоцитов. Являясь сериновой протеазой, апротинин блокирует калликреин-кининовую систему путем разрушения калликреина, снижает активность отдельных протеолитических ферментов, таких как: трипсин, химотрипсин, кининогеназа. Изначально препарат был включен в рекомендации по лечению острого панкреатита и панкреонекроза, однако не подтвердил свою эффективность, и показания к его применению были пересмотрены.[1]
Аминокапроновая кислота – 6-аминогексановая кислота — синтетическое производное лизина. Присоединяясь к лизин-связывающему участку плазминогена, аминокапроновая кислота обратимо блокирует процесс фибринолиза, снижает активность стрептокиназы, урокиназы, тканевых киназ, калликреина, трипсина и гиалуронидазы. Аналогичным фармакологическим эффектом обладает производное аминокапроновой кислоты — аминометилбензойная кислота, отличающаяся улучшенной фармакокинетикой. Аминокапроновая кислота снижает активность тромболитических препаратов и может быть использована для нейтрализации их эффекта.
Транексамовая кислота — транс-4-(аминометил)-циклогексанкарбоновая кислота — обратимо блокирует эффект плазминогена, адгезию лейкоцитов и тромбоцитов на поверхность тромба за счет конкурентного ингибирования активатора плазминогена. Оказывает противоаллергическое и противовоспалительное действие посредством подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. По мощности антифибринолитического действия транексамовая кислота значительно превосходит аминокапроновую кислоту. Активность препарата в плазме сохраняется на протяжении 7-8 часов, в тканях — до 17 часов.[2]
У больных с высоким риском массивной кровопотери в плановой хирургии (сердечно-сосудистая хирургия, травматология и ортопедия, трансплантология) применение ингибиторов фибринолиза уменьшает интраоперационную кровопотерю и снижает потребность в трансфузии донорской крови. На протяжении 20 лет проводилось множество исследований, результаты которых были неоднозначны: мнения склонялись то в пользу апротинина, то в пользу синтетических производных лизина.
В 2007 году компания Bayer завершила исследование BART (Blood conservation using antifibrinolytics in a randomized trial), в котором было изучено действие апротинина у кардиохирургических больных высокого риска. Исследователи выявили большой риск летальных исходов и осложнений при использовании апротинина. В группе апротинина количество больных с массивной кровопотерей было несколько меньше, но 30-дневная летальность на 50% превышала аналогичный показатель в других группах.[3]
После публикации результатов BART компания Bayer уведомила Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) о намерении изъять апротинин с рынка. Показания к назначению были пересмотрены, и препарат был исключен из списка безопасных лекарственных средств.
Огромный мета-анализ позволил сделать вывод, что транексамовая кислота обеспечивает такое же снижение периоперационной трансфузии, какое наблюдается при использовании апротинина, но более безопасна. Согласно рекомендациям Европейского общества анестезиологов по ведению пациентов с массивной периоперационной кровопотерей (2013 г.), при массивном кровотечении рекомендуется применение транексамовой кислоты (20-25 мг/кг); она может быть введена повторно или применяться в виде пролонгированной инфузии (1-2 мг/кг/ч).[4]
2. Препараты, усиливающие свертывание крови
Среди средств, повышающих скорость свертывания крови, выделяют: средства системного действия и для местного применения. К препаратам системного действия относят непрямые коагулянты (фитоменадион, менадиона натрия бисульфит) и коагулянты прямого действия (факторы свертывания: концентрат протромбинового комплекса, эптаког альфа).
Менадиона натрия бисульфит — синтетический водорастворимый аналог витамина К3. Субстратно стимулирует витамин K-редуктазу, активирующую витамин К и обеспечивающую его участие в печеночном синтезе витамин K-зависимых плазменных факторов гемостаза (II, VII, IX, X). Фитоменадион является синтетическим структурным аналогом витамина К1, обладает большей активностью и более ранним началом реализации эффектов (через 6-10 часов после перорального применения, против 18-24 часов у менадиона натрия бисульфита). Данная группа препаратов показана для коррекции нарушений системы гемостаза, вызванных дефицитом витамина К1, передозировкой антикоагулянтов непрямого действия (варфарина), а также для предоперационной профилактики кровотечений.
Концентрат протромбинового комплекса (КПК) — лекарственный препарат, содержащий факторы II, VII, IX, X, а также следовые концентрации антитромбина III, гепарина, протеинов С и S. Основным показанием к применению КПК служит коррекция приобретенного дефицита витамин К1-зависимых факторов в экстренных ситуациях (кровотечение, экстренная операция). Помимо этого, КПК широко используется как средство для лечения и профилактики кровотечений у пациентов с врожденным дефицитом одного из К1 зависимых факторов свертывания (врожденная гипопротромбинемия, врожденный дефицит фактора Стюарта – Прауэра).[5]
Эптаког альфа — рекомбинантный активированный VII фактор свертывания. Механизм действия препарата заключается в прямой активации фактора Х на поверхности активированных тромбоцитов. Это вызывает «тромбиновый взрыв» независимо от имеющейся концентрации факторов VIIIa и IXa. В результате образуется стабильный фибриновый сгусток. Считается, что эптаког альфа инициирует гемостаз только в месте повреждения ткани и не вызывает системной активации механизмов свертывания. Препарат был разработан для лечения кровотечений и проведения хирургических вмешательств у пациентов с наследственной или приобретенной гемофилией и высоким титром ингибитора факторов свертывания VIIIa или IXa. Его применение у пациентов с массивным кровотечением можно сформулировать согласно рекомендациям ESA (2013): «Применение рекомбинантного фактора VII возможно только при кровотечениях, которые не могут быть устранены хирургическими методами или путем комплексной гемостаз-корригирующей терапии». Необходимо серьезное обоснование для применения данного препарата [6].
3. Местные гемостатики
Местные гемостатики используются для остановки капиллярных и паренхиматозных кровотечений преимущественно в неотложной хирургии и стоматологии. Данная группа включает в себя широкий спектр препаратов с различным механизмом действия.
Тромбин является естественным компонентом свертывающей системы крови. Раствор тромбина используют только местно при капиллярных или паренхиматозных кровотечениях в ходе нейрохирургических вмешательств, операций на печени и почках, в стоматологической практике. Попадание тромбина в крупные кровеносные сосуды может вызвать распространенный тромбоз [7].
Окисленная целлюлоза выпускается в виде пленок, сеток, пучков и губок. Данный биологический агент играет роль субстрата для агрегации тромбоцитов и активации механизмов гемостаза. Целлюлоза значительно снижает рН среды, что приводит к лизису эритроцитов с образованием кислого гематина, который формирует дополнительный искусственный сгусток. Помимо этого окисленная целлюлоза обладает антибактериальным эффектом, в том числе в отношении антибиотикорезистентных микроорганизмов [7].
Хитозан – это полисахаридный биополимер, получаемый из хитиновых панцирей ракообразных. Кровоостанавливающий эффект данного вещества достигается путем связывания хлопьев хитозана с отрицательно-заряженными эритроцитами и образования гелеобразного сгустка в месте контакта с кровью. Среди преимуществ препаратов на основе хитозана выделяют его антимикробные свойства, длительный срок хранения, стабильность при перепадах температур и безопасность при наружном использовании [8].
Наиболее известным представителем группы средств, понижающих сосудистую проницаемость, является этамзилат. Гемостатический эффект данного препарата обусловлен активацией тромбопластина в месте повреждения сосудов микроциркуляторного русла и снижением синтеза простациклина PGI-2 в эндотелии сосудов, что в конечном итоге приводит к усилению адгезии и агрегации тромбоцитов, остановке или уменьшению кровоточивости. За счет антигиалуронидазного действия этамзилат обладает ангиопротективным эффектом, улучшает микроциркуляцию и нормализует проницаемость сосудистой стенки при патологических процессах [9].
Что такое гемостатический препарат
Плоткин Д.В., Поварихина О.А.
СОВРЕМЕННЫЕ СРЕДСТВА ЛЕКАРСТВЕННОЙ ГЕМОСТАТИЧЕСКОЙ ТЕРАПИИ
«ФАРМиндекс-Практик» выпуск 6 дата стр. 40-46 Дата выхода: ноябрь 2004 Предложения производителей и поставщиков, описания из «Энциклопедии лекарств» по упоминаемым в статье препаратам:
Кровотечение является угрожающим и наиболее опасным спутником многих ранений, повреждений и заболеваний. Где бы мы ни сталкивались с его проявлениями: в операционной, эндоскопическом кабинете, в походных условиях и в быту, от врача требуются квалифицированные и быстрые действия для его остановки и предотвращения необратимых последствий кровопотери.
Широко известна классификация кровотечений по источнику геморрагии (артериальные, венозные, капиллярные и смешанные), по направленности (внутренние и наружные) и по времени возникновения (первичные и вторичные). Первичные кровотечения возникают в момент травмы и являются непосредственными результатами ранения. Вторичные кровотечения возникают спустя какое то время после ранения по различным причинам (расплавление тромба или аррозии стенки кровеносного сосуда гнойным раневым процессом). По механизму возникновения в настоящее время кровотечения делят на механические (ранения и повреждения, а так же при разъедании сосуда воспалительным, опухолевым или другим патологическим процессом) и нейро-трофические. К последним относятся геморрагии возникшие в связи с нарушениями обмена при заболеваниях печени (декомпенссированные циррозы) крови (гемофилия, болезнь Верльгофа и др.), сепсисе и некоторых инфекционных заболеваниях (группа геморрагических лихорадок и т.д.).
Позволим себе кратко напомнить этот физиологический механизм. В первый момент тромбоциты собираются в конгломерат, закупоривая дефект в сосудистой стенке. При этом высвобождаются активные амины (АДФ, тромбоксан А2, серотонин, фактор Willebranda), которые в свою очередь вызывают дальнейшую агглютинацию кровяных пластинок, происходит вазоконстрикция и каскадно активируются факторы свертывания крови, выпадают первые нити фибрина. Сущность коагуляции заключается в последовательной активации свертывающих факторов, приводящей к расщеплению фибриногена и превращающего его в нерастворимый фибрин. Механизм коагуляции запускается следующим образом: в месте повреждения происходит контакт свертывающих факторов с коллагеном поврежденного сосуда (внутренний механизм), что в купе с активацией тканевых факторов (внешний механизм) приводит к превращению протромбина в тромбин, катализирующего превращения фибриногена в фибрин.
Безусловно, помимо образования первичного тромба в адаптационной системе человека к кровопотере принимают участие следующие факторы: снижение артериального давления, повышение тонуса и спазм периферических сосудов с замедлением кровотока, остановка секреции, снижение мочеотделения. Если кровотечение происходит не очень быстро (небольшой калибр сосуда, сдавление сосуда отечными тканями и гематомой), а компенсаторные реакции хорошо развиты, то возможна самопроизвольная его остановка.
С целью остановки кровотечение на протяжении многих веков человечество придумало бесчисленное количество способов хирургического и лекарственного гемостаза. Так в знаменитом египетском папирусе Эберса (около 3 тысяч лет до н.э.) описывается лечение кровоточащих ран с помощью наложения повязок с ароматическими маслами, меда и склеивающими веществами. Судя по археологическим находкам, древние целители Междуречья, Индии успешно останавливали кровотечение из ран путем ушивания последних, лигирования сосудов. Во времена Клавдия Галена (II век н.э.) и далее вплоть до конца XVIII века практиковалось прижигание ран каленым железом и кипящими маслами, наложение давящих повязок с травяными бальзамами для остановки раневых кровотечений. С 1879 года стала широко применяться тампонада йодоформной марлей, а так же гигроскопическими салфетками пропитанными адреналином и желатином. В 1911 году американским нейрохирургом Харви У. Кушингом были предложены прогрессивные методы местного гемостаза с использованием локального гемостатического эффекта скелетной мышцы, применение серебряных сосудистых клипс и электрокоагуляция (совместно с У. Бовье). В последующем фармацевтическая промышленность предложила хирургам множество средств местного гемостатического действия, полученных из компонентов крови человека.
Напомним, что естественный гемостаз за счет механизмов свертывания крови происходит при повреждении небольших по калибру кровеносных сосудов. При патологии свертывающей системы, а так же при повреждении средних и крупных артериальных стволов, самопроизвольная остановка кровотечения может не наступить. В таком случае от врача требуются неотложные меры направленные на предотвращение невосполнимой кровопотери.
Рассмотрим подробней химические гемостатики. Из применяемых препаратов одни являются вазоконстрикторами, другие прокоагулянтами, а третьи проявляют гигроскопические свойства, что помогает «запломбировать» поврежденный сосуд. В настоящее время в медицине широко используются желатиновые пенки и пластинки, коллагеновые пленки, фибриновый клей, целлюлоза и комбинированные средства.
Губка гемостатическая коллагеновая состоящая из коллагена, фурацилина и борной кислоты, оказывает гемостатическое действие, стимулирует восстановление тканей, полностью рассасывается в полости или ране. Губка используется при местном гемостазе при операциях на паренхиматозных органах, после лазерной операции эрозий шейки матки; при остановке постэкстракционного альвеолярного кровотечения и носовых кровотечений; может быть использована как раневое покрытие при лечении ран, трофических язв и пролежней. Применяется в общей хирургии, гинекологии.
Необходимо так же упомянуть о местном действии некоторых системных вазоконстрикторов, таких как адреналин (эпинефрин), но в настоящее время применение их ограничено стоматологией, отоларингологией и эндоскопической практикой при кровоточивости слизистых оболочек и гастродуоденальных язв.
В заключении хочется подчеркнуть, что все многообразие местных и системных гемостатических средств не заменяет хирургического гемостаза при кровотечениях из крупных венозных и артериальных стволов. Совершенствование методов остановки кровотечения и появление новых лекарственных гемостатиков позволяет надежно и эффективно бороться с кровопотерей, что в условиях современного дефицита компонентов крови является социальной и экономической необходимостью.
1. Диагностика и лечение ранений / Под редакцией Ю.Г.Шапошникова. М.: Медицина, 1984.- 340 с.
2. Кузнецов Н.А. Современные технологии лечения острой кровопотери // Consilium medicum.- 2003.- № 6.- С.347-357.
4. Раны и раневая инфекция / Под ред. М.И.Кузина, Б.М.Костюченок. М: Медицина, 1990.- 592 c.
5. Arand A.G., Sawaya R. Intraoperative chemical hemostasis in neurosurgery // Neurosurgery.- 1986.- Vol.18, №2.- P.223-233.
6. Browder I.W., Litwin M.S. Use of absorbable collagen for hemostasis in general surgical patients // Am. Surg.- 1986.- Vol.52, №9.- P.492-494.
7. DeLustro F., Dasch J., Keefe J., Ellingsworth L. Immune responses to allogeneic and xenogeneic implants of collagen and collagen derivatives // Clin. Orthop.- 1990.- Vol.260.- P.263-279.
8. Evans B.E. Local hemostatic agents // NY State. Dent. J.- 1977.- Vol.47, №4.- 109-114.
9. Evans B.E. Local hemostatic agents (and techniques) // Scand. J. Haematol.- 1984.- Vol.33, Ssuppl.40.- P.417.
10. Haemostasis and Thrombosis / Eds. A.L.Bloom, D.P.Thomas. London: Churchill Livingstone, 1987.- P.614-615.
11. Light R.E. Hemostasis in Neurosurgery // J. Neurosurgery.- 1945.- Vol.2, №5.- P.414-434.
12. Light R.E., Prentice H.Z. Surgical investigation of a new absorbable sponge derived from gelatin for use in hemostasis // J. Neurosurgery.- 1945.- Vol.2, №5.- P.435-455.
13. Lindstrom P.A. Complications from the use of absorbable hemostatic sponges // AMA Arch. Surg.- 1956.- Vol.73.- P.133-141.
14. Principles of Surgery / Ed. by S.I.Schwartz / 7th Edition.- New York: McGraw-Hill, 1999.- P.92-93.
15. Pupka A., Chudoba P., Barc P. et al. Intraoperative hemostasis during kidney transplantation and the use collagen mesh dressing covered by fibrin glue (TachoComb) // Polim. Med.- 2003.- Vol.33, №3.- P.27-32.
16. Rosand J., Eckman M.H., Knudsen K.A. et al. The effect of warfarin and intensity of anticoagulation on outcome of intracerebral hemorrhage // Аrch. Intern. Med.- 2004.- Vol.164, №8.- P.880-884.
Сравнительная эффективность российских и зарубежных средств для остановки наружных кровотечений на основе минеральных сорбентов
«Врач скорой помощи»
02/2016
ОТ НАУКИ К ПРАКТИКЕ
После латентного периода длительностью 45 с, за который животные теряли от 18 до 25% ОЦК, производили ручную остановку кровотечения с применением исследуемых МГС (рисунок 2).
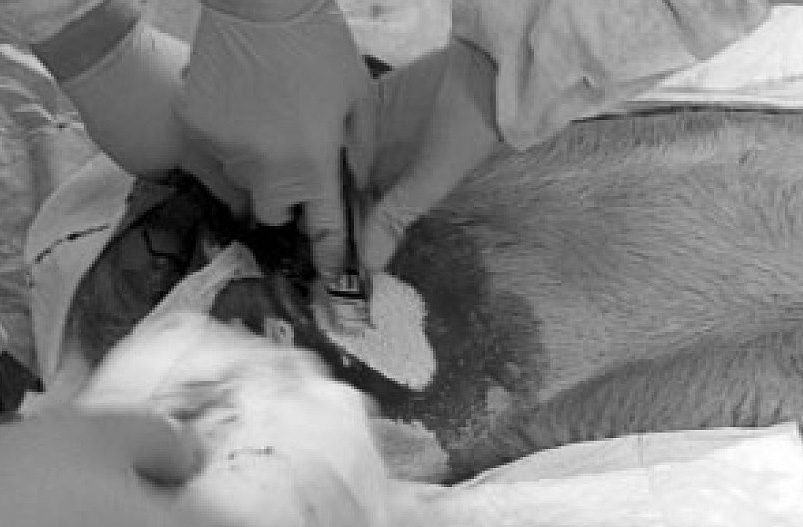
Засыпание МГС в рану 
Использование средств осуществляли в строгом соответствии с действующей инструкцией. Одновременно с временной остановкой кровотечения производили восполнение объема потерянного ОЦК 5% раствором гидроксиэтилкрахмала и 0,9% раствором натрия хлорида. После 7 мин ручной компрессии давление на рану прекращали и оценивали результат. При возобновлении кровотечения выполняли повторное применение гемостатика по изложенной схеме. Регистрацию АД производили в течение 60 мин. Оценка эффективности МГС осуществлялась по следующим показателям:
УГ = 1 — общее количество рецидиовов кровотечения (все животные) / общее число применений препарата
Изучаемые местные гемостатические средства. Оценке сравнительной эффективности подвергнуты следующие МГС:
Результаты и обсуждение
В ходе проведения эксперимента процедура применения гемостатиков, в целом, оставалось стандартной — засыпание препарата как можно ближе к источнику кровотечения, укладывание поверх раны ватно-марлевой подушки и ручная компрессия в течение 7 мин. При возникновении рецидива осуществляли повторное засыпание МГС, в количестве, необходимом для заполнения всей полости раны (с учетом вымывания части препарата непрекращающимся потоком крови) и повторяли алгоритм действий. После нанесения раны возникало струйное профузное кровотечение. В течение 45 с кровопотеря составляла 347,14±117,26 мл. Среднее АД понижалось с 80-90 до 20-23 мм рт.ст. К 4-6 мин отмечалось некоторое возрастание сАД, связанное с временной остановкой кровотечения, компенсаторными механизмами и проводимой гемодилюцией. После начала инфузионной терапии среднее АД животных, у которых был достигнут гемостаз, стабилизировалось на цифрах не менее 60 мм рт.ст.
В группе, где применяли «ГЕМОСПАС» первичного гемостаза удалось добиться у 2 животных (50%). У 3 и 4 особи дважды отмечался рецидив кровотечения. После повторных подсыпаний средства достигнут окончательный гемостаз. Таким образом, общее число рецидивов кровотечения составило — 4, на 8 применений препарата у всех животных. Интегральный показатель, отражающий устойчивость гемостаза равен 0,5. Все животные выжили в эксперименте. Средний общий объем кровопотери составил 1775,57±202,81 мл.
Во второй экспериментальной группе, где использовали Celox, первичный гемостаз достигнут только у 1 особи (25%). У 2,3 и 4 особи отмечено повторное возобновление кровотечения в виде интенсивного подтекания крови из-под ватно-марлевой прокладки. Только у одного животного гемостаз наступил сразу после повторного применения МГС, у двух оставшихся рецидив наступил еще раз, что потребовало 2-3 подсыпаний гемостатического агента. Общее число рецидивов кровотечения составило — 6, на 10 применений препарата у всех животных. Устойчивость гемостаза равна 0,4. Одно животное скончалось на 30 мин эксперимента
от необратимого снижения АД. Средний общий объем кровопотери составил 1668,0±102,03 мл.
В третьей экспериментальной группе применяли препарат QuikClot. По сути, с ним шло сравнение всех регистрируемых параметров в остальных группах, т. к. эффективность этого средства уже была неоднократно доказана в многочисленных исследованиях и экспериментах на животных. В данной группе животных (п=4) первичный гемостаз достигнут в 1 случае (25%). У 2 и 3 особи отмечено возобновление кровотечения 1 и 2 раза соответственно. Общее число рецидивов кровотечения составило — 3, на 7 применений препарата. Устойчивость гемостаза равна 0,6. Все животные выжили. Средний общий объем кровопотери составил 1536,67±117,86 мл.
В четвертой экспериментальной группе применяли препарат ГЕМОСТОП. При использовании на четырех экспериментальных животных первичный гемостаз достигнут в 2 случаях (50%). У 3 и 4 особи отмечено возобновление кровотечения один и два раза подряд соответственно. Общее число рецидивов кровотечения составило — 3, на 7 применений препарата. Устойчивость гемостаза равна 0,6. Все животные выжили. Средний общий объем кровопотери составил 1632,27±121,85 мл. Сводные данные по проведенному эксперименту и результатам анализа представлены в таблице.
В задачу нашего исследования входило сравнение эффективности двух отечественных (ГЕМОСПАС, ГЕМОСТОП») и двух зарубежных (QuikClot, Celox) средств для локального гемостаза в ране при интенсивных артериовенозных кровотечениях. Как можно было уже убедиться, по всем контрольным точкам статистически значимого различия не получено. Нельзя с уверенностью сказать, что какое-то из представленных средств показало лучший результат.
Сводные данные по эффективности изучаемых МГС
| Параметры эффективности | ГЕМОСПАС | Celox | QuikClot | ГЕМОСТОП | Р |
|---|---|---|---|---|---|
| Первичный гемостаз | 2 (50%) | 1 (25%) | 1 (33.3%) | 2 (67%) | 0.79 |
| Общее число рецидивов кровотечения | 4 | 6 | 3 | 3 | 0.05 |
| Общее число применений препарата | 8 | 10 | 7 | 7 | 0.03 |
| Устойчивость гемостаза (у.е.) | 0,5 | 0,4 | 0,6 | 0,6 | 0.87 |
| Средний общий объем кровопотери (мл) | 1775,57±202,81 | 1668,0±102,03 | 1536,67±117,86 | 1632,27±121,85 | 0.76 |
| Выживаемость | 100 | 75 | 100 | 100 | 0.08 |
Разработанный нами интегральный показатель «устойчивость гемостаза» хорошо отражает ситуацию с количеством рецидивов и повторных применений МГС. Несмотря, на кажущиеся на первый взгляд различия между группами, не подтвердились. Существенным недостатком в эксперименте является малое количество животных, вызванный недостатками в материально-техническом обеспечении. Желательно использовать не менее 6-8 на каждую группу, тогда статистические данные будут более достоверные. При строгом отборе животных необходимо проведения скрининг исследования системы гемостаза на подготовительном периоде, т.к. существенные различия в показателях могут повлиять на результаты. Некоторые исследователи отмечают не полную адекватность примененной нами модели. Считается, что при полном пересечении сосудов быстро наступает гемостаз за счет защитного сокращении мышечной оболочки артерии и вворачивания оболочек сосуда. По данным L. Littlejohn с соавт., при полном пересечении сосудов тампонада раны и /или надежная давящая повязка не уступают по эффективности МГС [19]. На предложенной учеными альтернативной модели краевого повреждения бедренной артерии даже современное табельное гемостатическое средство НАТО «CombatGauze» обеспечивает выживаемость только 33% животных, а первичный гемостаз вообще ни разу не был отмечен. Авторы указывают, что идеальная экспериментальная модель для будущих исследований должна обеспечивать гемостаз только у 30-50% при использовании «CombatGauze» в качестве стандарта [17]. Утяжеление экспериментальной модели позволит отчетливее проанализировать реальную полезность испытываемого МГС, особенно на этапах апробации и внедрения. Необходим более тщательный отбор животных и их рандомизация по группам. Так же считаем нецелесообразным использовать в эксперименте дополнительное тампонирование раны и наложение тугих давящих повязок поверх ран, т. к. это может серьезно исказить результаты эксперимента. Тем более, что сложно добиться стандартизации наложения повязок от случая к случаю.
Несмотря на указанные выше недостатки и ограничения в данном эксперименте, можно сделать предварительные выводы.