Что такое гемолимфа кратко
Гемолимфа
Содержание
Гемолимфа насекомых
Гемолимфа является единственной тканевой жидкостью в теле насекомых. Подобно крови у позвоночных животных гемолимфа образована жидким межклеточным веществом — плазмой — и находящимися в ней клетками — гемоцитами. Но в отличие от крови позвоночных, гемолимфа циркулирует не по замкнутым кровеносным сосудам, а в полости тела (в гемоцеле). Также в гемолимфе отсутствуют клетки, снабжённые гемоглобином или другими дыхательными пигментами.
Плазма гемолимфы содержит в себе неорганические и органические соединения. Гемоциты либо находятся в свободном взвешенном состоянии в плазме, либо оседают на поверхности внутренних органов. У большинства насекомых в 1 мм 3 гемолимфы содержится от 10000 до 100000 клеток. Число гемоцитов, циркулирующих в теле таракана, составляет 9—13 миллионов, а их суммарный объём достигает 10 % от общего объёма гемолимфы.
Функции гемолимфы
Гемолимфа осуществляет транспортировку питательных веществ от стенок пищеварительного канала ко всем органам. В выполнении данной функции принимают непосредственное участие как гемоциты, так и целый ряд химических соединений самой плазмы. Часть питательных веществ поступает из гемолимфы в клетки жирового тела. При голодании, диапаузе или во время линьки данные резервные продукты вновь переходят в гемолимфу и могут быть доставлены к местам их использования. У насекомых, развивающихся с полным превращением, те продукты, которые освобождаются при гистолизе личиночных тканей, тоже транспортируются гемолимфой. Вторая важная функция гемолимфы связана с её участием в защите насекомых от инфекционных заболевании и заражения паразитами. В выполнении данной защитной функции участвуют белки плазмы, гемоциты, способные к фагоцитозу, и клетки, образующие гемоцитарные капсулы вокруг многоклеточных паразитов. Гидростатическое давление, развиваемое гемолимфой, используется при выполнении ею механической функции. Оно обеспечивает раскручивание хоботка у бабочек и расправление крыльев после выхода из куколки или после превращения бескрылой личинки в крылатое взрослое насекомое.
Гемолимфа
Гемолимфа – кровь насекомых.
насекомое с красной кровью» />
насекомое с красной кровью
Личинка комара-дергуна –
насекомое с красной кровью
насекомое с красной кровью» />
Свойства гемолимфы насекомых
Гемолимфа насекомых обычно бесцветная либо окрашена в желтоватый или зеленоватый цвет. Однако у личинок комаров-звонков («мотыля») она имеет ярко-красную окраску. В плазме личинок растворено вещество, близкое по строению к гемоглобину, имеющемуся у высших животных. Просвечивая через прозрачные покровы, гемолимфа придает красный цвет и телу насекомого. [1] (фото)
Содержание воды в гемолимфе – 75-90%, в зависимости от стадии жизненного цикла и состояния (активная жизнь, диапауза) насекомого. Ее реакция либо слабокислая (как и у крови животных), либо нейтральная, в пределах рН 6-7. [1] Между тем, осмотическое давление гемолимфы намного выше, чем у крови теплокровных. В качестве осмотически активных соединений выступают различные аминокислоты и прочие вещества преимущественно органического происхождения. [2]
Осмотические свойства гемолимфы особенно сильно выражены у немногочисленных насекомых, населяющих солоноватые и соленые воды. Так, даже при погружении личинки мухи-береговушки в концентрированный раствор соли ее кровь не меняет своих свойств, а из тела не выходит жидкость, чего стоило бы ожидать при таком «купании». [2]
По весу гемолимфа составляет 5-40% от массы тела. [2]
Как известно, кровь животных имеет свойство свертываться – это защищает их от слишком большой кровопотери при ранениях. Среди насекомых не все обладают свертывающейся кровью; их раны, если такие появляются, обычно закрываются «пробками» из плазмоцитов, подоцитов и других специальных клеток гемолимфы. [3]
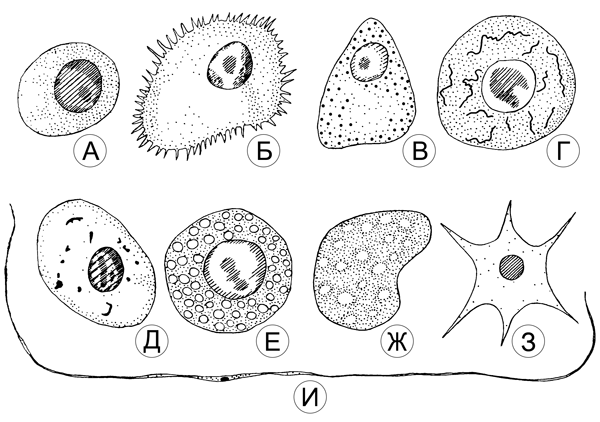
Разновидности гемоцитов у насекомых
А – Прогпмоцит, Б – Плазматоцит, В – Гранулоцит,
Г – Эноцит, Д – Цистоцит, Е – Сферическая клетка,
Ж – Адипогемоцит, З – Подоцит, И – Червеобразная клетка.
Состав гемолимфы насекомых
Гемолимфа состоит из двух частей: жидкости (плазмы) и клеточных элементов, представленных гемоцитами. [1]
В плазме растворены органические вещества и неорганические соединения в ионизированной форме: натрий, калий, кальций, магний, хлорит-, фосфат, карбонат-ионы. [1] В сравнении с позвоночными, гемолимфа насекомых содержит больше калия, кальция, фосфора и магния. Например, у растительноядных видов концентрация магния в крови может быть в 50 раз выше, чем у млекопитающих. То же касается калия. [3]
Также в жидкой части крови обнаруживаются питательные вещества, метаболиты (мочевая кислота), гормоны, ферменты и пигментные соединения. [1] В некотором количестве там также находятся растворенный кислород и углекислый газ, пептиды, белки, липиды, аминокислоты. [2]
Остановимся подробнее на питательных веществах гемолимфы. Из углеводов большая часть, примерно, 80%, приходится на трегалозу, состоящую из двух молекул глюкозы. Она образуется в жировом теле, выходит в гемолимфу, а затем расщепляется ферментом трегалазой в органах. При снижении температуры из другого углевода – гликогена – образуется глицерин. Кстати, именно глицерин имеет главное значение при переживании насекомыми морозов: он не дает гемолимфе образовать кристаллы льда, способные повредить ткани. Она превращается в желеобразную субстанцию, и насекомое сохраняет жизнеспособность иногда даже при минусовых температурах (например, наездник Braconcephi выдерживает замораживание до – 17 градусов). [2]
Липиды в гемолимфе насекомого представлены большей частью в виде эфиров глицерина и жирных кислот. Их источник – жировое тело. [2]
Аминокислоты представлены в плазме в достаточно большом количестве и концентрации. Особенно там много глутамина и глутаминовой кислоты, которые играют роль в осморегуляции и используются для построения кутикулы. Многие аминокислоты соединяются друг с другом в плазме и «хранятся» там в виде простых белков – пептидов. В гемолимфе самок насекомых имеется имеется группа белков – вителлогенинов, которые используются при синтезе желтка в яйцах. Белок лизоцим, присутствующий в крови у представителей обоих полов, играет роль в защите организма от бактерий и вирусов. [2]
Содержание в гемолимфе различных соединений и их соотношение может быть показателем его состояния. Например, соотношение между ионами калия и натрия в ней отражает обменные процессы (их интенсивность). Повышение уровня натрия в плазме говорит о том, что насекомое находится под воздействием инсектицидов или готовится к диапаузе. [1]
Гемоциты разделяются по морфологии и функциям на основные разновидности: амебоциты, хромофильные лейкоциты, фагоциты с гомогенной плазмой, гемоциты с зернистой плазмой. [1] А вообще, среди всех гемоцитов было обнаружено целых 9 видов: прогемоцит, плазмоцит, гранулоцит, эноцит, цистоцит, сферическая клетка, адипогемоцит, подоцит, червеобразная клетка. Частично это клетки разного происхождения, частично – разные «возраста» одного и того же гемопоэтического ростка. Они имеют различный размер, форму и функции. [3] (фото)
Обычно гемоциты оседают на стенках сосудов и в циркуляции практически не участвуют, и только перед наступлением очередного этапа превращения или перед линькой начинают перемещаться в кровотоке. Образуются они в специальных гемопоэтических органах. У Сверчков, Мух, Бабочек и Настоящих пилильщиков эти органы находятся в области спинного сосуда. [2]
Что такое гемолимфа кратко
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
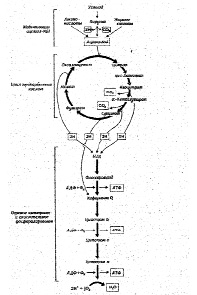
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Что такое гемолимфа кратко
Обычно понятие «иммунитет» используется для описания защитных реакций млекопитающих и особенно человека. Медицинское толкование иммунологических аспектов привело к массовому осознанию их связи с лечением и профилактикой конкретных заболеваний. Однако иммунология как наука прошла свое становление благодаря открытиям И.И. Мечникова, труды которого привели к возникновению сравнительной иммунологии.
Ведущая роль в защитных реакциях моллюсков принадлежит клеткам гемолимфы. Известно, что существуют различные морфотипы клеток гемолимфы, которые обладают определенной степенью подвижности по особым путям циркуляции и участвуют в инкапсуляции чужеродных объектов.
В последние десятилетия возникла потребность в понимании эволюционных аспектов становления защитных реакций. Поэтому важно получать сведения о характере защитных реакций разнообразных животных.
Моллюски представляют собой один из самых удобных объектов для таких исследований. В результате, выявление сходных закономерностей защитных реакций позволяет ставить вопрос о конвергентности стратегий защиты у беспозвоночных и позвоночных животных.
Целью представленного исследования было изучение морфофункциональных особенностей форменных элементов гемолимфы Helix pomatia и Stenomphalia ravergieri.
Объекты и методы исследования
В основу работы положены результаты исследований гемолимфы Helix pomatia и Stenomphalia ravergieri. Моллюски были собраны на территории города Белгорода, в пойме реки Везелка. Собранные особи содержались в стеклянных емкостях со слоем почвы на дне (5-6 см), для поддержания влажности в емкостях находились чашки Петри с водой. Периодически емкости опрыскивали водой при помощи пульверизатора. Кормление осуществляли один раз в сутки. Перед использованием в эксперименте моллюска предварительно лишали пищи.
Гемолимфу добывали через отверстие, проделанное во втором завитке от входа в раковину. После надавливания на тело улитки через входное отверстие из проделанного отверстия выступает брюшина. Из прокола, сделанного иглой, гемолимфу отбирали с помощью микропипетки и помещали на 2 мин в пластиковую чашку Петри (диаметр 3 см) для осаждения осколков раковины и слизи. Затем стекло располагали на столике инвертированного микроскопа (Nikon C1).
Для оценки динамики изменения количества циркулирующих гемоцитов в гемолимфе моллюсков была использована методика, предложенная К. Кусто и Т. Йошино [2]. Количество адгезированных и неадгезированных гемоцитов в 1 мкл гемолимфы подсчитывали одновременно для каждой пробы.
Для светооптических исследований был использован микроскоп Nikon C1. Измерения объектов проводили традиционным способом с использованием объективов ×25, ×40 и ×60. Фотоработы были выполнены на оптической системе Nicon. Для компьютерной обработки материала использовали следующие программы: Word 2003, Excel 2003.
Результаты и их обсуждение
Гемоциты моллюсков очень разнообразны, их количество и модификации могут существенно меняться в зависимости от условий окружающей среды и физиологического статуса животного. Несмотря на поступательное развитие исследований гемоцитов моллюсков, к настоящему времени не сложилось какой-либо однородной и удовлетворительной системы классификации форменных элементов гемолимфы. Такая ситуация возникла из-за некоторых противоречий при определении критериев классификации. Критерии могут быть морфологические или функциональные.
С функциональной точки зрения различают следующие типы клеток: стволовые клетки, фагоцитирующие клетки, гемостатически активные клетки и трофические клетки [3].
При использовании морфологических критериев выделяют два типа клеток: круглые клетки и клетки, образующие псевдоподии [6].
Предлагаемые нами критерии классификации гемоцитов предполагали морфологические и функциональные характеристики. Было выявлено два основных типа клеток: гемоциты типа I и гемоциты типа II.
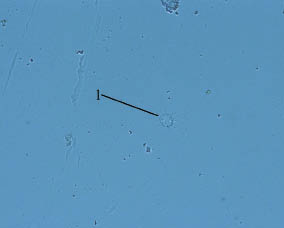
Гемоциты типа I представляют собой популяцию полиморфных клеток. Они могут быть сферическими или овальными и способны к формированию многочисленных псевдоподий. Псевдоподии обычно имеют форму длинных филоподий, чаще всего равномерно распределенных по периферии клетки (рис. 1).
В нативном препарате гемоциты типа I за время наблюдения распластываются на субстрате, изменяя форму и перемещаясь относительно первоначального места прикрепления. На окрашенных мазках хорошо выражено эксцентрично расположенное ядро, овальное или имеющее форму почки. При окраске выявлена чувствительность ядра к кислым красителям, вследствие чего наблюдается интенсивное розовое окрашивание. Цитоплазма клеток окрашивается слабо, обычно содержит несколько базофильных гранул. Способность гемоцитов типа I к распластыванию на субстрате и адгезии к другим клеткам подтверждает их основную роль в процессах инкапсуляции чужеродных объектов.
Псевдоподии клеток типа I содержат специальные поддерживающие структуры, которые обнаруживаются в клетках представителей и других видов брюхоногих моллюсков.
Следует отметить, что гемоциты типа I демонстрируют тенденцию формировать скопления и даже агрегаты из 10‒12 клеток, что можно рассматривать как участие в регенеративных и иммунных реакциях, а также как реализацию гемостатической функции.
Гемоциты типа II имеют преимущественно овальную форму, у некоторых выявлено образование коротких псевдоподий. Ядра окрашиваются кислыми красителями и окружены тонким слоем гомогенной цитоплазмы, содержащей многочисленные базофильно окрашенные гранулы. Клетки типа II медленно закрепляются на субстрате и в течение времени наблюдения практически не меняют свою форму.
Количество гемоцитов обеих категорий зависит от различных факторов. В частности, число клеток отличается в пробах гемолимфы, взятой из различных частей тела: проба, полученная из ноги, содержит в два раза меньше гемоцитов, чем проба, полученная из сердца. Кроме того, на количестве гемоцитов отражается и возраст животного: чем старше организм, тем большее число клеток гемолимфы содержится в его внутренней среде. С возрастом моллюски подвергаются влиянию большего количества антигенов, что вызывает возрастание числа функционально активных клеток. Если рассматривать соотношение гемоцитов типа I и гемоцитов типа II в гемолимфе Helix pomatia, то видно, что оно составляет 90 % типа I и 10 % типа II.
Гемоциты Helix pomatia сохраняют жизнеспособность во влажной камере в течение 2‒4 часов, в зависимости от объема пробы и физиологического состояния моллюска. В дальнейшем происходит гибель клеток гемолимфы.
При инкубировании во влажной камере среди гемоцитов преобладают крупные клетки с ядрами, идентифицированные нами как клетки типа I. Морфологически похожие клетки были описаны ранее в составе капсул вокруг дегенерирующих спороцист и трансплантатов тканей [5]. Высказано предположение, что такие гемоциты более устойчивы к патологическим изменениям, происходящим в организме зараженного моллюска [4]. Они же оказываются наиболее жизнеспособными при инкубировании, в условиях накопления продуктов обмена веществ. Можно предположить, что крупные гранулоциты являются специализированной группой гемоцитов, участвующих в процессах инкапсуляции.
При изучении гемоцитов in vitro нами отмечена широкая вариабельность не только размеров, но и формы клеток: на протяжении нескольких часов они могут менять форму, размер и количество псевдоподий. Это подтверждает принадлежность описанных ранее морфотипов гемоцитов к одному клеточному типу, хотя и весьма полиморфному.
Дополнительно был выполнен анализ корреляции между размерами моллюска и соотношением гемоцитов типа I и гемоцитов типа II в циркуляции. Установлено наличие достоверной отрицательной корреляции между этими параметрами. У мелких особей клеток типа I меньше, а клеток типа II больше, чем у более крупных моллюсков.
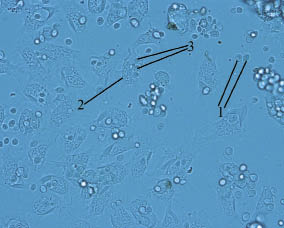
Для исследования фагоцитарной активности гемоцитов in vitro использовали культуру клеток Saccharomyces cerevisiae. Видеосъемка нативного препарата в течение 20 минут показала, что за этот период около 80 % дрожжевых клеток было фагоцитировано. Наиболее активно в процессе фагоцитоза участвовали клетки типа I, в то время как гемоциты типа II большей частью участвовали в процессах адгезии клеток Saccharomyces cerevisiae на своей поверхности (рис. 2). В результате были образованы агрегаты клеток типа II и дрожжевых клеток, что существенно ограничивало подвижность
дрожжей.
Заключение
Детальное изучение клеточного иммунитета моллюсков по-прежнему дает неоднозначные результаты. К настоящему времени имеются данные о существовании клеточных реакций, их участии в подавлении развития паразитов, однако сведения о характере и динамике этих процессов разноречивы.
Список литературы
Рецензенты:
Викулов А.Д., д.б.н., профессор, декан факультета физической культуры ГОУ ВПО «Ярославский государственный педагогической университет им. К.Д. Ушинского», Ярославль;
Капустин Р.Ф., д.б.н., доцент, профессор кафедры морфологии и физиологии ФГОУ ВПО «Белгородская государственная сельскохозяйственная академия» Министерства сельского хозяйства РФ, Белгородская обл.