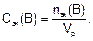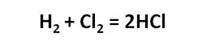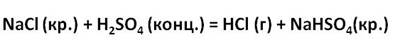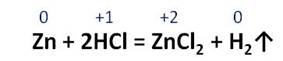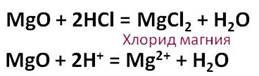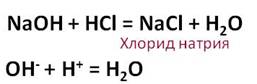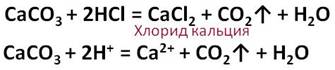Что такое галогеноводородные кислоты
Что такое галогеноводородные кислоты
Соединения галогенов с водородом HHal называются галогеноводородами. Это бесцветные газы, с резким запахом, хорошо растворимые в воде. С ростом массы и размеров молекул усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры плавления и кипения. Для фтороводорода они имеют аномально высокие значения за счет образования водородных связей между молекулами HF. Для остальных галогеноводородов образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
Химические свойства галогеноводородных кислот и их солей
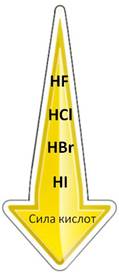
Галогеноводороды очень хорошо растворимы в воде, например, в 1 объеме воды при 0 °С растворяется 507 объемов хлороводорода и 612 объемов бромоводорода. Высокая растворимость в воде позволяет получать концентрированные растворы. При растворении в воде галогеноводороды диссоциируют по типу кислот. Фтороводородная кислота относится к числу слабых, остальные галогеноводородные кислоты – сильные. Сила кислот в ряду HF – HCl – HBr – HI возрастает, что объясняется уменьшением в этом же направлении энергии связи и увеличением межъядерного расстояния. HI – самая сильная кислота.
Водным растворам галогеноводородов присущи все свойства сильных кислот, они реагируют с металлами, оксидами металлов, основаниями. Поскольку отрицательные ионы галогенов могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов водорода, поэтому кислоты реагируют только с металлами, стоящими в ряду напряжений левее водорода.
В отличие от других кислот фтороводородная кислота разрушает стекло и силикаты:
Галогениды неметаллов, такие как SiCl4 и SF6, являются типичными ковалентными соединениями и, как правило, состоят из молекул.
Галогениды металлов являются типичными солями. Имеют ионный тип химической связи и ионную кристаллическую решетку.
Многие безводные галогениды переходных металлов имеют полимерное строение, связь металл-галоген является преимущественно ковалентной.
Ионные галогениды не гидролизуют, исключение составляют фториды, которые реагируют с водой по схеме:
Все галогениды металлов, за исключением солей серебра и свинца, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию:
как качественную для обнаружения ионов галогенов 
§ 31. Соединения галогенов
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 31. Соединения галогенов |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 19 Декабрь 2021, 07:05 |
Оглавление
Хлороводородная (соляная) кислота HCl — крупнотоннажный продукт химической промышленности. Oна является водным раствором хлороводорода, который представляет собой бесцветный газ с резким запахом. Растворимость HCl при 20 °С составляет около 450 объёмов на 1 объём воды.
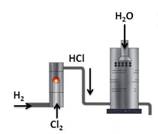
В промышленности соляную кислоту получают растворением в воде хлороводорода. При этом хлороводород синтезируют из простых веществ:
В лабораторных условиях хлороводород получают действием концентрированной серной кислоты на хлориды (NaCl или KCl) при нагревании ( рис. 71 ):
Химические свойства. Являясь сильным электролитом, хлороводородная кислота диссоциирует с образованием ионов водорода и хлорид-ионов:
и обладает всеми общими свойствами кислот: действует на индикаторы и образует соли (хлориды) при взаимодействии с металлами (1), основными и амфотерными оксидами (2), гидроксидами металлов (3), солями (4):
1. Реакции окисления хлорид-ионов. Ион хлора в составе хлороводородной кислоты имеет низшую степень окисления –1 и способен её повышать при потере электронов. Значит, за счёт ионов хлора кислота является восстановителем. Например, для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, КМnO4, КClO3):
Действие нитрата серебра(I) приводит к образованию белого творожистого осадка AgCl, что используют как тест (качественная реакция) на хлорид-ионы ( Приложение 3 ).
Сопоставление свойств галогеноводородных кислот и их солей
Таблица 23. Галогеноводороды
| Галогеноводороды | HF | HCl | HBr | HI |
| Длина связи, нм | 0,092 | 0,128 | 0,141 | 0,161 |
| Энергия связи, кДж/моль | 565 | 431 | 364 | 297 |
| Температура плавления, °С | –83 | –114 | –87 | –51 |
| Температура кипения, °С | 19,5 | –85 | –67 | –35 |
| Агрегатное состояние (при н. у. ) | Жидкость | Газ | Газ | Газ |
Плавиковая (фтороводородная) кислота способна разрушать («плавить») стекло Na2O ∙ CaO ∙ 6SiO2 в соответствии с уравнением:
Эти осадки не растворяются в азотной кислоте.
Нитрат серебра(I) не образует осадка с растворимыми фторидами, поэтому фторид-ионы определяют с помощью раствора CaCl2 ( Приложение 3 ):
CaCl2 + 2NaF = CaF2↓ + 2NaCl; Ca 2+ + 2F – = CaF2↓.
Таблица 24. Качественные реакции на анионы галогеноводородных кислот
Применение галогенов и их соединений
Галогены находят широчайшее применение и как простые вещества, и в виде соединений. Это иллюстрируют данные таблицы 25.
Таблица 25. Применение галогенов и некоторых их соединений
| Галоген | Соединение | Важнейшие области применения |
| Фтор | Na3[AlF6] (криолит) | Производство алюминия |
| NaF (фторид натрия) | Добавка к зубным пастам. Медицинский препарат | |
| НF (плавиковая кислота) | Стекольная промышленность. Производство алюминия | |
| Термостойкий полимер. Антипригарное покрытие для сковородок, утюгов | ||
| Хлор | Cl2 (хлор) | |
| NaClO (гипохлорит натрия) | Компонент отбеливающих средств | |
| НCl (соляная кислота) | Химическая промышленность | |
| NaCl (галит) | Пищевая добавка. Сырьё для производства хлора, натрия, гидроксида натрия | |
| Бром | Br2 (бром) | Органический синтез: производство антипиренов (ингибиторы горения), каучука, средств защиты растений. Производство медицинских препаратов |
| Йод | I2 (йод) | Медицина — спиртовой раствор ( 5–10 % ). Фармацевтическая промышленность |
Хлор содержится в очень опасном для жизни и здоровья веществе — диоксине, который может образоваться в результате реакций органических веществ и хлора при повышенной температуре. Органические соединения хлора и фтора (например, фреоны) учёные считают одной из причин разрушения озонового слоя Земли.
Растворы галогеноводородов являются кислотами.
Хлороводород получают синтезом из простых веществ либо действием концентрированной серной кислоты на твёрдый хлорид натрия.
Соляная кислота является окислителем за счёт водорода и восстановителем за счёт хлора.
Обнаружить хлорид-, бромид- и йодид-ионы можно с помощью раствора нитрата серебра(I). Нерастворимые галогениды серебра различаются цветом: AgCl — белый, AgBr — светло-жёлтый, AgI — жёлтый.
Вопросы, задания, задачи
1. Запишите химические формулы и назовите агрегатное состояние галогеноводородов при нормальных условиях.
2. Из перечня Mg(OH)2, FeCl2, FeCl3, Fe(NO3)3, HBr, HCl, MgCl2, ZnSO4 выпишите формулы и назовите вещества, которые при действии раствора AgNO3 образуют белый творожистый осадок.
3. Определите степени окисления атомов в соединениях: KClO3, HClO4, Cl2, KCl. В котором из них атомы хлора могут выступать только в роли восстановителя?
6. Запишите химические формулы веществ, реагирующих с соляной кислотой: медь, оксид меди(II), оксид кальция, оксид углерода(IV), железо, гидроксид цинка, сульфат натрия, карбонат натрия. Объясните свой выбор. Составьте уравнения соответствующих реакций.
7. Предложите план экспериментального определения растворов йодида калия, бромида натрия и фторида натрия, находящихся в пронумерованных пробирках, используя:
Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
1. Самой слабой кислотой является:
2. Водный раствор фтороводорода содержит частицы:
3. Соляная кислота реагирует с:
4. Белый творожистый и жёлтый осадок соответственно при взаимодействии с нитратом серебра(I) образуют:
5. Газообразный хлороводород можно получить взаимодействием:
Галогеноводородные кислоты



Фтороводород
CaF2 + H2SO4 = 2HF + CaSO4
SiO2 + 4HF = SiF4 + 2H2O
Хлороводород. Соляная кислота
Бесцветный газ с резким запахом, на воздухе дымит, образуя с парами волы мельчайшие капли соляной кислоты. Связь H-Cl полярная ковалентная. В сухом виде HCl не имеет кислотных свойств, не проводит электрический ток, не взаимодействует с металлами и сухим аммиаком, сжиженный хлороводород не изменяют цвет индикаторов. Кислотные свойства появляются только в присутствии воды (хотя бы в виде паров). Водный раствор хлороводорода называется соляной кислотой
Кислота-неокислитель. Активные металлы вытесняют из соляной кислоты водород (окислитель ионы водорода), а малоактивные металлы с ней не взаимодействуют
Взаимодействует с основными оксидами и основаниями с образованием солей, как сильная кислота вытесняет слабые кислоты из их солей
Бромоводород
Иодоводород
Галогени́ды (галоиды) — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным; так, оксид брома не является галогенидом.
По участвующему в соединении галогену галогениды также называются фторидами, хлоридами, бромидами, иодидами
В галогенидах галоген имеет отрицательную степень окисления, а элемент — положительную. Галогенидов не образуют Не, Ne и Аг.
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные.
Биологическая роль галогенов:
Фтор
В качестве микроэлемента фтор входит в состав всех организмов. У животных и человека фтор присутствует в костной ткани (у человека — 0,2-1,2%) и, особенно, в дентине и эмали зубов. В организме среднего человека (масса тела 70 кг) содержится 2,6 г фтора; суточная потребность составляет 2-3 мг и удовлетворяется, главным образом, с питьевой водой. Недостаток фтора приводит к кариесу зубов. Поэтому соединения фтора добавляют в зубные пасты, иногда вводят в состав питьевой воды. Избыток фтора в воде, однако, тоже вреден для здоровья. Он приводит к флюорозу — изменению структуры эмали и костной ткани, деформации костей. ПДК для содержания в воде фторид-ионов составляет 0,7 мг/л. ПДК газообразного фтора в воздухе 0,03 мг/м3. Роль фтора в растениях неясна.
Бром
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Соединения брома участвуют в деятельности клеток иммунной системы. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи. Железы внутренней секреции, гипофиз, восстанавливает равновесия процессов возбуждения и торможения.
Аналитические реакции:
1. NaCl + AgNO3 = AgCl↓ + NaNO3 (белый творожистый)
2. NaBr + AgNO3 = AgBr↓ + NaNO3 (бело-желтый)
3. NaI + AgNO3 = AgI↓ + NaNO3 (желтый)
4. 2KF + CaCl2 → 2KCl + CaF2↓ (белый)
Титриметрический анализ (титрование) — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки.
Анализ основан на точном измерении количества реактива, израсходованного на реакцию с определенным веществом. К раствору, приготовленному из навески анализируемого вещества, постепенно приливают раствор точно известной концентрации до тех пор, пока они полностью не прореагируют. На основании точного измерения объема реактива вычисляют содержание определенного вещества.
Химический эквивалент вещества –условная единица, соответствующая либо числу протонов (Н+), либо числу групп ОН, либо числу электронов (реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-основных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях).
Молярная концентрация эквивалента (нормальность) показывает, какое количество моль эквивалентов растворенного вещества содержится в 1 л раствора.
Молярную концентрацию эквивалента Сэк(В) находят как отношение количества эквивалентов вещества nэк(В) к объему раствора Vp
Закон эквивалентов: отношения масс, вступающих в химическое взаимодействие веществ, равны или кратны их химическим эквивалентам.
m1f1 = m2f2
Точка эквивалентности (конечная точка титрования) в титриметрическом анализе момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
Фиксирование:
Кислотно-основное титрование – титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации.
H3O + OH = 2H2O
Титрование раствором щелочи – алкалиметрия, раствором кислоты – ацидиметрия.
При количественном определении кислот рабочим раствором являются NaOH and KOH. При количественном определении щелочи – H2SO4 and HCl.
Если титровать раствор кислоты раствором щелочи, то происходит связывание ионов Н+ кислоты ионами ОН- и концентрация ионов Н+ постепенно уменьшается, рН раствора возрастает. При определении значения рН достигается точка эквивалентности и титрование должно быть закончено.
При титровании раствором щелочи связываются ионы ОН, концентрация ионов Н+ увеличивается и рН раствора уменьшается.
Индикатор— это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ее.
Кислотно-основной индикатор сам является кислотой или основанием и при кислотно-основном титровании изменяет свою окраску в точке эквивалентности или вблизи ее.
В реакции нейтрализации при достижении точки эквивалентности происходит изменение значения рН раствора. Поэтому для фиксирования точки эквивалентности используют вещества – индикаторы, окраска которых меняется в зависимости от изменения рН.
Галогеноводороды
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов:
Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Сокращённо галогеноводороды обозначают НГ, а в источниках на языках, использующих латинский алфавит, — HHal.
| соединение | формула | модель | молярная масса | длина связи d(H−X)/pm (газ) | дипольный момент μ/D | ΔG°f | tплав °C | tкип °C |
|---|---|---|---|---|---|---|---|---|
| фтороводород | HF |  | 20 | 91,7 | 1,86 | −270,7 | −83,4 | 19,5 |
| хлороводород | HCl |  | 36,5 | 127,4 | 1,11 | −92,3 | −114,2 | −85,1 |
| бромоводород | HBr |  | 81 | 141,4 | 0,79 | −36,3 | −86,9 | −66,8 |
| иодоводород | HI |  | 128 | 160,9 | 0,38 | 26,6 | −50,8 | −35,4 |
В ряду HCl — HBr — HI закономерно изменяются температуры плавления и кипения, но при переходе к HF они резко возрастают. Это объясняется ассоциацией молекул фтороводорода в результате образования водородных связей.
Химические свойства
Галогеноводороды хлора, брома, йода при обычных условиях — газы. Хорошо растворимы в воде, при растворении протекают следующие процессы:
Процесс растворения сильно экзотермичен. С водой HCl, HBr и HI образуют азеотропные смеси, которые содержат соответственно 20,24; 48; 57 % НГ.
Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается:



Иодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения иода постепенно принимает бурую окраску:
Аналогичный процесс протекает и в водном растворе HBr, но намного медленнее.
Растворы галогенов — сильные кислоты, в которых ион H + выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, потенциал которых − (в меньшей степени Br − ) хорошие комплексообразователи, HI может реагировать даже с серебром (E 0 = +0,8 В).
Фтороводород легко образует полимеры типа (HF)n
Методы получения
Вытеснение из солей сильными кислотами:
Хлор реагирует с водородом бурно, со взрывом, но реакцию необходимо инициировать (путём нагревания или освещения), что связано с её цепным механизмом.
Взаимодействие водорода с бромом и иодом также включает цепные процессы, но реакция с бромом протекает медленно, а с иодом идёт лишь при нагревании и не доходит до конца, поскольку в системе устанавливается равновесие. Этой закономерности соответствует и изменение ΔH°f.
Соединения галогенов
Урок 18. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Соединения галогенов»
Среди соединений галогенов следует выделить галогеноводороды. Само название говорит о том, что в состав этих соединений входят атомы водорода и галогена.
Галогеноводороды представляют собой бесцветные газы, с резким запахом, они токсичны, очень хорошо растворяются в воде с образование соответствующих кислот.
Если растворить хлороводород в воде с лакмусом, то лакмус изменит свою окраску с фиолетовой на красную.
Галогеноводороды дымятся во влажном воздухе, потому что притягивают к себе водяные пары, находящиеся в воздухе, образуя, при это, туманное облако.
Растворы галогеноводородов в воде являются кислотами. Так, HF – фтороводородная, или плавиковая кислота, HCl – хлороводородная, или соляная кислота, HBr – бромоводородная кислота, а HI – йодоводородная кислота.
В ряду от плавиковой до йодоводородной кислоты сила кислот увеличивается, так как увеличивается их способность к электролитической диссоциации с образованием ионов водорода. Самая слабая из этих кислот плавиковая, а самая сильная – йодоводородная. В HF расстояние между ядрами атомов маленькое, радиус атома фтора тоже, поэтому прочность связи высокая, поэтому и способность к диссоциации небольшая, а у HI радиусы атомов большие, расстояние между ядрами атомов тоже, поэтому эта кислота легко диссоциирует на ионы.
Наибольшее значение имеет хлороводород и соляная кислота. В промышленности хлороводород получают синтезом водорода и хлора.
А в лаборатории хлороводород получают действием концентрированной серной кислоты на кристаллический хлорид натрия.
Соляная кислота – это бесцветная жидкость, дымящаяся на воздухе. Тяжелее воды. В химических реакциях она проявляет свойства типичных кислот.
Соляная кислота реагирует с металлами, стоящими в ряду напряжений металлов до водорода. В реакции соляной кислоты с цинком образуется соль – хлорид цинка и газ – водород.
Это окислительно-восстановительная реакция, в которой атом цинка повышает свою степень окисления с 0 до +2, поэтому цинк – восстановитель, водород понижает свою степень окисления с +1 до 0, поэтому водород – окислитель.
Соляная кислота взаимодействует с основными оксидами. Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.
Соляная кислота реагирует с основаниями. В этих реакциях образуется соль и вода.
В результате взаимодействия гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
Соляная кислота реагирует с солями слабых кислот. Так в реакции соляной кислоты с карбонатом кальция образуется новая соль – хлорид кальция и слабая кислота – угольная, которая распадается на углекислый газ и воду.
Соляная кислота имеет большое значение. Её применяют для очистки поверхности металлов, при паянии, получении солей, в производстве пластмасс и других синтетических материалов, в получении лекарственных препаратов и красок.
Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде. Для определения в растворе хлорид-, бромид- и йодид-ионов используют нитрат серебра. В результате взаимодействия иона серебра и хлорид-иона выпадает белый творожистый осадок хлорида серебра.
В результате взаимодействия иона серебра с бромид-ионом образуется осадок светло-жёлтого цвета.
В реакции иона серебра с йодид-ионом образуется осадок жёлтого цвета.
Для распознавания фторид-иона используют ионы кальция, потому что фторид серебра – это растворимая в воде соль. В результате этой реакции выпадает осадок – фторид кальция – белого цвета.
Плавиковая кислота обладает уникальным свойством: при взаимодействии с оксидом кремния (IV), который входит в состав стекла, она плавит его.
Эту реакцию используют для изготовления надписей и рисунков на стекле. На стекло наносят тонкий слой парафина, по которому процарапывают рисунок, а затем изделие погружают в раствор плавиковой кислоты. Некоторые художники это свойство используют при написании своих картин.
Галогены в природе существуют только в связанном виде. Наиболее распространены хлор и фтор. Важнейшее природное соединение хлора – галит – NaCl. Кроме галита, встречается и природный хлорид калия – KCl. Он входит в состав минерала сильвина и сильвинита.
Фтор входит в состав природного минерала – флюорита или плавикового шпата – CaF2.
Бром и йод своих минералов не образуют, они сконцентрированы в водах океанов и морей, в водорослях.