Что такое дыхательный пигмент и где он находится
ДЫХАТЕЛЬНЫЕ ПИГМЕНТЫ
Дыхательные пигменты (лат. pigmentum краска) — окрашенные органические вещества различного химического строения, способные в зависимости от условий связывать или освобождать молекулярный кислород. В организме человека и животных Дыхательные пигменты осуществляют транспорт кислорода от органов дыхания к тканям и принимают участие в процессах биологического окисления и в окислительно-восстановительных процессах. Главными из Дыхательных пигментов являются дыхательные белки и дыхательные ферменты (см.).
Использование растворенного в воде кислорода одноклеточными или низшими многоклеточными животными организмами, обитающими в водной среде, осуществляется в результате его диффузии через клеточные мембраны. У более сложно организованных животных обеспечение организма кислородом происходит с помощью специальных дыхательных белков, переносящих кислород от органов дыхания к тканям. К таким белкам относятся гемоглобин (см.), эритрокруорин, хлорокруорин, гемэритрин, гемоцианин, геликорубин. Миоглобин (см.) не способен переносить кислород, но участвует в его депонировании.
Дыхательные пигменты представляют собой сложные белки — хромопротеиды (см.), молекулы которых состоят из простого белка и небелковой окрашенной простетической группы.
У многих Д. п. простетической группой является железопорфириновый комплекс — гем. У позвоночных гемсодержащими дыхательными пигментами являются гемоглобин, находящийся в эритроцитах и осуществляющий связывание, транспорт и высвобождение кислорода в тканях, и миоглобин, с помощью к-рого в мышцах резервируется кислород в количествах, достаточных для осуществления механической работы, производимой мышцами. Во внутриклеточном депонировании кислорода, кроме миоглобина, по-видимому, принимают участие находящиеся в клетках каротиноиды (см.), причем роль этих пигментов повышается в условиях гипоксии и при старении организма.
Более многочисленными и разнообразными являются Д. п. беспозвоночных животных. Высокомолекулярные гемоглобиноподобные вещества (мол. вес 400 000—6 700 000), растворенные в гемолимфе кольчатых червей (полихет и олигохет) и моллюсков, получили название эритрокруоринов. Они представляют собой гемсодержащие белки, в состав которых входит от 30 до 400 групп гема. Каждый гем способен связывать одну молекулу кислорода. Молекула эритрокруорина состоит из 12 субъединиц.
Много общего с эритрокруорином имеет хлорокруорин — зеленый пигмент многощетинковых кольчатых червей (Spirographis и родственных им видов). Он содержится в растворенном состоянии в плазме крови.
Хлорокруорин — гемсодержащий белок, гем к-рого отличается от гема гемоглобина наличием формильной группы при втором углеродном атоме протопорфиринового кольца; он носит название спирографиспорфирина или спирографисгемина. Мол. вес хлорокруорина колеблется от 2 750 000 до 3 500 000, содержание железа в нем находится в пределах 0,45—1,2%, молекула состоит из 12 субъединиц и содержит 190 групп хлорокруорогема. Хлорокруорин обладает высоким сродством к кислороду и незначительным — к окиси углерода; кислородная емкость крови кольчатых червей составляет 10%.
Гемэритрин — коричнево-красный Д. п. с мол. весом 66 000, находится внутри клеток, циркулирующих в полостной жидкости некоторых видов беспозвоночных (морские кольчатые черви, гл. обр. Sipunculidae, и др.). Гемэритрин отличается от других дыхательных белков тем, что не содержит гема. Молекула гемэритрина состоит из 8 субъединиц, в каждой из которых находится по 2 атома железа, которые, по всей вероятности, соединяются с атомами серы, входящей в состав белка. Содержание железа колеблется от 0,8 до 1,01%, кислородная емкость составляет ок. 1,6%. Свойство гемэритрина обратимо соединяться с кислородом (каждые 2 атома железа связывают одну молекулу кислорода) обусловлено особым расположением полипептидных цепей в его молекуле.
К Дыхательным пигментам относят также гемсодержащий красный пигмент виноградной улитки — геликорубин, способный к обратимому окислению — восстановлению.
Дыхательные пигменты, содержащие в своей молекуле медь, называются гемоцианинами. Они содержатся в плазме крови многих моллюсков и членистоногих, придавая ей голубую окраску. Гемоцианины представляют собой высокомолекулярные белки (мол. вес колеблется от 500 000 до 10 000 000), содержание меди в них составляет 0,17—0,18% (моллюски) и 0,24—0,26% (членистоногие). Молекулы гемоцианинов имеют одинаковую форму и состоят из 3—6 субъединиц, содержащих значительное количество атомов меди (у гемоцианина омара их 20), которые располагаются парами. Гемоцианины отличаются один от другого по своей растворимости, цвету (от пурпурно-синего до зеленого) и форме кристаллов. Они способны обратимо соединяться с кислородом, причем одна молекула кислорода связывается с двумя атомами одновалентной меди, которые при этом окисляются. Кислородная емкость крови таких моллюсков и членистоногих пропорциональна содержанию в ней меди и количественно меньше, чем кислородная емкость крови позвоночных животных. В крови, ткани печени и других тканях животных обнаружены медьсодержащие белки, не участвующие в переносе кислорода. К таким белкам, являющимся Д. п., относятся гемокупреин и гепатокупреин. Они представляют собой синие пигменты идентичной структуры, в результате чего эти Д. п. получили общее название цитокупреины. Цитокупреин — это белок с мол. весом 32 000; молекула цитокупреина состоит из двух субъединиц, каждая из которых содержит один атом меди и один атом цинка в двухвалентном состоянии. Установлено, что фермент супероксиддисмутаза, катализирующий реакцию дисмутации супероксидных радикалов H2O-, накапливающихся в тканях в ходе окислительных процессов, представляет собой цитокупреин.
Поскольку супероксидные радикалы и некоторые продукты их превращения чрезвычайно токсичны, супероксид-дисмутаза является жизненно необходимым ферментом.
Другой медьсодержащий белок — церулоплазмин (см. Кровь) — играет главную роль в резервировании и транспорте меди у позвоночных животных и человека. Церулоплазмин является не только нетоксическим резервом меди в организме, но и способен также ускорять окисление двухвалентных ионов железа в трехвалентные, т. е. обладает ферроксидазными свойствами, участвует в синтезе гемоглобина и трансферрина (железосвязывающего белка плазмы крови; нормальное содержание его у человека — 250 мг%, при поражении паренхимы печени эта цифра уменьшается).
Церулоплазмин является медьсодержащим альфа-1-глобулином сыворотки крови человека с мол. весом 151 000; на его долю приходится до 0,5% от общего количества белка в плазме крови человека и 90% всей меди плазмы крови. У здорового человека общее содержание меди в плазме крови составляет 70— 140 мкг%. Гиперкупремия и гиперцерулоплазминемия наблюдаются в остром периоде инфекций, протекающих с лихорадкой и распадом клеточных элементов, при заболеваниях печени — гепатитах, циррозах и механических желтухах, при карциноме, лейкемии, анемиях. Гиперцерулоплазминемия отмечается также при беременности.
В сыворотке крови количественное определение церулоплазмина проводят в клин, лабораториях по Равину. Метод основан на том. что церулоплазмин является единственным компонентом сыворотки крови, обладающим оксидазными свойствами, поэтому он катализирует окисление некоторых аминов, в т. ч. парафенилендиаминдигидрохлорида, в результате окисления к-рого образуется вещество сине-фиолетового цвета. Оптическая плотность (см. Колориметрия) р-ра измеряется при 530 нм, и концентрация церулоплазмина, пропорциональная степени окисления используемого субстрата, вычисляется по калибровочной кривой. Зная количество меди в плазме крови, можно также рассчитать содержание церулоплазмина по формуле:
церулоплазмин(мг%) = Cu(мкг%)• 100/0,32
т. к. теоретически содержание меди в церулоплазмине составляет 0,32%.
К Дыхательным пигментам относится также обширная группа флавоновых пигментов, окрашенных в желтый или желто-коричневый цвет и содержащих в своей молекуле ядро флавона (см. Флавоны). Эти пигменты содержатся в основном в растениях. Для животных и человека особое значение имеют производные флавона, близкие по своему хим. строению и биол, активности и являющиеся компонентами капилляроукрепляющего витамина Р. К таким Д. п. относятся гесперидин, рутин, катехин, эпикатехин и их галловые эфиры. Витамин P в животных клетках участвует в окислительно-восстановительных процессах вместе с аскорбиновой к-той, а также является ингибитором ряда ферментов, особенно гиалуронидазы (см.). Рутин способен в определенных условиях стимулировать процессы тканевого дыхания и окислительного фосфорилирования в митохондриях и, по-видимому, участвует в биосинтезе убихинона. Возможно, что катехин, рутин и гесперидин обладают адреналиноподобным действием.
Большая Энциклопедия Нефти и Газа
Дыхательный пигмент
Дыхательный пигмент асцидий содержит ванадий. [2]
Свойства различных дыхательных пигментов и распространение их в животном мире подробно рассматриваются в любом достаточно полном учебнике физиологии, и поэтому здесь мы можем не останавливаться на них. [3]
Большие концентрации дыхательных пигментов встречаются не только в крови. Эти нециркулирующие дыхательные пигменты обладают более высоким сродством к кислороду, чем циркулирующие пигменты ( рис. 112); однако наибольшее сродство к 02 обнаруживают дыхательные ферменты, например цитохромы, для работы которых в конечном счете и предназначается молекулярный кислород. Таким образом, нсциркулирующие пигменты, подобные миоглобину, облегчают перенос кислорода из крови к окислительным ферментам. [6]
Эти соединения служат пигментами крови или дыхательными пигментами у очень небольшого числа беспозвоночных. [11]
Рыбам, как и всем позвоночным, в качестве дыхательного пигмента свойствен гемоглобин. Известно лишь небольшое число видов ( преимущественно антарктические Chaenichthydae), кровь которых полностью лишена гемоглобина и весь кислород транспортируется только в плазме. Исследование одного из таких видов ( ледяная рыба СНаепо-cephala aceratus) показало, что эти рыбы обитают в хорошо аэрированных холодных водах, ведут довольно пассивный образ жизни и обладают низким уровнем обмена веществ. Для них характерна обильная васкуляризация жабр, повышенная роль кожного газообмена и увеличенная скорость кровотока в жаберных сосудах При всем этом ледяная рыба, как и другие безгемоглобиновые формы, весьма неустойчива к гипоксии. [15]
Что такое дыхательный пигмент и где он находится
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
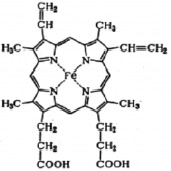
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].
Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HbA – это «зрелый» гемоглобин, который имеется у каждого человека. При рождении его содержание составляет 80 %, а затем повышается до 95–98 %.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
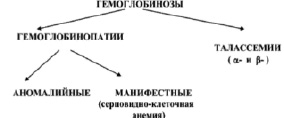
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].
Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Синдром матового стекла, обнаруживаемый в легких на КТ – это скопление [8], атакованного вирусом и утратившего способность к переноске кислорода [8]. Ученые обнаружили, что у пациентов наблюдается низкий уровень ферритина – белка, который является «хранилищем» железа в организме. На фоне недостаточного количества ферритина развивается анемия.
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
MetHb может образовываться как побочный продукт физиологической реакции в виде адаптивной повышенной передачи сигналов оксида азота (NO) вследствие острой анемии. Анемия может быть связана с инфекцией или системной воспалительной реакцией, называемой «анемией воспаления», как часть физиологической реакции на заболевание [9]. Согласно исследованию Bellmann-Weiler et al. [9] из 259 госпитализированных пациентов с COVID-19 24,7 % были анемичны при поступлении, причем большинство страдало воспалительной анемией (68,8 %). Во время госпитализации процент пациентов с анемией увеличился (около 68,8 % на 7-й день). Значительно более высокая смертность во время госпитализации была также обнаружена у пациентов с анемией при поступлении. Анемия связана с повышенной концентрацией NO, приводящей к вазодилатации. Она предотвращала тканевую гипоксию, но в то же время вызывала NO-основанное окисление Hb в MetHb. MetHb активирует путь NF-kB в эндотелиальных клетках, связанный с продукцией хемокинов (IL-8) и цитокинов (IL-6). Активация путей NF-kB и MAPK с последующим высвобождением хемокинов IL-8 и хемокинового моноцитарного хемоаттрактантного белка-1 (MCP-1) также наблюдалась в эндотелиальных клетках, подвергнутых воздействию MetHb [8]. Это подчеркивает, что повышение уровня MetHb в крови оказывает влияние на выработку цитокинов/хемокинов – факт, который может иметь особое значение для COVID-19, поскольку при тяжелом течении заболевания наблюдается «цитокиновый шторм». И следует иметь в виду, что гипоксия также вызывает выработку IL-8 и IL-6 [9].
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.