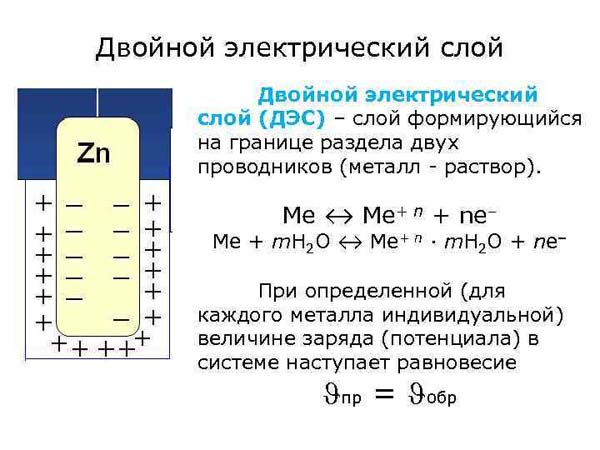
Что такое двойной электрический слой
Дзета-потенциал. Двойной электрический слой.
В дисперсных системах на поверхности частиц (на границе раздела частица-дисперсионная среда) возникает двойной электрический слой (ДЭС). Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд. Эти ионы называют потенциалопределяющими (ПОИ). К поверхности частицы из жидкой среды притягиваются ионы противоположного знака, их называют противоионами (ПИ).
Таким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде. Слой противоионов состоит из двух слоев:
Теории двойного электрического слоя широко используются для интерпретации поверхностных явлений. Однако не существует прямых методов измерения потенциалов на границе адсорбционного слоя. Для количественного определения величины электрического заряда в двойном электрическом слое широко используется дзета-потенциал. Дзета-потенциал не равен адсорбционному потенциалу или поверхностному потенциалу в двойном электрическом слое. Тем не менее, дзета-потенциал часто является единственным доступным способом для оценки свойств двойного электрического слоя. Знание дзета-потенциала важно во многих областях производственной и исследовательской деятельности.
Строение двойного электрического слоя
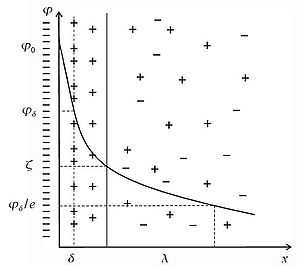
Образование двойного электрического слоя приводит к появлению электрического потенциала, который убывает с расстоянием, и его значение в разных точках соответствует:
Важность определения дзета-потенциала
Важность дзета-потенциала состоит в том, что его значение может быть связано с устойчивостью коллоидных дисперсий. Дзета-потенциал определяет степень и характер взаимодействия между частицами дисперсной системы.
Для молекул и частиц, которые достаточно малы, высокий дзета-потенциал будет означать стабильность, т.е. раствор или дисперсия будет устойчивы по отношению к агрегации. Когда дзета-потенциал низкий, притяжение превышает отталкивание, и устойчивость дисперсии будет нарушаться. Так, коллоиды с высоким дзета-потенциалом являются электрически стабилизированными, в то время, как коллоиды с низким дзета-потенциалом склонны коагулировать или флокулировать.
Значение дзета-потенциала равное 30 мВ (положительное или отрицательное) можно рассматривать как характерное значение, для условного разделения низко-заряженных поверхностей и высоко-заряженных поверхностей. Чем больше электрокинетический потенциал, тем устойчивее коллоид.
Двойной электрический слой
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Механизм образования ДЭС
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
Строение ДЭС
В отсутствие теплового движения частиц, строение двойного электрического слоя подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
Электрической характеристикой ДЭС является потенциал φ. Существует несколько характеристических потенциалов:
Ссылки
Полезное
Смотреть что такое «Двойной электрический слой» в других словарях:
двойной электрический слой — – тонкий слой, образующийся на границе двух фаз из пространственно разделенных электрических зарядов противоположного знака, что сопровождается возникновением электрической разности потенциалов. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности. Возникает на границе раздела двух фаз. Строение слоя существенно влияет на механизм и кинетику электро химических… … Большой Энциклопедический словарь
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — совокупность электрич. зарядов противоположных знаков, распределённых вдоль границы соприкосновения двух фаз. В образовании Д. э. с. могут принимать участие эл ны, ионы и ориентированные полярные (обладающие собств. дипольным моментом) молекулы.… … Физическая энциклопедия
Двойной электрический слой — два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический… … Большая советская энциклопедия
двойной электрический слой — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, например твердого электрода и жидкости … Энциклопедический словарь
двойной электрический слой — Термин двойной электрический слой Термин на английском electrical double layer Синонимы double layer Аббревиатуры ДЭС, EDL, DL Связанные термины коллоидная химия, коллоидный раствор, наночастица Определение тонкий поверхностный слой из… … Энциклопедический словарь нанотехнологий
двойной электрический слой — dvigubasis elektrinis sluoksnis statusas T sritis chemija apibrėžtis Du priešingų krūvių sluoksniai fazių sąlyčio riboje. atitikmenys: angl. double electric layer rus. двойной электрический слой … Chemijos terminų aiškinamasis žodynas
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств. разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, Д … Химическая энциклопедия
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрич. зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, напр. тв. электрода и жидкости в… … Естествознание. Энциклопедический словарь
Двойной электрический слой строение
Двойной электрический слой строение граница возникновение образование теория
Двойной электрический слой строение
Электронный Двойной электрический слой обусловлен квантовомех св-вами электронов в металлах и полупроводниках Согласно совр моделям металла как электронного газа и ионного остова электронный Д. э. с связывают с тем, что электронный газ несколько выходит за пределы ионного остова, что и приво дат к пространств разделению зарядов При этом своей положит обкладкой Дэе обращен к металлу, отрицательной-к контактирующей с металлом фазе (р-ру или газу) В полупроводниках из-за малого кол-ва носителей тока (электронов в Зоне проводимости и «дырок» в валентной зоне) при наложении внеш, напряжения возникает их неравномерное пространств, распределение в поверхностном слое, к-рое рассматривают как электронный Двойной электрический слой. внутри полупроводниковой фазы. В общем случае Двойной электрический слой, вызванные разными причинами, накладываются друг на друга, что приводит к весьма сложной структуре границы раздела между Электродом и р-ром.
Двойной электрический слой изучают также с помощью оптич. методов (эллипсометрия, разл. варианты электроотражения света, комбинационное рассеяние в адсорбц. слое и др.). На основе указанных методов можно определить заряд пов-сти электрода q, его зависимость от потенциала электрода Е, потенциал нулевого заряда Eq = 0, электрич. емкость Д. э. с., равную δ q/ δ E, а также поверхностные избытки (адсорбции) разл. компонентов р-ра в зависимости от Е (или q) и их объемной концентрации.
Современная теория Д.э.с., основной вклад в развитие которой внесли работы Г. Гельмгольца (1879), Ж. Гуи (1910), Д. Чапмена (1913), О. Штерна (1924) и Д. Грэма (1947-58), базируется на след, модели ионной обкладки Д.э. с. Благодаря тепловому движению ионы, адсорбировавшиеся на электроде только под действием кулоновских сил, распределяются у пов-сти подобно молекулам газа в земной атмосфере и образуют диффузную часть Д.э.С. Границей диффузной части‘является т. наз. внеш, плоскость Гельмгольца х2 (рис.), до к-рой Могут дойти электрические центры ионов, участвующих в тепловом движении. Между внеш, плоскостью Гельмгольца и пов-стью металла располагается плотная часть Д.э.с., для к-рой характерна диэлектрин, проницаемость существенно меньшая, чем в объеме р-pa. В плотном слое локализуется дипольный Д.э.с, образованный ориентированными диполями р-рителя и орг. растворенного в-ва. Кроме того, в плотную часть Д.э.с. входят специфически адсорбирующиеся ионы; при этом их элект рич. центры образуют т. наз. внутр, плоскость Гельмгольца ХI. В силу электронейтральности границы раздела плотность заряда q на электроде компенсируется зарядами специфически адсорбиров. ионов (qI) и ионов, находящихся в диффузной части Д. э. с. (q2) :q = — qI — q2.
Для развития теории дипольного Д.э.с., связанного с адсорбцией молекул р-рителя, успешно используется зависимость емкости К02, от q. Теоретич. расчеты электронного Д.э.с. пока крайне противоречивы; с целью упрощения принято считать, что скачок потенциала в электронном Д. э. с. металла не зависит от q и потому не вносит вклада в наблюдаемые эффекты.
Изучение св-в и строения Д.э.с. имеет большое значение для понимания и усовершенствования таких практически важных процессов, как электролиз, электроосаждение металлов, электрохим. р-ции в хим. источниках тока, коррозия металлов, коагуляция в коллоидных системах, флотация, ионный обмен и др.