Что такое днк чип
Биологические микрочипы: будущее медицины
Биологические микрочипы (biochips) или, как их чаще называют — DNA microarrays, — это один из новейших инструментов биологии и медицины 21 века. Изобретены биочипы были в конце 90-х годов в России и в США. В настоящее время они активно производятся несколькими американскими биотехнологическими фирмами. Производят биочипы также и в России, в Центре биологических микрочипов Института молекулярной биологии РАН.
Биочипы используются для самых разных целей. Армия США утверждает, что обладает биочипами, позволяющими очень быстро определять наличие в окружающей среде болезнетворных микробов. В медицине биочипы помогают за считанные часы обнаруживать у больных лекарственно устойчивые формы туберкулеза. Еще одно очень важное медицинское применение биочипов — это диагностика лейкозов и других раковых заболеваний. Биочипы позволяют быстро, за считанные дни или даже часы различать внешне неразличимые виды лейкозов. При одних лейкозах пациента можно быстро и эффективно вылечить современными лекарствами. При других — не стоит даже пробовать, надо сразу делать пересадку костного мозга. Врачи не могут быстро отличить эти лейкозы друг от друга, а стратегию лечения надо правильно выбирать с самого начала. Также биочипы позволяют сразу отличить две формы рака груди — легко излечимую и плохо излечимую. Биочипы применяются и для диагностики других видов рака.
Исследователи в университетах и в фармакологических фирмах проводят на чипах одновременный анализ работы тысяч и десятков тысяч генов и сравнивают экспрессию этих генов в здоровых и в раковых клетках. Такие исследования помогают создавать новые лекарственные препараты и быстро выяснять, на какие гены и каким образом эти новые лекарства действуют. Биочипы являются также незаменимым инструментом для биологов, которые могут сразу, за один эксперимент, увидеть влияние различных факторов (лекарств, белков, питания) на работу десятков тысяч генов.
Что же это такое — биочипы? Точнее всего их описывает английское название DNA-microarrays, т.е. это организованное размещение молекул ДНК на специальном носителе. Профессионалы называют этот носитель «платформой». Платформа — это чаще всего пластинка из стекла или пластика (иногда используют и другие материалы, например кремний). В этом смысле чипы биологические близки к чипам электронным, которые и базируются на кремниевых пластинах. Это организованное размещение занимает на платформе очень небольшой участок размером от почтовой марки до визитной карточки, поэтому в названии биочипов присутствует слово micro. Микроскопический размер биочипа позволяет размещать на небольшой площади огромное количество разных молекул ДНК и считывать с этой площади информация с помощью флуоресцентного микроскопа или специального лазерного устройства для чтения.
Способы изготовления биочипов тоже бывают разными. Одна из крупнейших фирм по производству биочипов — Affymetrix — изготовляет биочипы таким же способом, каким изготовляют электронные чипы (и расположена эта фирма в Силиконовой долине, в Калифорнии). Чипы Affymetrix наращиваются прямо из стеклянной пластинки методом фотолитографии с использованием специальных микромасок. Применение отработанных методов электронной промышленности позволило добиться впечатляющих результатов. На одном таком чипе расположены десятки (а иногда и сотни) тысяч пятен размером в несколько микрон. Каждое пятно — это один уникальный фрагмент ДНК длиной в десятки нуклеотидов.
Изготовленный таким образом биочип в дальнейшем гибридизуют с молекулами ДНК, мечеными красителем. Сравнивают, например, ДНК, выделенную из здоровых клеток, и ДНК, выделенную из раковых клеток. Часто сравнивают ДНК, выделенную из разных больных. После гибридизации на биочипе возникают причудливые узоры. Эти узоры бывают разными у нормальных и у раковых клеток или сильно различаются при различных видах лейкозов. Излечимые виды лейкозов дают одни узоры (паттерны), неизлечимые дают совсем другие паттерны. На рисунке 1 можно видеть, как окрашенная ДНК от разных больных образует различные паттерны на биочипе. Болезнь одна и таже, паттерны — разные. По виду паттернов можно с большой вероятностью предсказать течение болезни на самой ранней ее стадии. В данном случае при паттерне типа 1 верятность метастаз равна нулю, при паттерне типа 2 — уже 29%, при паттернах типа 3 и 4 соответственно 75% и 77%.
Биочипы изготавливают не только методом фотолитографии. Другой подход — это когда олигонуклеотиды (относительно короткие фрагменты однонитевой ДНК) синтезируют отдельно, а затем уже пришивают к биочипу. Чипы такого типа изготавливают в разных фирмах, в частности, в Москве, в Институте молекулярной биологии. Биочипы, изготовленные в ИМБ, позволяют различать у больных туберкулезом штаммы, отличные от штаммов устойчивых к антибиотикам. Проблема состоит в том, что у некоторых больных бактерии туберкулеза имеют устойчивость к антибиотику рифампицину и антибиотик не помогает при лечении болезни. У большей части больных бактерии обычные (т.н. дикие штаммы бактерий) и антибиотик помогает. Необходимо знать устойчивость бактерий к антибиотику в самом начале лечения. Если врачи определят устойчивость бактерий через 2–3 месяца после начала лечения, то легкие больного будут уже изрядно повреждены. Традиционные методы определения устойчивости бактерий туберкулеза могут отнять несколько недель. Биочипы позволяют решить эту задачу за 1–2 дня. На рисунке 2 видны различные узоры паттерны гибридизации на российском биочипе двух штаммов туберкулеза: дикого и устойчивого к рифампицину.
На рисунке представлены гибридизационные картины (A, B) и соответствующие им диаграммы интенсивности флуоресцентных сигналов (C, D). A и C — прогибридизована последовательность дикого типа, B и D — последовательность содержит мутацию, приводящую к замене His526>Tyr (показана стрелкой).
Теперь приведем пример новейших специальных разработок в области биочипов. Специалисты из Нортвестернского университета в США разработали для американской армии биочип, обладающий совершенно неожиданными свойствами. Если на этот биочип попадает ДНК от патогенных микробов, то фрагменты ДНК зондов с прикрепленными к ним микроскопическими частицами золота выстраиваются в ряд. Между электродами идет ток и биочип сигнализирует об угрозе. Схема такого биочипа приведена на рисунке. Специальный биочип сигнализирует о наличии бактериальной угрозы после того, как золотые микрочастицы замыкают два электрода.
Сейчас также разрабатывают белковые микрочипы. Но это уже отрасль большой новой науки — протеомики.
Биочипы сегодня — это быстро развивающийся рынок, где работают десятки фирм. Биочипы будут составлять основу биомедицины 21 века.
Александр Крылов, Институт молекулярной биологии РАН
Органы-на-чипе: когда технология сплетается с жизнью
Можем ли мы создать «идеальную модель человека» при помощи технологии органов-на-чипе, и что стоит на нашем пути? Рисунок в полном размере.
Автор
Редакторы
В предыдущих статьях спецпроекта о доклинических исследованиях мы обсудили проведение классических доКИ с использованием клеток (первичных или культур) и животных моделей, рассмотрев в том числе недостатки обоих подходов. Есть ли какая-то альтернатива? По-видимому, да, и лежит она на стыке биологии, химии, физики, инженерии и ИТ. Сегодня мы поговорим о микрофлюидных чипах и их совмещении с клеточной биологией: именно так появляются системы органов-на-чипе, которые рано или поздно не только заменят использование животных, но и помогут получать персонализированные результаты для каждого конкретного пациента.
Доклиника
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
В третьей статье спецпроекта «Доклинические исследования» мы расскажем об одном из новых направлений — попытке смоделировать работу целых органов на маленьких устройствах: микрофлюидных чипах.
В предыдущих частях мы рассмотрели общие принципы доклинических исследований (доКИ) в лекарственной разработке [1] и проведение исследований на клеточных и животных моделях [2].
Клеточные модели — скажем, клетки линии рака молочной железы, — достаточно дешевы и удобны для лабораторной работы, но имеют целый ряд недостатков. Во-первых, все клеточные линии — потомки клеток какого-то определенного пациента, а для стабильности и способности неограниченно делиться их превращают в опухолевые (иммортализуют). Однако из-за этого в них со временем накапливаются различные мутации, и они всё больше и больше отличаются от первичных клеток. Во-вторых, условия культивирования (чашка Петри или инкубатор с питательной средой) сильно отличаются от таковых в организме: отсутствуют межклеточные взаимодействия с другими тканями, нет межклеточного матрикса. По сути, мы исследуем что-то, лишь отдаленно напоминающее организм. В результате молекула, «успешная» на клеточной линии, может не давать нужного эффекта для целого органа и, тем более, целого человека.
Подробнее об исследованиях на людях мы писали в спецпроекте «Клинические исследования».
Здесь тоже есть этические проблемы. Пусть и добровольно, но человек рискует своим здоровьем. При этом есть и еще одна проблема: несмотря на все правила планирования и дизайна объективных исследований, чаще всего его участниками становятся взрослые люди средних лет без серьезных (кроме основного заболевания) проблем со здоровьем. А вот принимать лекарство после его выхода на рынок может понадобиться всем — детям, старикам, беременным женщинам, людям с хроническими заболеваниями. Еще недавно серьезной проблемой было даже то, что исследовали лекарства в основном на мужчинах, из-за чего дозировки и побочные эффекты для женщин были изучены гораздо хуже (см. врезку). Кроме того, есть индивидуальные реакции организма: например, аллергии или другие особенности. Это тот риск, на который приходится идти, оперируя некоторыми усредненными данными. Но даже малая вероятность какого-то побочного эффекта (скажем 1%) означает, что на каждые 99 человек будет 1 пострадавший.
Всегда ли женщин в клинических исследованиях было столько же, сколько и мужчин?
Где-то до 1990-х годов никто не придавал особенного значения соотношению женщин и мужчин в клинических исследованиях, хотя последних было больше. В результате дозировки лекарств были рассчитаны на вес и метаболизм среднестатистического мужчины, да и информация о побочных эффектах была неполной. Между тем в ряде случаев пол имеет большое значение. Например, в 2000 году FDA отозвало препарат троглитазон для лечения диабета, потому что только в ходе его широкого применения выяснилось, что одним из частых побочных эффектов является печеночная недостаточность. и в 67% случаев от нее страдают женщины.
Другим примером стало снотворное золпидем. FDA его одобрило в 1993 году, однако позднее выяснилось, что у женщин наутро в среднем на 25–33% больше препарата в крови, чем у мужчин, что делает небезопасным вождение автомобиля. Этот факт связан с различиями в продукции и активности алкоголь- и альдегиддегидрогеназ, зависящими от пола. Впрочем, скорректированные рекомендованные дозы для женщин были опубликованы только в 2013 году.
Проблема недостаточной представленности женщин в клинических исследованиях была отмечена в середине 90-х годов. Тогда же в США отменили запреты на участие женщин в КИ, а Европейский союз позднее обязал производителей равномерно представлять популяцию. За прошедшие годы ситуация значительно улучшилась, хотя некоторые исследования отмечают, что доля женщин всё еще меньше и составляет не более 43% в среднем по миру, а в некоторых случаях падает и ниже 25%. Впрочем, некоторые авторы показывают, что этого достаточно [3].
Оптимальным решением была бы возможность протестировать лекарство на тканях конкретного пациента перед назначением, чтобы минимизировать риски. И в последнее десятилетие кажется, что человечество скоро к этому придет — появились возможности создания моделей отдельных органов из клеток человека. Так можно было бы не только создать адекватную модель в лаборатории, избежав этических проблем с использованием животных и добровольцев, но и персонализировать область клинических исследований.
Но как выглядит модель органа? Воображение наверняка рисует сердце или почку в банке с питательной средой. Всё не совсем так. Современное моделирование осуществляется в микроформате, а органы на микрофлюидных чипах визуально не похожи на те, которые есть у нас в организме. В этой статье мы разберемся, как выглядят «искусственные органы», как они работают, при чем тут пресловутые чипы и. почему работа с ними может оказаться даже дешевле, чем классические исследования.
Что такое чип? Микрофлюидика и микрочипы
Микрофлюидика, или микрогидродинамика, — это наука, которая описывает поведение микро- и нанообъемов жидкостей в потоке, где основные взаимодействия обеспечиваются ламинарным течением и диффузией. Микрофлюидика находится на стыке физики, гидравлики, динамики, химии, биологии и инженерии. Как самостоятельное научное направление микрофлюидика начала формироваться в 1990-х годах.
Микрофлюидная система, или чип, — это компактное устройство, в котором малые объемы жидкостей перемещаются по каналам размерами в десятки или сотни микрон. Иными словами, чип представляет собой пластину из стекла, кремния или полимерных соединений, в которой вытравлены или отлиты микроканалы. Они имеют разную длину и размеры, а также могут соединяться вместе для достижения желаемых функций: смешивания и разделения потоков, сортировки объектов (например клеток) и других [4].
Микрофлюидика призвана работать с жидкостями, точно контролировать их потоки и анализировать вплоть до пиколитрового объема. Правильный дизайн чипа позволяет автоматизировать пробоподготовку или протекание реакции в микроформате. Сегодня в микрофлюидике (не считая органов-на-чипах, о которых мы поговорим отдельно чуть ниже) одно из наиболее востребованных — это генерация микрокапель и создание эмульсий, пен, гелей и (аэро)золей.
О применении микрофлюидных технологий для создания микрокапель и выделения единичных клеток мы писали в статье «Автоматизация омиксных технологий» [5] спецпроекта «Автоматизация в биологии».
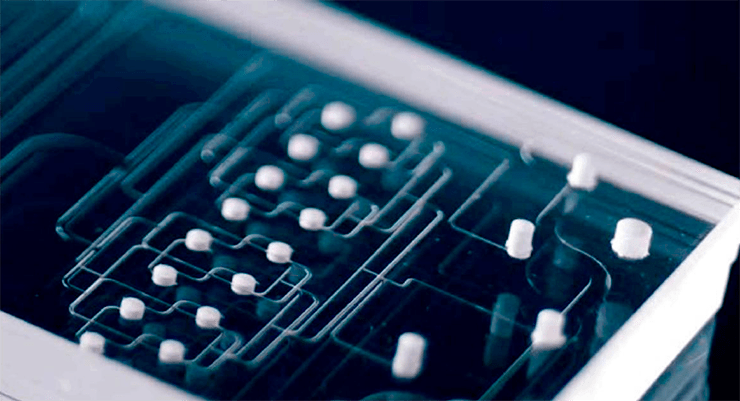
Микрофлюидные технологии нашли применение в фармакологии (проведение реакций, кристаллизация белков, single-cell-анализы), в промышленности (анализ веществ, создание микротопливных водородных элементов), нефтехимии (моделирование токов жидкостей в разных условиях, анализ жидкостей и газов), научных исследованиях (от капиллярного электрофореза на чипах до моделирования систем организма). Микрочипы также активно используются для создания портативных ПЦР-амплификаторов (устройства компаний Novel Microdevices и Minute Molecular), для скрининга лекарственных средств, в геномике и протеомике (рис. 1).
Рисунок 1а. Микрофлюидные устройства для разных задач. Микрофлюидные каналы на чипе.
Рисунок 1б. Микрофлюидные устройства для разных задач. Микрофлюидная генерация капель двойной эмульсии вода-масло-вода.
Рисунок 1в. Микрофлюидные устройства для разных задач. Слева — пример чипа, созданного для культивирования и изучения эмбрионов в течение нескольких дней и позволяющего удерживать их в нужном положении во время длительной съемки, не нарушая процесс культивирования. Справа — эмбрион мыши на стадии четырех клеток (диаметр 120 мкм) при увеличении 40×.
К очевидным плюсам микрофлюидики можно отнести:
Обычно конструирование подразумевает выбор подходящего процесса изготовления, материалов чипа, покрытий поверхности, способов соединения и устройств для подачи жидкости. Все микрофлюидные чипы и соответствующие коннекторы и интерфейсы конструируются с помощью программ для создания трехмерных моделей. Для подтверждения характеристик чипов, таких как смешение жидкости или изменение температуры, проводятся лабораторные испытания. Материал чипа зависит от планируемого применения. Несмотря на то, что стеклянные чипы превосходят полимерные по многим характеристикам (таким как оптические свойства, химическая стойкость, температурная стабильность, долговечность и вариативность покрытий поверхности), полимерные микрочипы тоже нередки. Связано это с тем, что изделия для клинической диагностики чаще всего одноразовые, в этом случае исходя из стоимости производства выгоднее использовать пластик.
Несмотря на всю мощь современного расчетного ПО, создать работающий микрофлюидный чип под любую задачу пока не так-то просто. Для большинства применений правильный дизайн чипа необходимо подбирать методом проб и ошибок, а создание рабочей версии может занять несколько лет. Но зато стоимость изготовления пластиковой основы чипа при массовом производстве может опускаться до 2–3 долларов за штуку — всё зависит от материалов и структуры чипа. Микрофлюидные технологии стремительно развиваются; усложняются и применения этой технологии. В последнее десятилетие идет активное создание микрофлюидных систем для моделирования процессов, проходящих в тканях и органах человека.
Орган-на-чипе: как это возможно?
Несмотря на то, что при словах «орган-на-чипе» воображение рисует миниатюрное сердце или кишечник на пластиковой подложке, система такого рода выглядит совсем иначе (рис. 2). Необходимости в том, чтобы соответствовать форме реального органа, совершенно нет, ведь интересует исследователей совсем другое.
Рисунок 2. Микрофлюидные чипы, имитирующие сердце, кишечник и сосуды (слева направо).
Что отличает клетки в культуре на чашке Петри от клеток в организме? Окружение. Клетки в культуре растут среди лишь себе подобных, не взаимодействуют с другими видами клеток и межклеточным матриксом — вместо этого у них есть питательная среда, которая тоже воспроизводит реальность лишь отдаленно.
Подробнее о ведении и примерах использования 3D-культур читайте в статье «Лекарство в пробирке: доклинические исследования in vitro» [2].
В результате на небольшой пластинке мы уже можем наблюдать тенденции, характерные для всего организма. Любопытно, что несколько органов-на-чипе можно соединить вместе — тогда, к примеру, можно сначала изучить лекарственное действие новой молекулы на нужных тканях, а потом и ее метаболизм в клетках желудка или кишечника!
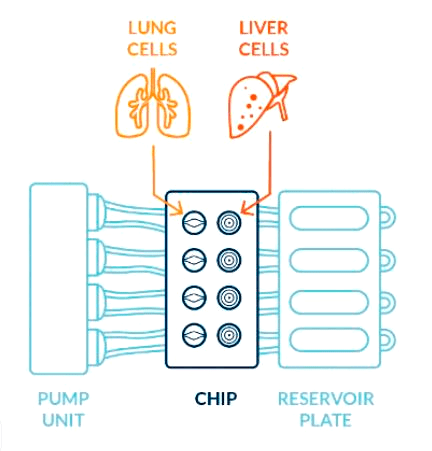
К сожалению, это не так просто, как кажется. Обычно разные чипы требуют разных способов анализа и контроля их работы, поэтому создание универсальных комбинируемых систем — одна из актуальных задач, которую, впрочем, уже пытаются решить, создавая специальные платформы для работы с органами-на-чипах. Эти платформы позволяют соединить два и более органа-на-чипе, например, если необходимо изучить влияние двух разных веществ (видео 1). Таких «повторов» можно сделать несколько десятков и, таким образом, получить огромный массив данных, использовав микроколичества потенциального лекарства и устройство размером с ладонь.
Видео 1. Платформы для работы с микрофлюидными чипами: объединение нескольких органов-на-чипе в одну систему и переход к высокопроизводительным исследованиям.
Примеры органов-на-чипе
Несмотря на то, что идея органов-на-чипах появилась около 10 лет назад, технология еще не получила широкого распространения из-за сложности разработки и зарегулированности фармацевтического рынка: должно пройти немало времени, прежде чем новинке начнут доверять и широко использовать как замену классическим методам клинических исследований. С другой стороны — спрос есть, и он очень велик. Например, не более 14% противоопухолевых препаратов успешно проходят КИ, и связано это в том числе с низкой точностью моделей, используемых в доКИ. Стоимость провала одного потенциального лекарства может превышать 1 миллиард долларов США, или даже 2, если учесть упущенную выгоду от инвестиций, будь они вложены в другой проект.
Компании, занимающиеся разработками, помогающими сократить риск провалов препарата или уменьшить стоимость исследований, получают многомиллионные инвестиции и активно сотрудничают с Большой фармой. Так, например, стартап Emulate, занимающийся органами-на-чипах, в партнерстве с фармкомпаниями создает чипы для исследований заболеваний центральной нервной системы, для изучения иммунных ответов и их влияния на легкие, печень или кишечник, а также модель печени-на-чипе для изучения влияния микробиома и проведения токсикологических исследований при разработке лекарств. На данный момент на чипах уже удается получать те же данные, которые ранее получали на животных моделях или в исследованиях на людях. Печень-на-чипе уже использовалась для изучения молекулы ТАК-875, ранее провалившейся на III фазе клинических испытаний, чтобы определить механизмы ее токсичности.
Органы-на-чипе помогают сократить использование животных для исследований токсичности как лекарств, так и других веществ, в том числе табака. В перспективе такая технология может способствовать и полному отказу от доКИ с участием животных. Рассмотрим еще несколько примеров микрофлюидных систем. Модель органа-на-чипе — это комбинация 3D-модели органа с микрофлюидной платформой. Уже известны и изучаются модели микрососудов [9], легкого, почки [10], кишечника [11] и печени, а также их комбинаций, на чипах.
Чтобы было понятнее, как создаются органы-на-чипах, какие проблемы они решают и с какими сложностями сталкиваются исследователи, мы рассмотрим подробно несколько систем.
Легкое-на-чипе
Редакция «Биомолекулы» напоминает, что курение вредит здоровью.
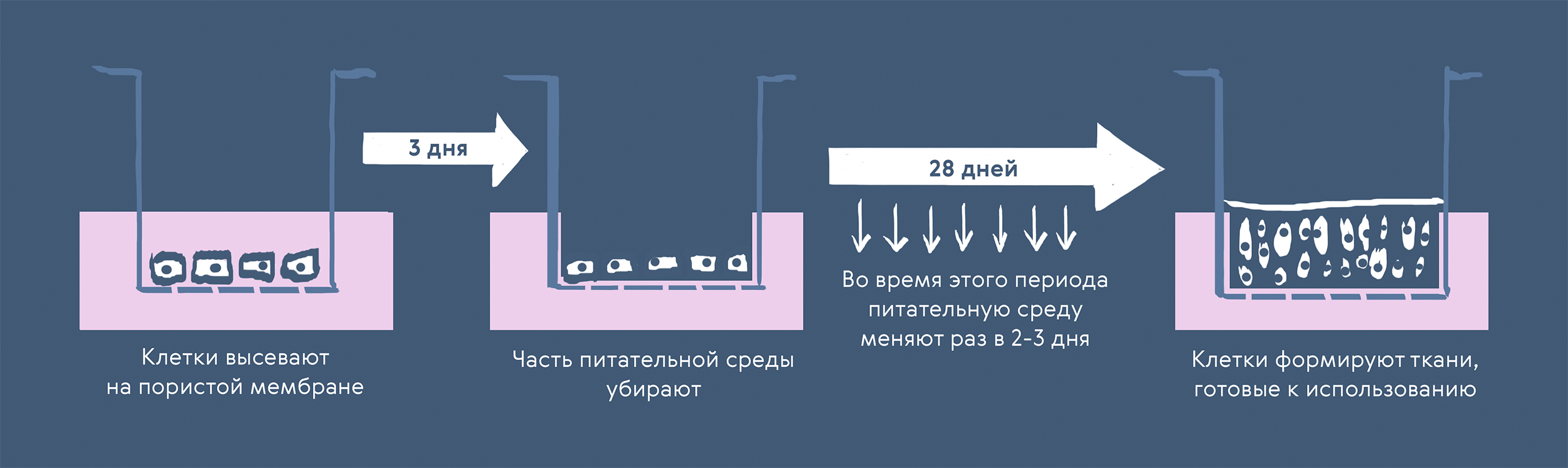
Подготовка 3D-культуры для моделирования органотипических тканей бронхов и более мелких дыхательных путей требует использования первичных бронхиальных клеток человека. Как правило, их сначала растят в культуральных флаконах, а затем высевают на плашки со специальными пористыми мембранами. Эти мембраны позволяют разместить клетки на границе раздела воздушной и жидкой сред (рис. 3), чтобы запустить дифференцировку исходных базальных клеток бронхиального эпителия в реснитчатые и бокаловидные в зависимости от их расположения.
Рисунок 3. Создание 3D-культуры ткани бронхов на мембранных культуральных плашках
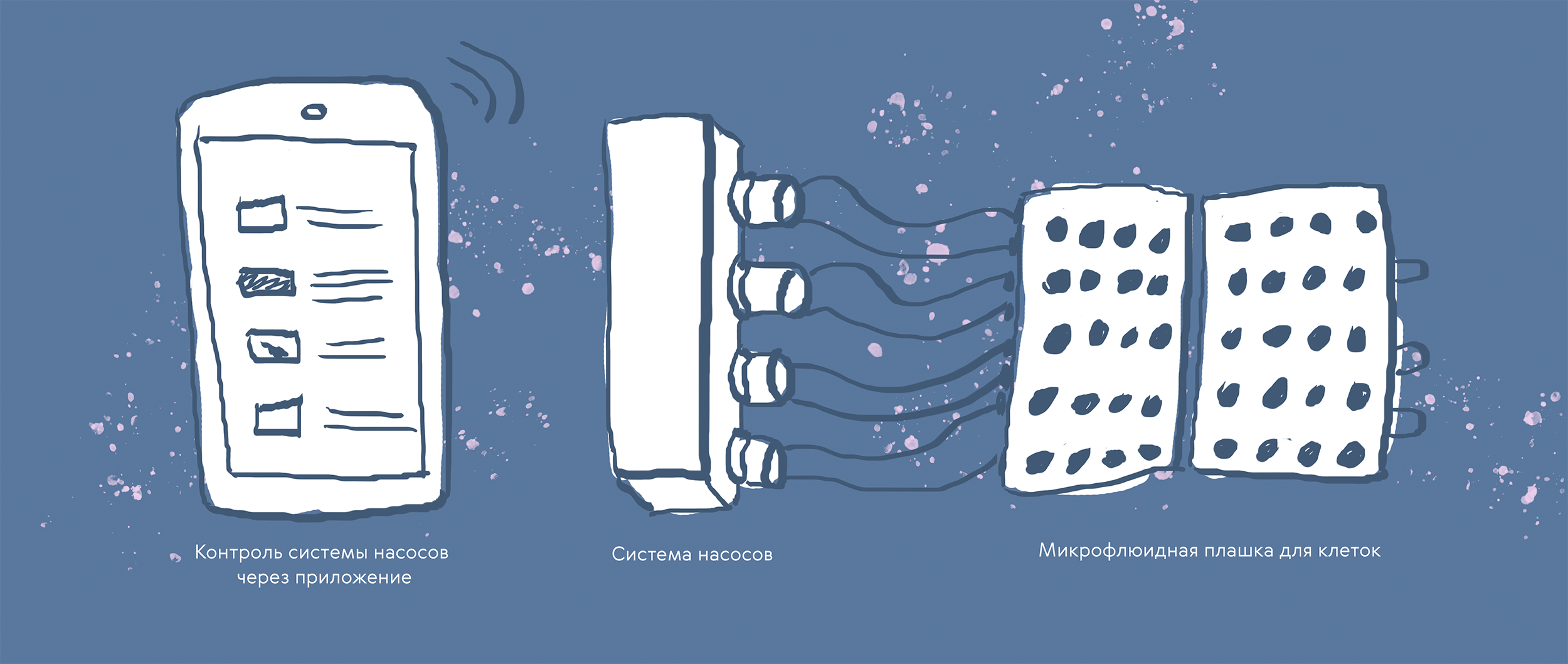
Несмотря на относительную простоту схемы эксперимента, на этом шаге есть немало сложных моментов. Например, многократное изменение условий, в том числе замена среды раз в несколько дней, не всегда происходит одинаково, поэтому ростовые факторы или питательные вещества могут распределяться неравномерно и влиять на растущие ткани. Решить эту проблему можно, если обеспечить постоянный ток питательной среды в микрофлюидное устройство, чтобы избежать резких изменений в системе. На рисунке 4 показана система, состоящая из чипа, объединенного с 32-луночной мембранной плашкой, перистальтического насоса с четырьмя выходами и смартфона с приложением для контроля скорости и направления подачи жидкости. Такая конфигурация позволяет сделать достаточно автономную систему, контроль которой возможен удаленно. Чип изготовлен из полиэфирэфиркетона (PEEK), полимера семейства полиарилэфиркетонов, который не абсорбирует реагенты из жидкой среды. Компоненты системы можно автоклавировать и использовать многократно.
Рисунок 4. Система для создания 3D-культур тканей легкого на базе микрофлюидного чипа, перистальтических насосов и приложения для контроля условий в системе
По данным PMI Science, ткани легкого, выращенные с использованием микрофлюидной системы, получаются тоньше, а сами клетки лучше дифференцированы относительно 3D-культур, полученных на мембранных плашках в статических условиях. Также сокращается время дифференцировки и увеличивается функциональность полученных клеток.
Легкое+печень-на-чипе
Рисунок 5. Схема легкого и печени на чиповой платформе. Две культуры клеток имеют общую среду, подача которой перистальтическим насосом контролируется при помощи смартфона.
Размещение нескольких органов на одном чипе помогает понять, как различные органы могут работать вместе и, например, метаболизировать то или иное вещество. Пример такой комбинации — 3D-культуры клеток легких и печени человека на чипе, соединенные флюидным каналом (рис. 5). Скорость и направление питательной среды, циркулирующей между культурами, можно контролировать с помощью смартфона. Система каналов позволяет двум различным культурам совместно использовать окружающую среду и «общаться» путем выделения в нее различных сигнальных молекул, не соприкасаясь при этом напрямую.
Такая модель «легкие+печень-на-чипе» была проверена при добавлении в систему известного канцерогена афлатоксина В1. Клетки печени в чипе детоксифицировали это вещество, в результате чего клетки бронхов пострадали гораздо меньше, чем в случае добавления к ним токсина в той же концентрации в отсутствии клеток печени в системе. Таким образом, подобное устройство действительно имитирует соединение легких и печени, наблюдаемое в организме человека, и вполне представляет новый подход к изучению токсичности веществ для организма в целом.
Почка-на-чипе
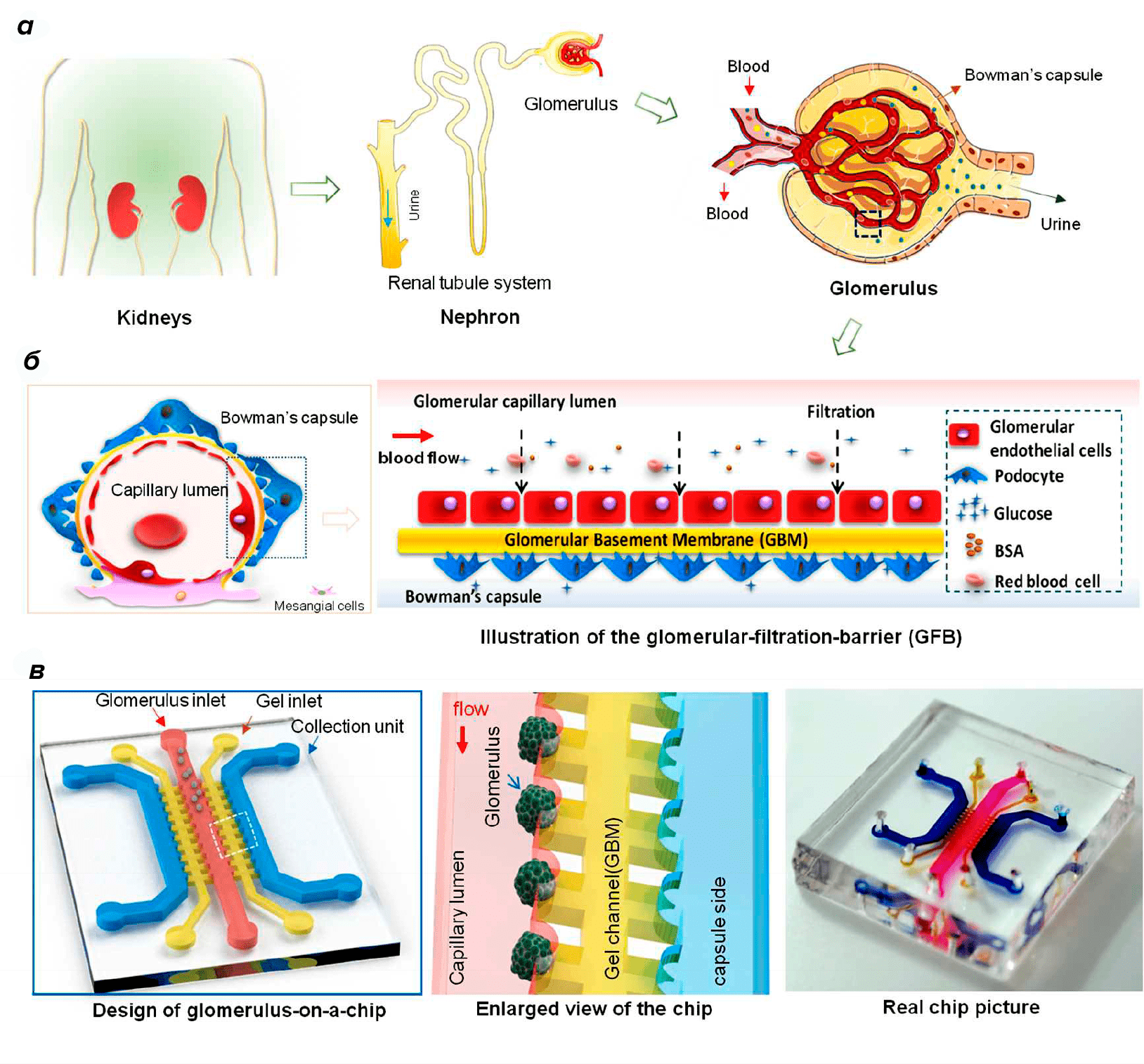
Для обсуждения почки-на-чипе нам не так важно знать все тонкости ее работы, как понимать вот что: огромные количества фильтруемой жидкости создают напряжение сдвига, к которому адаптированы все клетки органа. И это первая проблема, которую призваны решить микрофлюидные чипы, позволяющие создавать и поддерживать постоянный ток жидкости в модели. Вторая — реальная почка состоит из более чем 10 типов клеток, организованных в трехмерную сеть со сложной сосудистой системой, окруженную внеклеточным матриксом (ВМ). Учитывая физиологическую и патологическую важность кровообращения и секреторной циркуляции в почке, модель почки должна включать микрофлюидную платформу, имитирующую кровообращение в просвете и тканях и реализующую транспортные функции.
Выбор правильных клеток для 3D-культуры на чипе — отдельная сложная задача; здесь коротко остановимся на главном: первичные клетки изменяются от донора к донору и недолго живут, что снижает контролируемость эксперимента. Иммортализованные и опухолевые линии чересчур активно делятся, что, в свою очередь, делает модель неадекватной. На данный момент наилучшим решением видится использование клеток, полученных из эмбриональных или индуцированных плюрипотентных стволовых. Но предположим, что мы получили несколько типов клеток, соответствующих разным частям нефрона. Что дальше?
Модель почки-на-чипе, которая была бы полезна для высокопроизводительного скрининга на тестирование токсичности препарата и изучения фармакокинетики — это комбинация 3D-культур разных клеток почки с платформой, воссоздающей микросреду и структуру почки in vivo. Такая модель должна обеспечивать совместное культивирование различных почечных клеток и сохранять функциональные взаимодействия между ними (например, между эндотелиальными клетками клубочков сосудов и подоцитами), обеспечивать синтез функциональных переносчиков, а также метаболические и эндокринные функции. Сегодня уже разработана модель клубочка и проксимальных и дистальных канальцев, но полноценный нефрон-на-чипе, интегрирующий всё это вместе, пока не создан. Прямая комбинация существующих моделей не дает как результат платформу «почка-на-чипе». Другие структурные части нефрона, такие как толстая восходящая конечность, кортикальный собирающий проток, еще недостаточно хорошо охарактеризованы, чтобы создать микрофлюидный чип.
Рисунок 6. Схема структуры клубочка и микрофлюидной системы «клубочек-на-чипе». а — Структура и функции клубочка в почке. б — Барьер клубочковой фильтрации состоит из клубочковых эндотелиальных клеток, подоцитов и базальной мембраны, избирательно проницаемой для малых молекул и воды. в — Клубочек-на-чипе состоит из капиллярных каналов, гелевых каналов и каналов сбора, имитирующих просвет капилляра, базальную мембрану клубочка и капсулу Боумена. Капиллярный канал обеспечивает поток жидкости, похожий на физиологический. Серповидные микроструктуры использовались для создания типичных для оболочки клубочка форм.
О разработке чипов из первых рук — рассказывает Джулия Хёнг
Джулия Хёнг, PhD — директор по системной токсикологии в PMI Science
Разработка чипов — сложный процесс, на который уходит немало времени. Обычно наша работа выглядит так: RnD-отдел разрабатывает первый чип (выбирает материалы, формы, структуру, подсоединяет насос и контроллеры, проводит первые эксперименты с клетками), и на это пока уходит 2–3 года. После этого мы отдаем нашу наработку для адаптации модели к масштабируемому производству. Этим занимаются отдельные компании, как, например, ChipShop. Затем мы делаем коллаборацию с научно-исследовательскими институтами и улучшаем биологическую составляющую чипа — какие клетки лучше использовать, как можно оптимизировать условия и так далее. Для PMI особый интерес представляют модели легких, однако мы поддерживаем наших коллег из академии, если они хотят создавать и другие органы на наших чипах.
С какими мы сталкиваемся сложностями? Я бы разделила процесс работы на условный hardware — то есть сам чип, материалы и структуры. И software — в данном случае, это про биологию и про конкретный подбор условий.
Большой пласт hardware-задач лежит в подборе материала для чипа, ведь нужно подобрать такой материал, который не будет влиять на ход эксперимента, не будет абсорбировать реагенты и не будет разрушаться в длительных экспериментах, а также будет многоразовым. Мы делаем многоразовые пластиковые чипы, потому что это лучше для окружающей среды, а еще позволяет избежать различий между партиями чипов в процессе их дальнейшей разработки.
Дальше идут software-задачи — нужно убедиться, что клетки могут жить, расти, дышать, что им достаточно питательной среды в чипе, что насос работает правильно и его легко контролировать, что все вещества попадают туда, куда требуется и в правильных количествах. Всё это оптимизируется под каждую конкретную клеточную культуру и задачу.
Команда разработки чипов в PMI состоит из семи человек: один инженер со специализацией в биоинжиниринге; один ученый — кандидат биологических наук; другой мой коллега — кандидат химических наук; программист для разработки мобильного приложения, контролирующего чип; и я как руководитель. Еще нескольких экспертов мы привлекаем в качестве внешних консультантов, если у нас возникает такая необходимость.
Без своей команды разработки не обойтись, потому что пока создание каждой системы органа-на-чипе — это отдельный и трудоемкий процесс. Нет таких компаний, которые готовы сделать «под ключ» любой чип под ваши требования, хотя Synbio имеет набор чипов и реагенты для некоторых несложных задач, а Mimetas предлагает готовые решения для создания 3D-культур, особенно для моделирования сосудов. Но такие задачи, как у нас, купить «в коробке» нельзя. Проанализировав стоимость, сроки и потенциальные проблемы, мы понимаем, что хотя бы первый прототип нужно делать самостоятельно. Наверное, в будущем, когда наработок станет больше, появятся «супермаркеты» — говоришь компании, какие задачи хочешь решать на какой модели, а тебе предлагают пять готовых и точно работающих вариантов. Но пока такого нет.
Себестоимость нашего чипа, если бы мы его продавали, была бы, наверное, порядка 1000 долларов: сюда входит насос, многоразовый чип, электроника и ПО. Со временем цены будут уменьшаться. Но даже при такой цене — это всё равно гораздо дешевле, чем проводить испытания на животных.
Я думаю, через 5–10 лет уже появятся первые прецеденты, когда модели органов-на-чипе будут использованы в доКИ и, может быть, даже в КИ. Например, уже есть случаи, когда на чип помещают опухолевые клетки пациента и смотрят, какая химиотерапия оказывается более эффективной. Это пока экспериментальные методы, но они уже помогают сразу дать пациенту лучшее лекарство. Именно эти успехи мотивировали моего коллегу по отрасли, ученого Уве Маркса, основать свою компанию TissUse и заняться в том числе разработкой микрофлюидных чипов для персонализации лечения. Что касается PMI, то нам органы-на-чипе помогут быстрее изучать безопасность и токсические свойства потенциальных ингредиентов (например, ароматизаторов), а также получать значительно больше данных об их воздействии на организм человека, которые нам недоступны при использовании животных моделей.
Будущее микрофлюидики: высокопроизводительные технологии и замена доКИ на животных
Развитие технологий микрообработки (например, фотолитографии, травления, микроформования) позволило обеспечить быстрое и достаточно дешевое изготовление микрофлюидных чипов, а также их стандартизацию. Есть и еще несколько проблем, которые пока стоят на пути полноценной модели органа-на-чипе: от сложностей со стороны получения и поддержания нужных клеток до свойств используемых материалов. Некоторые материалы как нередко используемый в производстве чипов полидиметилсилоксан, выщелачивают растворы и питательные среды. Например, чтобы упомянутая выше почка-на-чипе стала стандартом, она должна быть многократно проверена на чувствительность и специфичность, что означает, к примеру, стандартные ответы клеток в системе на известные нефротоксиканты.
Конечно, рассмотренные в этой статье примеры — это только часть огромной работы, которую ведут компании и научные группы по всему миру. Создаются модели микрососудов [9], кишечника [11] и более сложные комбинации: например, из клеток трех органов: бронхов, легких и печени [14]. И возникает логичный вопрос — а что дальше? Когда эти наработки будут использоваться не только в нескольких десятках RnD-отделов, а повсеместно: например, в разработке лекарств или тестировании промышленных продуктов?
Для скрининга лекарств требуется высокопроизводительный стандартизированный формат, обеспечивающий надежные и воспроизводимые результаты для доклинических исследований. Разработка лекарств — сложный и дорогостоящий процесс, и частота неудач в доклинических и клинических испытаниях остается высокой. По статистике США, только 13,8% всех протестированных лекарств демонстрируют окончательный клинический успех и получают одобрение Управления по санитарному надзору за качеством продуктов и медикаментов США (FDA). Системы «орган-на-чипе» на базе микрофлюидных устройств начали активно развиваться в 2010-х годах, и исследователи быстро поняли, что это может быть хорошим шансом уменьшить расходы на доклинические исследования и использовать меньше животных моделей. Создать полную модель человеческого организма на чипе пока не получается, но системы из трех-четырех органов уже не являются чем-то несбыточным. Амбициозную цель по созданию системы из 10 органов-на-чипе ставит перед собой немецкая компания TissUse и ее основатель доктор Уве Маркс в партнерстве с другими игроками рынка. Эта же компания, подписала договор с PMI о совместной работе над полной моделью респираторного тракта человека. Еще одна нерешенная задача, которая стоит на пути создания целого организма-на-чипе (видео 2), это отсутствие стабильно работающих моделей мозга и сердца.
Видео 2. Концепция «организм-на-чипе»
Применение технологии «организм-на-чипе» в высокопроизводительном скрининге лекарств возможно, если вести эксперименты параллельно на десятках чипов, а также сочетать микрофлюидику с другими методами, например, с масс-спектрометрией: это позволит проводить исследования соединений-кандидатов, отслеживая генетические, протеомные и метаболомные изменения в клетках разных тканей в рамках одной системы. Интересно, что удаленный контроль условий, таких как скорости потоков питательных сред, температуры и так далее, по сути позволит уместить десятки и даже сотни организмов-на-чипах в одной небольшой комнате, а для обеспечения работы такой «фабрики доклинических исследований» нужно будет всего несколько человек.
Важно, что применение технологии органов-на-чипе для полноценной замены доклинических исследований связано не только с успехами биологии, но и с требованиями регуляторов. Например, регулирующие органы для косметологической отрасли уже допускают проведение исследований только in vitro; поэтому отказ от животных становится почти повсеместным трендом в этой отрасли. Однако в более критических отраслях — а именно, в фармацевтической, — могут пройти еще годы исследований, прежде чем использование микрофлюидных чипов будет официально разрешено как альтернатива классическим доклиническим исследованиями. Тем не менее большинство экспертов сходится в том, что в перспективе 10–15 лет это произойдет.
В июне 2019 года Европейский центр альтернатив тестированию на животных (CAAT) выступил спонсором трехдневного семинара по технологии «орган-на-чипе». 46 ведущих экспертов со стороны ученых, поставщиков и производителей, фармацевтики и промышленности, а также регуляторов обсудили препятствия к широкому использованию микрофлюидных чипов.
Основными препятствиями, по мнению экспертов, является недостаточная коммуникация всех участников отрасли и неразработанность критериев оценки для анализов, сделанных при помощи органов-на-чипе. Например, регулирующие органы четко не сообщают, как они оценивают результаты, а производители, в свою очередь, утверждают, что конечные пользователи не предоставляют достаточно данных. Эксперты сошлись на нескольких действиях, которые должны помочь в регулировании использования органов-на-чипе:
Заключение
Органы-на-чипе — одна из технологий, которая может привести к долгожданной революции в сфере доклинических исследований (рис. 7). Все исследователи, от академических ученых до фармацевтических корпораций, хотят, чтобы результаты их работы были точнее, получались быстрее, а стоили меньше. И именно микрофлюидные технологии в совокупности с передовыми подходами клеточной биологии потенциально могут решить все эти вопросы. Создание модели «человек-на-чипе», которая позволит перейти от тестов на животных к персонализированным доклиническим испытаниям, — непростая работа, которая возможна только при кооперации биологов, химиков, инженеров, математиков и программистов. Несмотря на значительные успехи в течение последних 10 лет, путь еще долгий: как в самих разработках, так и во внедрении их в существующие законодательные нормы. Однако многие эксперты сходятся в том, что еще через 10 лет микрофлюидные устройства будут широко применяться в доклинических исследованиях. Что ж, поживем и увидим!
В следующей части спецпроекта мы расскажем, как омиксные технологии, то есть анализ больших массивов данных о разных биологических процессах, меняют доклинические исследования.
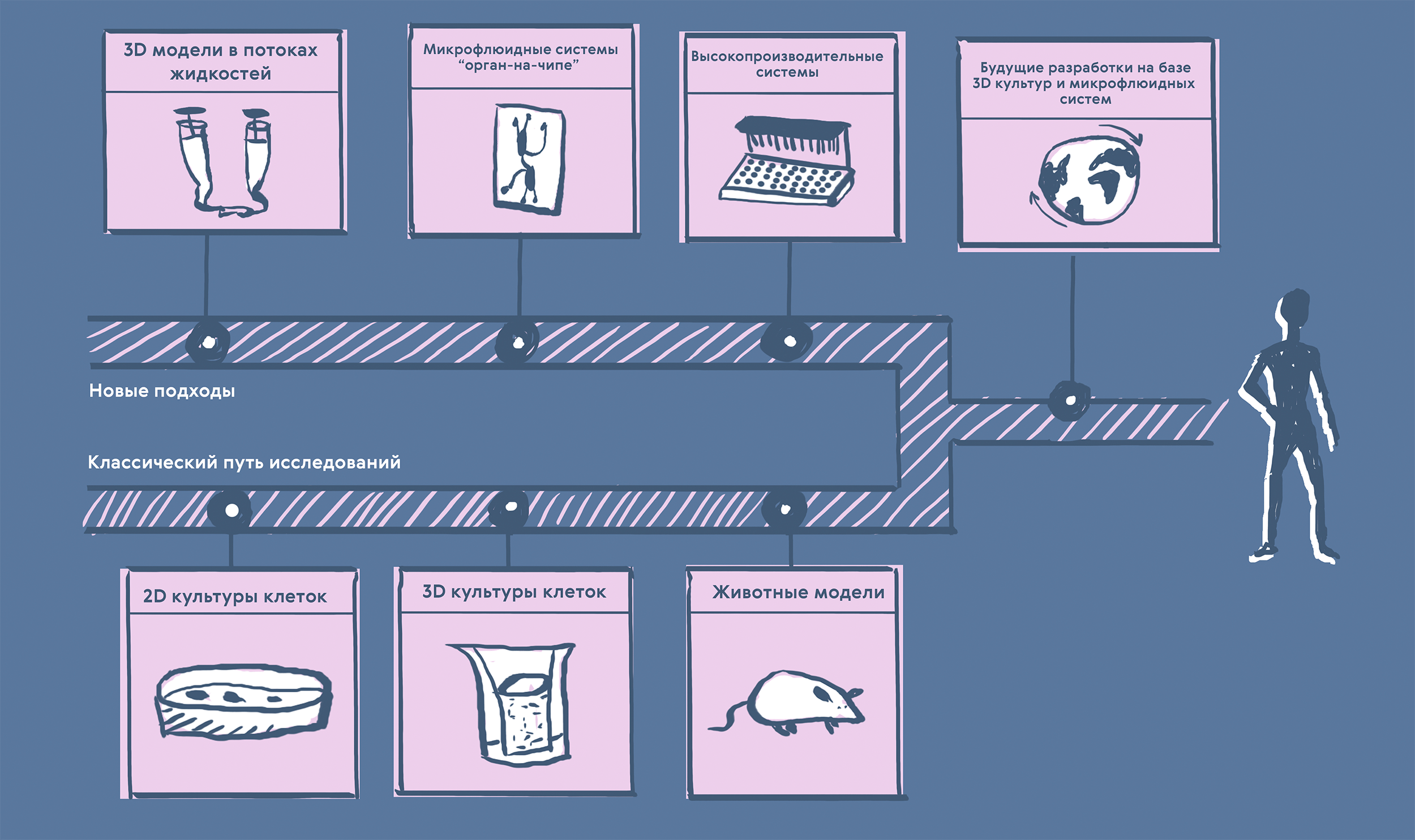
Рисунок 7. Классические и инновационные подходы к доклиническому исследованию лекарственных препаратов.
К классическим относятся 2D-культуры клеток (очень хорошо изучены, недорогие и простые в работе, но не очень точно воспроизводят свойства целого организма), 3D-культуры клеток (хорошо изучены, информативнее 2D-культур, но всё еще не дают достаточно полной картины, чтобы отказаться от испытаний на животных) и животные модели (источник бесценных данных по целому живому организму, однако работа с ними дорогая и неэтичная, а также всё равно остается много видовых отличий при переходе к исследованиям на людях).
К новым подходам можно отнести 3D-модели клеточных культур в потоках жидкостей (первый шаг к комплексному изучению физиологических процессов), микрофлюидные системы «орган-на-чипе» (тканеспецифичные и стандартизируемые, моделирующие физиологические процессы, но пока всё еще сложные и дорогие в разработке) и высокопроизводительные микрофлюидные системы (объединение десятков устройств с автоматическим контролем для сбора большого количества данных; крайне перспективно, но всё еще дорого, а также сложно в смысле валидации и воспроизводимости результатов).
Будущие разработки на базе 3D-культур и микрофлюидных систем должны быть стандартизированными, недорогими, работающими с большим количеством образцов, комбинироваться с другими методами — так они в конце-концов смогут заменить животные модели.
иллюстрация Карины Илиопуло по мотивам [10]