Что такое дистилляция в химии кратко
Простой процесс перегонки и примеры
простая перегонка представляет собой процесс, в котором пары, образующиеся из жидкости, направляются непосредственно в конденсатор, внутри которого температура паров понижается и происходит его конденсация.
Он используется для отделения летучего компонента от нелетучих компонентов, присутствующих в жидкости. Он также используется для разделения двух жидкостей, присутствующих в растворе с очень разными температурами кипения.
Простая дистилляция не является эффективным методом разделения двух летучих жидкостей, присутствующих в растворе. Когда ее температура увеличивается за счет подачи тепла, кинетическая энергия молекул также увеличивается, что позволяет им преодолевать силу сцепления между ними.
Летучие жидкости начинают кипеть, когда их давление пара равно внешнему давлению, действующему на поверхность раствора. Обе жидкости вносят вклад в состав образующихся паров, причем присутствие более летучей жидкости больше; то есть тот, с самой низкой температурой кипения.
Следовательно, наиболее летучая жидкость составляет большую часть образующегося дистиллята. Процесс повторяется до достижения желаемой чистоты или максимально возможной концентрации.
Простой процесс перегонки
При простой перегонке температура раствора увеличивается, пока он не достигнет точки кипения. В этот момент происходит переход между жидким и газообразным состояниями. Это наблюдается, когда при растворении начинается постоянное барботирование.
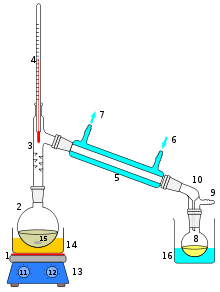
оборудование
Оборудование для проведения простой перегонки обычно состоит из зажигалки или нагревательного чехла (см. Изображение); круглая колба огнеупорное стекло с матовым стеклом ротами, чтобы разрешить соединение; и некоторые стеклянные шарики (некоторые используют деревянную палочку), чтобы уменьшить размер образовавшихся пузырьков.
Стеклянные шарики служат в качестве пузырьков, образующих сердцевины, которые позволяют жидкости кипеть медленно, предотвращая перегрев, что приводит к образованию неких гигантских пузырьков; способен даже выбросить массу жидкости из дистилляционного баллона.
В сочетании с устьем колбы, переходник огнеупорных трехгорлые стекол помещают, которые изготовлены из матового стекла. Горловина соединена с дистилляционной колбой, вторая горловина соединена с конденсатором, а третья горловина закрыта с помощью резиновой заглушки.
В изображении, сборке не хватает этого адаптера; и вместо этого через ту же резиновую пробку помещаются термометр и прямой соединитель с конденсатором.
конденсатор
Конденсатор представляет собой устройство, предназначенное для выполнения функции, указанной в его названии: для конденсации пара, который проходит через его внутреннюю часть. Его верхняя часть соединена с адаптером, а его нижняя часть соединена с шаром, где собираются продукты дистилляции..
В случае изображения они используют (хотя это не всегда правильно) градуированный цилиндр, чтобы сразу измерить дистиллированный объем.
Вода, которая циркулирует через внешнюю оболочку конденсатора, поступает в нее через свою нижнюю часть и уходит через верхнюю часть. Это гарантирует, что температура конденсатора будет достаточно низкой, чтобы обеспечить конденсацию паров, образующихся в дистилляционной колбе..
Все детали, из которых состоит дистилляционный аппарат, закреплены зажимами, соединенными с металлической опорой..
Объем раствора, подлежащего перегонке, помещают в круглую колбу с подходящей емкостью.
Соответствующие соединения выполняются с использованием графита или смазки, чтобы обеспечить эффективную герметизацию и запуск нагревания раствора. Одновременно начинается прохождение воды через конденсатор..
отопление
По мере нагревания дистилляционного баллона в термометре наблюдается повышение температуры до достижения точки, при которой температура остается постоянной. Это остается так, даже если нагревание продолжается; если вся летучая жидкость полностью не испарится.
Объяснение этого поведения состоит в том, что точка кипения нижнего кипящего компонента жидкой смеси была достигнута, в которой давление его пара равно внешнему давлению (760 мм рт. Ст.).
В этот момент вся тепловая энергия расходуется на переход из жидкого состояния в газообразное состояние, которое включает истечение силы межмолекулярного сцепления жидкости. Следовательно, подача тепла не приводит к повышению температуры..
Жидкий продукт перегонки собирается в колбах с соответствующей маркировкой, объемы которых будут зависеть от объема, первоначально помещенного в перегонную колбу..
примеров
Дистилляция воды и алкоголя
Существует 50% раствор спирт в воде. Зная, что температура кипения спирта составляет 78,4 ° С, а температура кипения воды составляет около 100 ° С, можно ли затем получить чистый спирт с простой стадией перегонки? Ответ нет.
При нагревании водно-спиртовой смеси температура кипения наиболее летучей жидкости первоначально достигается; в этом случае алкоголь. Образующийся пар будет иметь большую долю спирта, но также будет высокое присутствие воды в паре, так как точки кипения аналогичны..
Жидкость, собранная в результате дистилляции и конденсации, будет иметь процентное содержание спирта более 50%. Если эта жидкость подвергается последовательной дистилляции, может быть достигнут концентрированный спиртовой раствор; но не чистые, так как пары будут продолжать тянуть воду к определенной композиции, образуя так называемый азеотроп
Жидкий продукт сбраживания сахаров имеет процентное содержание спирта 10%. Эту концентрацию можно переносить при 50%, как в случае с виски, простой перегонкой..
Разделение жидкости и твердого вещества
Раствор соли в воде образован жидкостью, которая может улетучиваться, и нелетучим соединением с высокой температурой кипения: солью.
Когда раствор дистиллирован, чистая вода может быть получена в конденсационной жидкости. Между тем, в нижней части дистилляционной колбы соли будут осаждаться.
Алкоголь и глицерин
Он имеет смесь этилового спирта с температурой кипения 78,4 ° С и глицерина с температурой кипения 260 ° С. При простой перегонке образующийся пар будет иметь очень высокий процент спирта, близкий к 100%..
Таким образом, вы получите дистиллированную жидкость с процентным содержанием спирта, похожего на пар. Это происходит потому, что точки кипения жидкостей очень разные.
Дистилляция
Дистилляция (лат. distillatio — стекание каплями) — перегонка, испарение жидкости с последующим охлаждением и конденсацией паров. Различают дистилляцию с конденсацией пара в жидкость (при которой получаемый конденсат имеет усреднённый состав вследствие перемешивания) и дистилляцию с конденсацией пара в твёрдую фазу (при которой в конденсате возникает распределение концентрации компонентов). Продуктом дистилляции является конденсат или остаток (или и то, и другое) – в зависимости от дистиллируемого вещества и целей процесса. Основными деталями дистилляционного устройства являются обогреваемый контейнер (куб) для дистиллируемой жидкости, охлаждаемый конденсатор (холодильник) и соединяющий их обогреваемый паропровод.
Содержание
История
До X века, у Авиценны дистилляция упоминается как метод получения эфирных масел.
Применение
Дистилляция применяется в промышленности и в лабораторной практике для разделения и рафинирования сложных веществ: для разделения смесей органических веществ (например, разделение нефти на бензин, керосин, соляр и др.; получение ароматических веществ в парфюмерии; получение алкогольного спирта) и для получения высокочистых неорганических веществ (например, металлов: бериллий, цинк, магний, кадмий и др.).
Теория
В теории дистилляции в первую очередь рассматриваются двухкомпонентные вещества. Действие дистилляции основано на том, что концентрация 



При 





Для различных режимов дистилляции выведены уравнения, связывающие содержание второго компонента в конденсате 







При дистилляции вещества с большой концентрацией компонентов с конденсацией пара в жидкость при несильной зависимости коэффициентов активности компонентов от их концентраций взаимосвязь величин 



Для дистилляции с конденсацией пара в жидкость при малом содержании примеси



Дистилляционные уравнения могут использоваться для описания процессов распределения примесей в других фазовых переходах из фазы с интенсивным перемешиванием (таких как переходы жидкий кристалл-кристалл, жидкий кристалл-жидкость, газ-плазма, а также в переходах, связанных с квантово-механическими состояниями – сверхтекучая жидкость, конденсат Бозе-Эйнштейна) – при подстановке в них соответствующих коэффициентов распределения.
Дистилляция с конденсацией пара в жидкость (простая перегонка, фракционная дистилляция, ректификация)
Простая перегонка — частичное испарение жидкой смеси путём непрерывного отвода и конденсации образовавшихся паров в холодильнике. Полученный конденсат называется дистиллятом, а неиспарившаяся жидкость — кубовым остатком.
Фракционная дистилляция (или дробная перегонка) — разделение многокомпонентных жидких смесей на отличающиеся по составу части — фракции путём сбора конденсата частями с различной летучестью, начиная с первой, обогащенной низкокипящим компонентом. Остаток жидкости обогащён высококипящим компонентом. Для улучшения разделения фракций применяют дефлегматор.
Ректификация — способ дистилляции, при котором часть жидкого конденсата (флегма) постоянно возвращается в куб, двигаясь навстречу пару в контакте с ним. В результате этого примеси, содержащиеся в паре, частично переходят во флегму и возвращаются в куб, при этом чистота пара (и конденсата) повышается (См. ректификация, ректификационная колонна).
Дистилляция с конденсацией пара в твёрдую фазу (с конденсацией пара в градиенте температуры; с направленным затвердеванием конденсата; зонная дистилляция)
Дистилляция с конденсацией пара в градиенте температуры – дистилляционный процесс, в котором конденсация в твёрдую фазу осуществляется на поверхности, имеющей градиент температуры, с многократным реиспарением частиц пара. Менее летучие компоненты осаждаются при более высоких температурах. В результате в конденсате возникает распределение примесей вдоль температурного градиента, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Разделение компонентов пара при реиспарении подчиняется собственным закономерностям. Так, при молекулярной дистиляции соотношение между количествами 


Дистилляция с направленным затвердеванием конденсата (дистилляция с вытягиванием дистиллята) – дистилляционный процесс в контейнере удлинённой формы c полным расплавлением дистиллируемого вещества и конденсацией пара в твёрдую фазу по мере вытягивания конденсата в холодную область. Процесс разработан теоретически.
В получаемом конденсате возникает неравномерное распределение примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс является дистилляционным аналогом нормальной направленной кристаллизации. Распределение примеси в конденсате описывается уравнением:

где С – концентрация примеси в дистилляте на расстоянии х от начала, L – высота конденсата при полностью испарившемся дистиллируемом материале.
При движении зонного нагревателя вдоль контейнера сверху вниз в контейнере формируется твёрдый конденсат с неравномерным распределением примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс может быть повторён многократно, для чего конденсат, полученный в предыдущем процессе, должен быть перемещён (без переворота) в нижнюю часть контейнера на место рафинируемого вещества. Неравномерность распределения примесей в конденсате (т. е. эффективность очистки) растёт с увеличением числа повторений процесса.
Зонная дистилляция является дистилляционным аналогом зонной перекристаллизации. Распределение примесей в конденсате описывается известными уравнениями зонной перекристаллизации с заданным числом проходов зоны – при замене коэффициента распределения k для кристаллизации на коэффициент разделения α для дистилляции. Так, после одного прохода зоны

где С – концентрация примеси в конденсате на расстоянии х от начала конденсата, λ – длина жидкой зоны.
Дистилляция. Справка
Дистилляция (от лат. distillatio – стекание каплями) – перегонка, разделение жидких смесей на отличающиеся по составу фракции. Процесс основан на различии температур кипения компонентов смеси.
Процесс дистилляции был известен в Древнем Китае и Риме во втором тысячелетии до нашей эры и применялся главным образом для выделения душистых веществ из ароматических растений. Египтяне, постигнув тайны дистилляции вина, изобрели перегонный аппарат (аламбик), получивший впоследствии большое распространение у других народов.
Описание способа дистилляции и его использования в лечебных целях приводится в трудах персидского ученого Авиценны (930–1037).
В Древней Руси упоминание о постройке винокурни для получения «хлебного вина» водки относится к 1174 году.
Определенная роль в совершенствовании процесса дистилляции принадлежит алхимикам средневековья, но наибольшее развитие она получила в конце 19 – начале 20 веков в связи с внедрением в промышленности (спиртовой, нефтеперерабатывающей и др.) высокопроизводительных колонных аппаратов.
В зависимости от физических свойств компонентов разделяемых жидких смесей применяют различные способы дистилляции.
Простая дистилляция проводится частичным испарением кипящей жидкой смеси, непрерывным отводом и последующей конденсацией образовавшихся паров. Так как пары над кипящей жидкой смесью содержат низкокипящих компонентов больше, чем жидкость, то конденсат (называемый дистиллятом) обогащается, а неиспарившаяся жидкость (кубовый остаток) обедняется ими. При простой дистилляции содержание низкокипящих компонентов в паровой и жидкой фазах непрерывно падает. Поэтому состав дистиллята меняется во времени. Простая дистилляция – периодический процесс. Для ускорения процесса применяют полунепрерывную дистилляцию, при которой в дистилляционный куб непрерывно поступает исходная смесь, равная массе уходящих паров.
Фракционная дистилляция, называемая также дробной перегонкой, – одна из разновидностей простой дистилляции. Такую дистилляцию применяют для разделения смеси жидкостей на фракции, кипящие в узких интервалах температур. При этом дистилляты разных составов отводят (последовательно во времени) в несколько сборников. В каждом из этих дистиллятов (фракциях) преобладает один или несколько компонентов исходной смеси с близкими температурами кипения. Простую дистилляцию для улучшения разделения смесей часто комбинируют с противоточной дефлегмацией (частичная конденсация). При этом образующиеся в кубе пары частично конденсируются в дефлегматоре, конденсат (флегма) непрерывно возвращается в куб, а остаток паров после дефлегматора поступает в конденсатор, откуда дистиллят стекает в сборник. Этим способом достигается большее обогащение дистиллята низкокипящими компонентами, т.к. при дефлегмации паров преимущественно конденсируются высококипящие компоненты.
Равновесная дистилляция (однократное испарение) характеризуется испарением части жидкости и продолжительным контактом паров с неиспарившейся жидкостью до достижения фазового равновесия. Разделяемая смесь проходит по трубам, обогреваемым снаружи топочными газами. Образовавшаяся при этом парожидкостная смесь, близкая к равновесному состоянию, поступает в сепаратор для механического отделения жидкости от пара. Пары из сепаратора поступают в конденсатор, откуда дистиллят стекает в приемник, а оставшаяся в сепараторе жидкость отводится в сборник. В этом процессе соотношение между паром и жидкостью определяется материальным балансом и условиями фазового равновесия. Равновесная дистилляция редко применяется для двухкомпонентных смесей; хорошие результаты получают в основном в случае многокомпонентных смесей, из которых можно получить фракции, сильно различающиеся по составу.
Дистилляцию в токе водяного пара или инертных газов применяют, когда необходимо понизить температуру процесса отгонки, в случае разделения нетермостойких компонентов, а также для отгонки веществ с низкой температурой испарения от компонентов с высокой температурой испарения. Пузырьки водяного пара или инертного газа барботируют (продавливают) через слой жидкости. При дистилляции с водяным паром образовавшаяся смесь паров воды и летучего компонента отводится из аппарата и подвергается конденсации и охлаждению. Состав образующихся в кубе паров не зависит от состава жидкости, а температура кипения смеси всегда ниже температуры кипения каждого из компонентов при данном давлении. При дистилляции с инертным газом компоненты раствора испаряются в поток газа, даже если раствор не кипит, а парообразование при испарении может происходить при любых температурах, вне зависимости от внешнего давления, что позволяет вести процесс при низких температурах.
Молекулярная дистилляция основана на разделении жидких смесей свободным их испарением в высоком вакууме 133–13,3 мн/м2 (10–3–10–4 мм ртутного столба) при температуре ниже точки их кипения. Процесс проводят при взаимном расположении поверхностей испарения и конденсации на расстоянии, меньшем длины свободного пробега молекул перегоняемого вещества. Благодаря вакууму молекулы пара движутся от испаряющей поверхности к конденсирующей с минимальным числом столкновений. При молекулярной дистилляции изменение состава пара по сравнению с составом жидкости определяется различием скоростей испарения компонентов. Поэтому этим способом можно разделять смеси, компоненты которых обладают одинаковым давлением паров. При данной температуре жидкости и соответствующем ей давлении паров скорость молекулярной дистилляции растет с понижением давления в аппарате.
Для молекулярной дистилляции применяют аппараты с горизонтальными и вертикальными поверхностями испарения, а также получившие наибольшее промышленное применение центробежные аппараты. В последних процесс характеризуется наименьшими толщиной жидкой пленки (в среднем 0,05 мм) и временем ее пребывания на поверхности нагрева (0,03м–1,2 сек). В центробежных аппаратах на испаритель, представляющий собой быстровращающийся конус (иногда диск), подается разделяемая смесь. Центробежная сила перемещает жидкость от центра к периферии (вверх). Пары перегоняемого вещества собираются на неподвижном конденсаторе, расположенном параллельно поверхности испарителя, откуда дистиллят непрерывно отводится. Остаток после перегонки сбрасывается в кольцевой желоб и выводится из куба. Для увеличения эффекта разделения устанавливают несколько аппаратов последовательно.
Молекулярную дистилляцию применяют для разделения и очистки высокомолекулярных и термически нестойких органических веществ, например для очистки эфиров себациновой, стеариновой, олеиновой и других кислот, для выделения витаминов из рыбьего жира и различных растительных масел, при производстве медицинских препаратов, вакуумных масел и др.
В металлургии понятие дистилляции объединяет пирометаллургические процессы, основанные на переводе восстанавливаемого металла в парообразное состояние с последующей конденсацией. Металлургическая дистилляция – сочетание химического (окислительно-восстановительной реакции) и физического (испарения и конденсации) процессов. Восстановление проводят с использованием углеродистых восстановителей или металлотермическим способом. Возможно выделение свободного металла при окислительном обжиге сульфидных концентратов. Степень разделения при дистилляции определяется различием состава перегоняемой смеси и ее пара. Полнота перехода металла в газовую фазу при дистилляции определяется восстановлением металлов при температурах и давлениях, обеспечивающих получение восстановленного металла в парообразном агрегатном состоянии.
Дистилляция применяется также в химической, лесохимической, фармацевтической и других отраслях промышленности для грубого разделения смесей на фракции, когда не предъявляются высокие требования к чистоте получаемых продуктов, а также для очистки жидких смесей от нелетучих или малолетучих примесей.
Дистилляцию с дефлегмацией применяют в нефтепереработке и лабораторной практике, дистилляция с водяным паром – в химической, нефтехимической, парфюмерной и других отраслях промышленности для отгонки высококипящих компонентов из вязких смесей, содержащих значительные количества твердых или малолетучих жидких веществ. Также путем перегонки (однократной или многократной) на ликеро-водочных заводах получают полуфабрикат для множества алкогольных напитков: коньяка, рома, виски, а в домашних условиях – самогон.
В лабораторной практике условия дистилляции для некоторых видов продуктов стандартизованы. Наиболее известными являются ГОСТ 2177(ASTM D86) – перегонка 100 мл продукта с температурой кипения от комнатной до 400°С при атмосферном давлении. Это сделано для воспроизводимости результатов тестирования бензина, керосина, дизельного топлива, нефти, а также различных растворителей.
Дистилляция является давно известным и проверенным способом глубокой очистки воды.
Хорошо всем известный пример использования дистиллированной воды – заливка в аккумуляторы автомобиля. В быту же дистилляторы не нашли широкого применения.
И дело здесь совсем не в непригодности дистиллированной воды для питья. Вредность такой воды из-за отсутствия в ней «полезных» минеральных веществ – это, скорее, укоренившийся предрассудок. Дистиллированная вода действительно имеет невысокие вкусовые качества, часто ее вкус характеризуют как «затхлый». Однако с точки зрения влияния на здоровья нет никаких свидетельств того, что дистиллированная вода непригодна для питья.
Ограниченность же применения дистилляторов в быту объясняется следующими причинами:
Во-первых, бытовые дистилляторы имеют малую производительность (около одного литра в час).
Во-вторых, в бойлере дистиллятора постоянно образуются осадок, накипь и т.п., которые надо вычищать.
В-третьих, дистилляторы излучают тепло и в довольно значительных количествах.
В-четвертых, дистилляторы потребляют значительное количество электроэнергии, что для многих применений делает их использование менее рентабельным, чем обратный осмос (способ очистки воды, при котором вода, проходит через специальную полупроницаемую мембрану) или деминерализация на ионообменных смолах.