Что такое дисперсная среда
Дисперсионная среда
Смотреть что такое «Дисперсионная среда» в других словарях:
дисперсионная среда — дисперсионная среда: Непрерывная фаза в дисперсной системе. [ГОСТ 16887 71, статья 2] Источник … Словарь-справочник терминов нормативно-технической документации
дисперсионная среда — Непрерывная фаза в дисперсной системе. [ГОСТ 16887 71] [ГОСТ Р 51109 97] [ГОСТ Р 12.4.233 2007] Тематики промышленная чистотасредства индивидуальной защитыфильтрование, центрифугирование, сепарирование … Справочник технического переводчика
дисперсионная среда — – непрерывная часть (фаза) дисперсной системы, в которой распределены частицы дисперсной фазы. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Дисперсионная среда — – непрерывная фаза в дисперсной системе. [ГОСТ 16887 71] Рубрика термина: Общие Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги, Автотехника … Энциклопедия терминов, определений и пояснений строительных материалов
дисперсионная среда — dispersinė terpė statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiaga, kurioje pasklidusi dispersinė fazė. atitikmenys: angl. dispersion medium vok. dispergierendes Medium, n; Dispersionsmedium, n; Dispersionsmittel, n rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
дисперсионная среда — dispersinė terpė statusas T sritis fizika atitikmenys: angl. dispersing medium; dispersion medium; dispersive medium vok. dispergierendes Medium, n; Dispersionsmedium, n rus. диспергирующая среда, f; дисперсионная среда, f; дисперсная среда, f… … Fizikos terminų žodynas
дисперсионная среда — dispersinė terpė statusas T sritis chemija apibrėžtis Medžiaga, kurioje pasklidusi dispersinė fazė. atitikmenys: angl. dispersion medium rus. дисперсионная среда … Chemijos terminų aiškinamasis žodynas
дисперсионная среда — дисперсионная фаза … Cловарь химических синонимов I
ДИСПЕРСИОННАЯ СРЕДА — смотри Дисперсные системы … Металлургический словарь
Понятие и определение
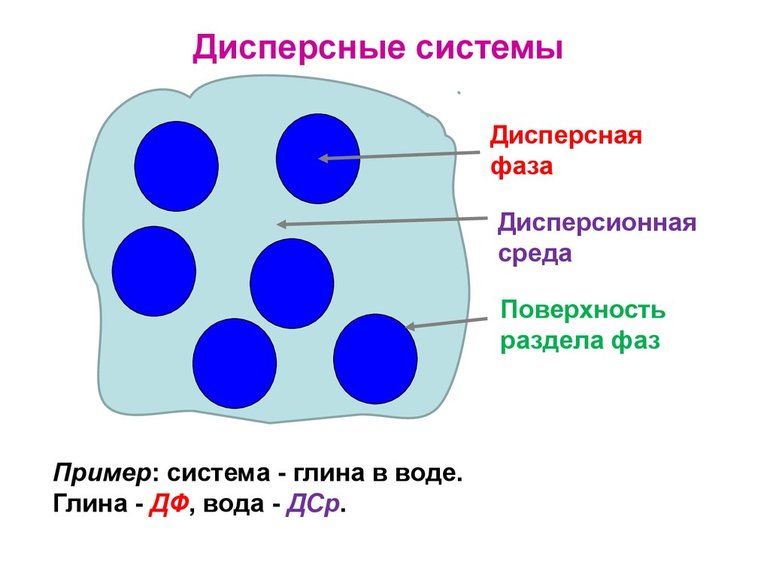
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
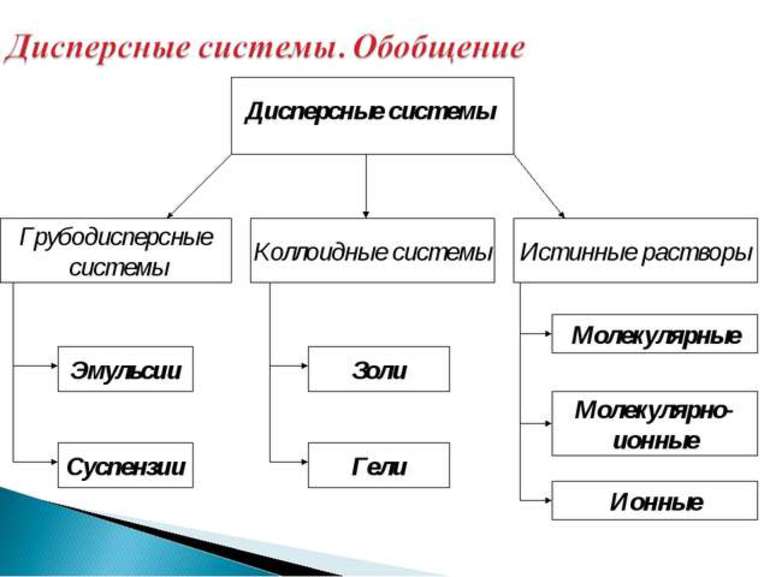
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:
Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства
Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
В свою очередь, тонкодисперсные системы являются настолько мелкими, что рассмотреть их можно только в специальный ультразвуковой микроскоп. В некоторых случаях даже при направленном в жидкость луче не появляется характерной «дорожки». Несмотря на существенные различия, свойства везде одинаковы. Они зависят от таких показателей, как:
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Дисперсные среды
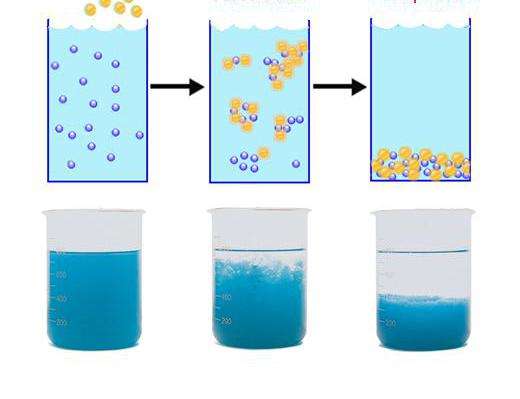
Дисперсная система — это система, образованная из двух или более фаз, которые практически не смешиваются и не реагируют друг с другом химически. При двухфазной системе первое вещество — дисперсная фаза — распределено в дисперсионной среде. Дисперсные системы бывают различными. Примером системы, где дисперсной фазой является жидкость, а дисперсионной средой — газ, служат аэрозоли (облака и туманы). Коллоидные растворы (золи) — это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. По размерам частиц коллоидные растворы — промежуточные между истинными растворами, суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов. Их изучает коллоидная химия.
В коллоидном растворе имеются мельчайшие крупинки или капельки жидкости, состоящие из большого количества молекул в растворителе (в данном случае — в дисперсной фазе); в истинных растворах в растворителе имеются отдельные молекулы или ионы. Для коллоидных растворов характерен эффект Тиндаля, при котором свет рассеивается коллоидными частицами. Если пропустить через золь пучок света, то появляется светлый конус, видимый в затемненном помещении. Так можно распознать, является данный раствор коллоидным или истинным.
Если дисперсная фаза газообразная, а дисперсионная среда жидкая, мы имеем дело с пеной. Когда обе дисперсные фазы жидкие — это эмульсия. Эмульсиями являются и нефть, и кремы.
Твердая дисперсная фаза при жидкой дисперсионной среде — суспензия. Это ил, взвесь, паста. Жидкая дисперсная фаза и твердая дисперсионная среда — это капиллярная система, то есть заполненное жидкостью пористое тело, например почва.
Примерами дисперсной системы, когда и дисперсная фаза, и дисперсионная среда твердые, являются бетон и сплавы.
Двухфазные дисперсные системы бывают также свободнодисперсными, когда дисперсная фаза подвижна, и связнодисперсными, когда дисперсионная среда твердая и частицы дисперсной фазы не могут перемещаться свободно.
Если частицы дисперсной фазы одинаковые, такие системы называют монодисперсными, если разные — полидисперсными. В основном реальные дисперсные системы, окружающие нас, полидисперсны.
Коллоидные системы имеют огромное значение в биологии и в жизни человека. Многие вещества в человеческом организме находятся в коллоидном состоянии. Коллоидные растворы — это нервные и мышечные клетки, кровь и другие биологические жидкости. Плазма крови также представляет собой дисперсионную среду.
Дисперсия (химия)
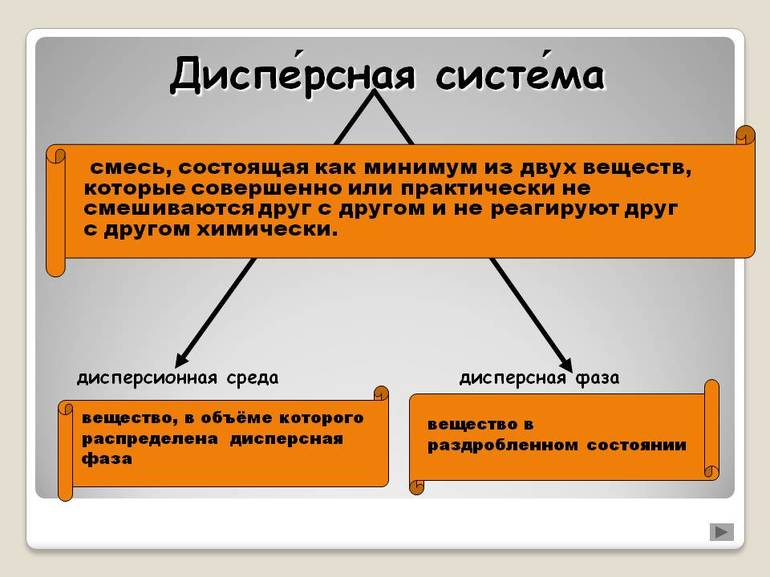
Диспе́рсная систе́ма — это смесь, состоящая как минимум из двух веществ, которые совершенно или практически не смешиваются друг с другом и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда, диспергатор). Фазы можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т.д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твердой дисперсной среды, в которой находится дисперсная фаза.
Классификация дисперсных систем
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среди и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсионная среда | Дисперсная фаза | Название и пример |
|---|---|---|---|
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем, молоко |
| Т/Ж | Жидкая | Твёрдая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Ж | Жидкая | Газообразная | Газовые эмульсии и пены |
| Ж/Т | Твёрдая | Жидкая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твердые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы |
| Г/Т | Твёрдая | Газообразная | Пористые тела |
| Ж/Г | Газообразная | Жидкая | Аэрозоли: туманы, облака |
| Т/Г | Газообразная | Твёрдая | Аэрозоли (пыли, дымы), порошки |
| Г/Г | Газообразная | Газообразная | Дисперсная система не образуется |
По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса:
В свою очередь эти системы классифицируются по степени дисперсности.
По размерам частиц свободнодисперсные системы подразделяют на:
Ультрамикрогетерогенные системы также называют коллоидными или золями. В зависимости от природы дисперсионной среды, золи подразделяют на твердые золи, аэрозоли (золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой). К микрогетерогенным системам относят суспензии, эмульсии, пены и порошки. Наиболее распространенными грубодисперсными системами являются системы твердое-газ, например, песок.
Связнодисперсные системы (пористые тела) по классификации М. М. Дубинина подразделяют на:
Степень дисперсности. Дисперсная фаза. Дисперсионная среда
Большинство окружающих нас веществ представляют собой смеси различных субстанций, поэтому изучение их свойств играет важную роль в развитии химии, медицины, пищевой промышленности и других отраслей народного хозяйства. В статье рассматриваются вопросы, что такое степень дисперсности, и как она влияет на характеристики системы.
Что такое дисперсные системы?
Прежде чем перейти к обсуждению вопроса о степени дисперсности, необходимо пояснить, к каким системам может применяться это понятие.
Представим себе, что у нас имеются два различных вещества, которые могут отличаться друг от друга химическим составом, например, поваренная соль и чистая вода, или же агрегатным состоянием, например, та же вода в жидком и твердом (лед) состояниях. Теперь необходимо взять и смешать эти две субстанции и интенсивно их перемешать. Какой будет результат? Он зависит от того, прошла при смешивании химическая реакция или нет. Когда речь ведут о дисперсных системах, то полагают, что при их образовании никакой реакции не происходит, то есть исходные вещества сохраняют свое строение на микроуровне и присущие им физические свойства, например, плотность, цвет, электропроводность и другие.

Гомогенные и гетерогенные системы
Понятно, что названные две составляющие дисперсной системы будут отличаться по своим физическим свойствам. Например, если бросить в воду песок и размешать его, то понятно, что существующие в воде песчинки, химическая формула которых SiO2, ничем не будут отличаться от того состояния, когда они не находились в воде. В таких случаях говорят о гетерогенности. Иными словами, гетерогенная система представляет собой смесь из нескольких (двух и более) фаз. Под последней понимают некоторый конечный объем системы, который характеризуется определенными свойствами. В примере выше имеем две фазы: песок и вода.

Однако размеры частиц дисперсной фазы при их растворении в какой-либо среде могут стать настолько маленькими, что они перестанут проявлять свои индивидуальные свойства. В этом случае говорят о гомогенных или однородных субстанциях. В них хотя и находится несколько компонентов, но все они образуют одну фазу по всему объему системы. Примером гомогенной системы является раствор NaCl в воде. При его растворении из-за взаимодействия с полярными молекулами H2O кристалл NaCl распадается на отдельные катионы (Na+) и анионы (Cl-). Они однородно смешиваются с водой, и уже невозможно в такой системе найти границу раздела между растворимым веществом и растворителем.
Размер частиц
Что такое степень дисперсности? Эту величину необходимо рассмотреть подробнее. Что она собой представляет? Она обратно пропорциональна размеру частиц дисперсной фазы. Именно эта характеристика лежит в основе классификации всех рассматриваемых субстанций.
Общепринятая классификация
Классификация дисперсных систем по степени дисперсности приведена ниже:
Касательно приведенной классификации проясним два момента: во-первых, приведенный цифры являются ориентировочными, то есть система, в которой размер частиц будет 3 нм, не обязательно является коллоидом, она может представлять собой и истинный раствор. Это можно установить, изучив ее физические свойства. Во-вторых, можно заметить, что в списке используется фраза «условный размер». Связано это с тем, что форма частиц в системе может быть совершенно произвольной, и в общем случае имеет сложную геометрию. Поэтому говорят о некотором среднем (условном) их размере.
Далее в статье дадим краткую характеристику отмеченных типов дисперсных систем.
Истинные растворы
Как выше было сказано, степень дисперсности частиц в настоящих растворах настолько велика (их размер очень маленький, Вам будет интересно: Формулы площади сектора круга и длины его дуги
Атомы, которые находятся на поверхности частиц дисперсной фазы, обладают ненасыщенными химическими связями. Это означает, что они могут образовывать соединения с другими молекулами. Как правило, эти соединения возникают за счет ван-дер-ваальсовых сил либо водородных связей. Они способны удержать несколько слоев молекул на поверхности коллоидных частиц.
Степень дисперсности и удельная поверхность
Расчет величины S/m является непростой задачей. Дело в том, что частицы в коллоидном растворе имеют различные размеры, форму, а также поверхность каждой частицы обладает уникальным рельефом. Поэтому теоретические методы решения этой задачи приводят к качественным результатам, а не к количественным. Тем не менее, полезно привести от степени дисперсности формулу удельной поверхности.
Экспериментальный способ определения Sud заключается в вычислении объема газа, который адсорбируется исследуемым веществом, а также в измерении размера пор (дисперсная фаза) в нем.
Системы лиофильные и лиофобные
Важно отметить, что лиофобные (гидрофобные, если растворителем является вода) системы являются термодинамически нестабильными, что их отличает от лиофильных.
Свойства суспензий
Примерами суспензий в природе можно назвать мутную воду в реках или вулканический пепел. Использование человеком суспензий связано, как правило, с медициной (растворы лекарственных препаратов).
Коагуляция
Что можно сказать смесях веществ с различной степенью дисперсности? Частично этот вопрос уже был освещен в статье, поскольку в любой дисперсной системе частицы имеют размер, лежащий в некоторых пределах. Здесь лишь рассмотрим один любопытный случай. Что будет, если смешать коллоид и истинный раствор электролита? Взвешенная система нарушится, и произойдет ее коагуляция. Причина ее заключается во влиянии электрических полей ионов истинного раствора на поверхностный заряд коллоидных частиц.