Что такое дифференциация клеток и тканей
Дифференцировка клеток
Дифференцировка клеток — процесс реализации генетически обусловленной программы формирования специализированного фенотипа клеток, отражающего их способность к тем или иным профильным функциям. Иными словами, фенотип клеток есть результат координированной экспрессии (то есть согласованной функциональной активности) определённого набора генов.
В процессе дифференцировки менее специализированная клетка становится более специализированной. Например, моноцит развивается в макрофаг, промиобласт развивается в миобласт, который образуя синцитий, формирует мышечное волокно. Деление, дифференцировка и морфогенез— основные процессы, путём которых одиночная клетка (зигота) развивается в многоклеточный организм, содержащий самые разнообразные виды клеток. Дифференцировка меняет функцию клетки, её размер, форму и метаболическую активность.
Дифференцировка клеток происходит не только в эмбриональном развитии, но и во взрослом организме (при кроветворении, сперматогенезе, регенерации поврежденных тканей).
Содержание
Потентность
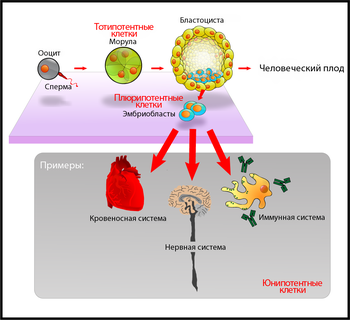
Общее название для всех клеток, ещё не достигших окончательного уровня специализации (то есть способных дифференцироваться), — стволовые клетки. Степень дифференцированости клетки (её «потенция к развитию») называется потентностью. Клетки, способные дифференцироваться в любую клетку взрослого организма, называются плюрипотентными. Для обозначения плюрипотентных клеток в организме животных используется также термин «эмбриональные стволовые клетки». Зигота и бластомеры являются тотипотентными, так как они могут дифференцироваться в любую клетку, в том числе и в экстраэмбриональные ткани.
Дифференцировка клеток млекопитающих
Самая первая дифференцировка в процессе развития эмбриона происходит на этапе формирования бластоцисты, когда однородные клетки морулы, разделяются на два клеточных типа: внутренний эмбриобласт и внешний трофобласт. Трофобласт участвует в имплантации эмбриона и дает начало эктодерме хориона (одна из тканей плаценты). Эмбриобласт даёт начало всем прочим тканям эмбриона. По мере развития эмбриона клетки становятся всё более специализированными (мультипотентные, унипотентные), пока не станут окончательно дифференцировавшимися клетками, обладающими конечной функцией, как например, мышечные клетки. В организме человека насчитывается порядка 220 различных типов клеток.
Небольшое количество клеток во взрослом организме сохраняют мультипотентность. Они используются в процессе естественного обновления клеток крови, кожи и др., а также для замещения повреждённых тканей. Так как эти клетки обладают двумя основными функциями стволовых клеток — способностью обновляться, поддерживая мультипотентность, и способностью дифференцироваться — их называют взрослыми стволовыми клетками.
Дедифференцировка
Дедифференцировка — это процесс, обратный дифференцировке. Частично или полностью дифференцировавшаяся клетка возвращается в менее дифференцированное состояние. Обычно является частью регенеративного процесса и чаще наблюдается у низших форм животных, а также у растений. Например, при повреждении части растения клетки, соседствующие с раной, дедифференцируются и интенсивно делятся, формируя каллус. При помещении в определённые условия клетки каллуса дифференцируются в недостающие ткани. Так при погружении черенка в воду из каллуса формируются корни. С некоторыми оговорками к явлению дедифференцировки можно отнести опухолевую трансформацию клеток.
Пути дифференцировки
Стволовые клетки могут дифференцироваться в конечное состояние разными путями
Рис. 1. Моторные (двигательные) нейроны, полученные из стволовых клеток. Голубой – DAPI, ядра клеток. Зеленый – белки, подтверждающие, что эти нейроны функциональны: Tubb3 – тубулин, белок микротрубочек в аксонах; Map2 – белок, связанный с микротрубочками; VACht – белок, транспортирующий вакуоли с нейромедиатором ацетилхолином. Изображение из обсуждаемой статьи в eLife.
Дифференцировка стволовых клеток, то есть их превращение в тот или иной клеточный тип, – это сложный многоступенчатый процесс. По пути в конечное состояние клетка проходит ряд промежуточных стадий. Существует два подхода к дифференцировке клеток in vitro. Можно последовательно воспроизводить процессы, происходящие в зародыше при развитии, и постепенно вести клетку в требуемом направлении. А можно сразу экспрессировать в клетке белки, характерные для конечного состояния. Будут ли в этом случае клетки проходить все промежуточные состояния или какие-то пропустят? Или же они вообще пойдут другим путем?
Развитие зародыша от зиготы до полноценного организма можно представить в виде дороги со множеством развилок. По мере того как клетки делятся, каждая из них выбирает путь, по которому она будет двигаться дальше, то есть приобретает некоторые характерные свойства (форму, внутреннее строение и экспрессию конкретных генов). В результате множества таких последовательных «решений» клетка достигает конечного состояния – одного из клеточных типов взрослого организма со всем набором его характерных признаков. Весь этот путь клетки в целом называют дифференцировкой, а итог – дифференцированным состоянием.
В 1954 году английский биолог Конрад Уоддингтон предложил модель эпигенетического ландшафта, которая, в частности, применима и к дифференцировке стволовых клеток. Этот ландшафт выглядит как горка с параллельными разветвляющимися колеями (креодами), а клетка представляется шариком, скатывающимся по этой горке (рис. 2.). Согласно этой модели, судьба клетки определяется раз и навсегда, и изменить ее уже не получится. Чтобы клетка оказалась вместо одного органа в другом, ей нужно перескочить в соседнюю колею, что в данной модели энергетически невыгодно.
Рис. 2. Эпигенетический ландшафт Уоддингтона. Под каждой колеей указано итоговое предназначение клетки: грудь, крыло, верхняя нога, нижняя нога, антенна, рот (речь идет о развитии дрозофилы). Изображение из книги: C. H. Waddington. «Principles of embryology». NY, 1956.
Идеи Уоддингтона остаются актуальными до сих пор, однако эксперименты со стволовыми клетками подсказывают нам новые правила обращения с этим ландшафтом. Так, в 2006 году японским ученым Такахаси и Яманаке удалось «забросить камень обратно на гору» – вернуть клетки мыши из терминально-дифференцированного состояния на уровень эмбриональных стволовых клеток зародыша, из которых можно получить любой клеточный тип (см. K. Takahashi, S. Yamanaka, 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors). Для этого в зрелые фибробласты мыши вводили 4 ключевых транскрипционных фактора, обеспечивающих стволовое состояние. Этот процесс назвали репрограммированием клеток. Однако сам Яманака отметил невысокую эффективность этого процесса: в первых экспериментах удавалось репрограммировать лишь 0,05% клеток.
Потом эти цифры выросли, в некоторых случаях даже до 10%, но большинство клеток всё равно не поддавалось методике (см. S. Yamanaka, 2009. Elite and stochastic models for induced pluripotent stem cell generation). Яманака предпринял попытку объяснить это через ландшафт Уоддингтона (рис. 3). Предположим, что мы пытаемся забросить шарик обратно на гору. На его пути может возникнуть несколько препятствий: он может не долететь до верха и скатиться вниз окончательно (в данном случае это означает апоптоз, то есть намеренную гибель клетки, стрелка 4), может докатиться до верха и не удержаться там (тогда клетка будет дифференцироваться снова в случайном направлении, стрелка 2) или может полететь в неправильном направлении и перескочить в соседнюю колею (дифференцироваться в другой тип, стрелка 3). И только в тех редких случаях, когда шарик долетает до верха и удерживается там, клетка репрограммируется и становится стволовой (стрелка 1).
Рис. 3. Применение ландшафта Уоддингтона к репрограммированию клеток. 1 – полный возврат к эмбриональному состоянию. 2 – неудавшееся репрограммирование. 3 – переход в другой тип клеток. 4 – клеточная гибель. Изображение из статьи: S. Yamanaka, 2009. Elite and stochastic models for induced pluripotent stem cell generation.
Но на этом приключения шарика на горке не заканчиваются. До недавнего времени были известны всего две основные методики работы со стволовыми клетками: дифференцировка и репрограммирование. Протоколы дифференцировки состояли из последовательного действия на клетки веществами, «направляющими» их в ту или иную сторону. Набор этих веществ определяли экспериментально, основываясь на реальных процессах развития. Если для дифференцировки клеток нервной системы на некоторой стадии в зародыше мыши нужна ретиноевая кислота, то и в лаборатории можно добавить ее в среду культивирования для получения нейронов. Теперь представим себе, что мы хотим получить, например, культуру нейронов человека. Можно взять его клетки кожи, репрограммировать до эмбриональных стволовых клеток, а затем дифференцировать в нейроны. Это оказывается долго и неэффективно, поэтому давно идет поиск более короткого пути.
Коротких путей обнаружилось два – прямая дифференцировка и трансдифференцировка. В ходе прямой дифференцировки предлагается получить нейроны из эмбриональных стволовых клеток без промежуточных стадий. Трансдифференцировка же предполагает получение нейронов напрямую из клеток кожи. Отметим сразу, что клеточные типы здесь даны как примеры, реально они могут быть практически любыми. Эти короткие пути осуществляются одним способом: в культуре исходных клеток (стволовых или дифференцированных) запускается экспрессия транскрипционных факторов, характерных для нужного клеточного типа (в данном случае, нейронов). Эффективность этих методов пока остается невысокой, однако оба они работают. Поэтому возникает множество вопросов: насколько функциональны полученные таким образом клетки? Какие механизмы лежат в основе ускоренной дифференцировки? Что при этом происходит с промежуточными стадиями, исчезают ли они полностью или частично сохраняются? Этими вопросами и задались авторы обсуждаемой статьи (рис. 4).
Рис. 4. Исследовательские вопросы авторов обсуждаемой статьи. а) Как в случае прямой дифференцировки обходятся промежуточные стадии? Возможные варианты: все стадии присутствуют, некоторые стадии пропущены, появляются альтернативные стадии. b) Какие из промежуточных стадий исчезают? Возможные варианты: самые ранние, самые поздние, весь путь отличается от классического. с) Получаются ли в результате прямой дифференцировки полноценные функциональные клетки? Возможные варианты: полное или частичное достижение эффекта. Изображение из обсуждаемой статьи в eLife.
Авторы работали с эмбриональными стволовыми клетками мыши. Они запустили параллельно стандартный протокол последовательной дифференцировки и прямую дифференцировку в моторные нейроны спинного мозга. Чтобы отследить, на каких стадиях находятся клетки, они анализировали РНК в отдельных клетках на ранних (4–5 день) и поздних (11–12 день) стадиях дифференцировки. Затем исключали клетки, от которых получено слишком мало РНК, и те, у которых обнаруживали повышенную экспрессию митохондриальных генов, связанных со стрессом: эти клетки, возможно, развивались аномально. В оставшихся клетках вычисляли гены, экспрессия которых статистически значимо менялась в ходе дифференцировки.
Это позволило определить основные стадии, через которые проходили клетки. При стандартном протоколе дифференцировки путь получился следующим: эмбриональные стволовые клетки – общие нейральные предшественники – клетки заднего отдела нервной системы – клетки брюшной стороны заднего отдела – предшественники моторных нейронов – ранние моторные нейроны – поздние (зрелые) моторные нейроны. При этом в культуре можно было обнаружить несколько стадий одновременно, так как клетки дифференцируются асинхронно. Ученые обнаружили, что при использовании стандартного протокола до поздних стадий доходило меньше клеток, чем при прямой дифференцировке, а также больше клеток отклонялось от намеченного пути и превращалось в другие типы. В то же время при прямой дифференцировке не удалось обнаружить двух стадий: клетки не приобретали постепенно свойств заднего и брюшного отделов нервной системы (рис. 5). При этом начальные и конечные стадии в обоих протоколах оказались очень похожими. Итогом стали полноценные и функциональные моторные нейроны.
Рис. 5. Последовательные стадии, которые проходят клетки при прямой (b) и постепенной (с) дифференцировке. По осям отложены статистические показатели, отражающие экспрессию характерных для разных стадий групп генов. Клетки с близкими значениями этих показателей считали находящимися на одной стадии. Обозначения стадий: ESC – эмбриональные стволовые клетки, NP – общие нейральные предшественники, PNP – клетки заднего отдела нервной системы, VNP – клетки брюшной стороны заднего отдела, MNP – предшественники моторных нейронов, EMN – ранние моторные нейроны, LMN – поздние (зрелые) моторные нейроны. Изображение из обсуждаемой статьи в eLife.
Это отличие прямой дифференцировки от стандартной наглядно показывает нам разницу между развитием клетки в эмбрионе и в культуре. В целостной системе, такой как зародыш, на ранних этапах возникает разметка плана строения, и только после этого начинается окончательная дифференцировка. Вероятно, это необходимо для адекватного взаимодействия между тканями и разными типами клеток в эмбрионе. В то же время эти стадии оказываются не критичными для последующего формирования функционального нейрона, если идет речь о культуре, где клетки не взаимодействуют с окружением. При прямой дифференцировке клетки проходили стадию, нехарактерную для стандартного протокола: в них включались гены переднего мозга. Впрочем, к поздним стадиям их экспрессия исчезала, и конечные стадии дифференцировки в обоих протоколах оказались очень похожими.
Технология прямой дифференцировки вызывает много вопросов и споров. Несмотря на ее эффективность, прежде чем использовать ее на практике, необходимо убедиться в том, что «нестандартные» пути развития клеток не привносят в них никаких побочных свойств. Авторы обсуждаемой статьи полагают, что стадия терминально-дифференцированной клетки относится к числу так называемых «бассейнов притяжения» (см. Basin of attraction), то есть устойчивых состояний, к которым стремятся все незначительно отличающиеся состояния и которые устойчивы к умеренным колебаниям окружающей среды. Это означает, что если в результате дифференцировки каким-либо образом будет достигнута экспрессия ключевых транскрипционных факторов, то клетка так или иначе придет к конечному состоянию. И вероятность того, что она в последний момент пойдет по другому пути, крайне мала. Если это действительно так, то можно ожидать, что короткие пути дифференцировки вскоре вытеснят длинные и традиционные, увеличив эффективность процесса и приблизив нас к использованию этих технологий в медицине.
Научная электронная библиотека
5.4.2.3.2. Роль паратгормон-родственного протеина в регуляции хондрогенеза и ингибировании гипертрофии хондроцитов при хондрогенной дифференцировке мезенхимальных стволовых клеток
Кроме индукции дифференциации стволовых клеток в хондрогенную линию, контроль фенотипической стабильности образования хряща после дифференциации также имеет решающее значение. Часто факторы и условия, которые усиливают хондрогенную дифференциацию стволовых клеток, также предрасполагают дифференцированные хондроцитоподобные клетки к преждевременной гипертрофии с терминальной прогрессией к апоптозу и замещением костными структурами в физиологическом процессе, известном как эндохондральная оссификация. Гипертротрофия хондроцитов является одним из ключевых физиологических процессов, связанных с продольным ростом длинных костей, однако регуляция гипертрофии также становится все более актуальной для клинического применения мезенхимальных стволовых клеток. Преждевременная гипертрофическая дифференциация хондроцитов является основным препятствием для рутинного использования МСК в генерации стабильного хряща и применения мезенхимальных стволовых клеток для восстановления хрящевых структур. Трансформирующий фактор роста (TGF-β) является сигналом против гипертрофии хондроцитов, тогда как костные морфогенные белки (BMPs) оказывают противоположное влияние. Кроме того, сигнальный путь
ПТГрП-Ihh признан самым мощным средством, опосредующим гипертрофию хондроцитов. Понимание перекрестных взаимодействий между TGF-β, BMPs и ПТГрП-Ihh может, таким образом, дать представление об устранении этого нежелательного явления с целью облегчения регенерации функционального и стабильного хряща на клеточной основе (Wang Y., et al., 2015).
Развитие хондрогенной дифференциации в направлении гипертрофии может быть связано с тем, что МСК, используемые в существующих подходах в тканевой инженерии в отличие от хряща in vivo, находятся на одном и том же этапе развития и потеряли физиологические пространственные и временные сигналы, которые могут регулировать формирование стабильного хряща. Во время развития скелета последовательная пролиферация и дифференциация хондроцитов жестко контролируется с помощью множества сигнальных путей, играющих жизненно важную роль в регуляции фенотипа хондроцитов. Многочисленные сигнальные пути вовлечены в регуляцию гипертрофических изменений хондрогенеза МСК и хондроцитов. По данным литературы, наиболее важными сигнальными путями являются Wnt, костный морфогенетический белок (BMP)/TGFβ, ПТГрП-Ihh, фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF) и гипоксия-индуцируемый фактор (HIF) (Kronenberg, H.M., 2003). Понимание этих путей необходимо для использования возможностей контроля гипертрофии хондроцитов в процессе регенерации хряща (Chen S., et al., 2015). ПТГрП блокирует гипертрофию, стимулируя гомеоблок NK3 2 (Nkx3,2) Provot S. et al., 2006) и предотвращая экспрессию RUNX2 (Zhang M. et al., 2009). Предполагается, что SOX9 является мишенью передачи сигналов ПТГрП в пластине роста и что повышенная активность SOX9 может влиять на эффект ПТГрП в поддержании клеток как негипертрофирующихся хондроцитов (Huang W. et al., 2000).
Хондрогенная гипертрофия характеризуется увеличением объема клеток более чем в 10 раз и структурным ремоделированием внеклеточного матрикса. Увеличение объема клеток (Bush P.G. et al., 2008) при гипертрофии сопровождается продукцией маркеров терминальной дифференцировки и повышением матричных металлопротеиназ (ММР), включая MMР-13 (Shimizu E. et al., 2010), коллагена X типа (Takeda S. et al., 2001; Stanton L.A. et al., 2004; Arnold M.A. et al., 2007), Ihh (Yoshida C.A. et al., 2004; Mueller, Tuan, 2008) и сосудистого эндотелиального фактора роста (VEGF) (Kwon T.G. et al., 2011), которые все являются мишенями фактора транскрипции 2 (Runx2) и функционально способствуют эндохондральная оссификации. MMP-13 деградирует коллаген II (Inada M. et al., 2004) и аггрекан (Fosang A.J. et al., 1996), которые являются ключевыми компонентами внеклеточного матрикса функционального хряща. Коллаген X типа осаждается внутри внеклеточного матрикса и служит основой для последующая кальцификация (Shen G., 2005). Многие сигнальные пути, включая, связанные с ПТГрП-Ihh (Indian Hedgehog), Wingless/Int (Wnt)/β-catenin и трансформирующий фактор роста β (TGF-β)/Sma и Mad Related Family (Smad), могут регулировать гипертрофию, но такие факторы, как гипоксия, совместная среда культивирования, эпигенетика и состав биоматериалов также могут влиять на экспрессию Runx2. Контроль гипертрофической дифференциации можно использовать как для восстановления хряща, где необходим стабильный фенотип, но также и при регенерации кости, где гипертрофический хрящ может действовать как шаблон для формирования эндохондральной кости (Studer D., et al., 2012). Grimsrud C.D., et al. (1999) исследовали взаимосвязь трех факторов роста во время созревания хондроцитов в культуре. Они подтвердили, что ПТГрП способен ингибировать созревание клеток, включая торможение индукции мРНК коллагена X типа, активности щелочной фосфатазы, увеличения размера хондроцитов и снижение пролиферации. Кроме того, они показывают, что ПТГрП также отменяет экспрессию мРНК костного морфогенного белка-6 (BMP-6). Ингибирующее действие на созревание хондроцитов может быть быстро отменено путем удаления ПТГрП из культур, и, кроме того, экзогенный BMP-6 может обойти ингибирующее действие ПТГрП на созревание. Хотя многие костные морфогенные белки, включая BMP-6, способны авторегулировать экспрессию мРНК, BMP-6 не смог индуцировать свою собственную продукцию в присутствии ПТГрП, несмотря на его способность индуцировать другие параметры созревания. Эти наблюдения составляют основу для их вывода о том, что подавление ПТГрП гипертрофии хондроцитов происходит путем ингибирования уровней BMP-6 и что гипертрофия может протекать, несмотря на индуцированное ПТГрП подавление эндогенного BMP-6, если клетки снабжены экзогенным костным морфогенным белком.
Гипертрофическая дифференциация хондроцитов представляет собой постепенный процесс развития от хондрогенной дифференциации до хрящевой минерализации, которая характеризуется рядом маркеров; каждый из которых имеет свою собственную функцию в ходе трансформации хрящевой ткани (Hellingman C.A., et al., 2012). Например, факторы транскрипции: транскрипционный фактор (RUNX2), ответственный за индуцирование дифференциации мультипотентных мезенхимальных клеток и миоцитарный энхансер фактор-2C (Mef2c), транскрипционный фактор, контролирующий гипертрофию хондроцитов и формирование кости (Arnold M.A. et al., 2007). Предполагается, что MEF2C является основным регулятором Runx2 который действует через Dlx5/Dlx6 (Verzi M.P. et al., 2007), а также маркеры терминальной дифференцировки и в том числе матриксная металлопротеиназа 13 (Studer D., et al., 2012), коллаген X типа, Ihh (Yoshida C.A., et al., 2004), щелочная фосфатаза и сосудистый эндотелиальный фактора роста (Mueller M.B., Tuan R.S., 2008; Kwon T.G., et al., 2011), которые все функционально способствуют эндохондральной оссификации. Матриксная металлопротеиназа 13 деградирует коллаген II типа и аггрекан, ключевые компоненты внеклеточной матрицы функционального хряща (Fosang A.J., et al., 1996). Коллаген X типа служит основой для последующей кальцификации через матричные везикулы (Shen G., 2005). Щелочная фосфатаза гидролизует пирофосфат до неорганического фосфата который в присутствии кальция образует гидроксиапатит (Anderson H.C., 2003). Ihh через цикл обратной связи ПТГрП-Ihh в эмбриональной пластине роста позволяет ПТГрП контролировать гипертрофию и регулировать пролиферацию хондроцитов (van Donkelaar C.C., Huiskes R., 2006). ПТГрП подавляет гипертрофическую хрящевую дифференцировку, тогда как сигнализация Ihh позитивно регулирует гипертрофический фенотип высокой транскрипцией и экспрессией коллагена X типа и RUNX2. Кроме того, известно, что канонический путь Wnt способствует гипертрофии хондроцитов посредством ингибирования сигнальной активности ПТГрП (Guo X. et al., 2009).
Наличие тонкого баланса перекрестных помех между сигнальными путями является требованием для нормального фенотипа хондроцитов (Zhong L., et al., 2015). К сожалению потенциальная хондрогенная гипертрофия дифференцированных клеток в значительной степени игнорируется (Chen S., et al., 2015). Фенотип МСК в восстановлении хряща нестабилен, что указывает на возможность дальнейшей дифференциации в направлении эндохондральной оссификации (Pelttari K., et al., 2006; Hennig T., et al., 2007). Сообщено, что индукция хондрогенеза МСК in vitro обычно сопровождается нежелательной гипертрофической дифференциацией (Mueller M.B., Tuan R.S., 2008). Развитие гипертрофического хряща часто заканчивается началом формирования эндохондральной кости. Для реконструкции хряща это нежелательно, так как хронически дифференцированный хрящ, продуцируемый МСК, минерализуется при имплантации in vivo.
Предполагается, что используемые в настоящее время условия культивирования могут приводить клетки к терминальной дифференциации и демонстрируется, что методы ингибирования терминальной дифференцировки (через ПТГрП, матричную металлопротеиназу 13 или блокирующее фосфорилирование Smad1/5/8) приводят к образованию хряща с уменьшением гипертрофических маркеров (Hellingman C.A., et al., 2012). Крайне важно систематически оценивать текущие стратегии минимизации гипертрофии хондрогенно дифференцированных клеток для обеспечения продукции высококачественной хрящевой ткани. Основной фактор роста фибробластов и ПТГрП могут ингибировать раннюю и позднюю хондрогенную дифференцировку МСК путем изменения синтеза и разложения внеклеточного матрикса хряща. Ингибирование происходит не только путем подавления экспрессии коллагена X типа, но также, возможно, путем подавления других хондрогенных белков (Liu Y., et al., 2013).
Способность ПТГрП регулировать созревание и гипертрофию хондроцитов, а также модулировать хондрогенную дифференциацию МСК является активной областью исследования. Было показано, что N-концевой фрагмент ПТГрП (1-34) ослабляет гипертрофию хондроцитов Weisser J., et al., 2002). Разные изоформы ПТГрП оказывают различное влияние на хондрогенную дифференцировку и гипертрофию мезенхимальных стволовых клеток. (Lee J.M., Im G.I. 2012). МСК, выделенные из костного мозга, культивировали в хондрогенной среде, содержащей трансформирующий фактор роста и одну из четырех изоформ ПТГрП (1-34, 1-86, 7-34 и 107-139). После 2 недель культивирования in vitro ПТГрП (1-34) значительно увеличивал экспрессию гена и белка хондрогенного маркера коллагена II типа и уменьшал показатели гипертрофических маркеров коллагена X типа и щелочной фосфатазы, в то время как другие изоформы показали противоречивые эффекты. Все изоформы ПТГрП значительно подавляют экспрессию гена и белка Ihh. Изоформа ПТГрП (1-34) наиболее значительно улучшила хондрогенез и подавила гипертрофию в МСК.
Благодаря зарегистрированным антигипертрофическим свойствам ПТГрП является эффективной молекулой-кандидатом для улучшения хондрогенеза МСК. Ввиду хорошо исследованного перехода от катаболического к анаболическому отклику в костной ткани, когда ПТГ или ПТГрП вводится с перерывами, а не постоянно (Esbrit P., Alcaraz M.J., 2013), представлялось целесообразным использование импульсного, а не постоянного режима введения ПТГрП, чтобы вызвать благоприятное воздействие на хондрогенез МСК. Это действительно направило МСК на хондрогенную дифференциацию при значительном увеличении содержания пептидов ДНК, протеогликана и коллагена II типа и снижения признаков гипертрофии. Импульсное воздействие ПТГрП может повышать пролиферацию МСК путем активации экспрессии cyclin D1 (Beier F., et al., 2001) или через ингибитор cyclin-зависимой киназы p57 (Kip2), который опосредует пролиферативные действия ПТГрП на хондроциты. (MacLean H.E., et al., 2004). В одной из ранних работ представлены данные о пиковом влиянии ПТГрП на экспрессию коллагена X типа в хондроцитах ростовых эпифизарных пластин через 24 часа (O′Keefe R.J., et al., 1997). Импульсное воздействие ПТГрП в течение 6 ч было очевидно достаточным для эффективного стимулирования экспрессии коллагена II типа, но слишком коротким, чтобы оказывать глубокое влияние на экспрессию коллагена X типа.
Fischer J., et al. (2014) исследовали, влияние прерывистого воздействия ПТГрП на экспрессию хондрогенных и гипертрофических маркеров дифференцировки: экспрессию гена коллагена II типа, коллагена X типа, Ihh, рецептора ПТГрП 1 типа (PTHR1) и матричной металлопротеиназы 13 (MMP13). Результаты исследования позволили констатировать, что прерывистая добавка ПТГрП во время хондрогенеза МСК усиливает экспрессию коллагена II типа и одновременно снижает гипертрофию в соответствии с уровнями Ihh и активностью щелочной фосфатазы. Постоянное воздействие ПТГрП (1-34) ингибирует хондрогенез через сигнализацию cAMФ/протеинкиназа A. Поскольку постоянное и прерывистое применение ПТГрП оказывало различное влияние на хондрогенез МСК, аторы пытались выяснить, могут ли они быть опосредованными с помощью расходящихся сигнальных путей. До сих пор мало известно о молекулярных механизмах действия ПТГрП на МСК во время хондрогенеза in vitro. В соответствии с предыдущими результатами впервые показано, что стимуляция сигнализации cAMФ/протеинкиназа A форсколином способна полностью воспроизводить как отрицательные эффекты постоянного применения ПТГрП, так и положительные анаболические эффекты прерывистого воздействия ПТГрП на осаждение хондрогенного внеклеточного матрикса. Заключая вышеизложенное можно констатировать, что прерывистое воздействие на МСК во время хондрогенеза представляет собой новое и эффективтое средство для увеличения осаждения хрящевых матриц вместе с одновременным подавлением нежелательных гипертрофических признаков. Несмотря на различающиеся эффекты постоянного и прерывистого воздействия ПТГрП на маркеры хондрогенной дифференцировки при обоих способах введения длительность сигнала является решающей переменной для достижения выявленных эффектов на хондрогенез МСК. Оба режима воздействия влияли на МСК в основном через cAMФ/протеинкиназа A-зависимый путь, тогда как участие сигнализации протеинкиназа C-зависимого пути кажется менее важным. В целом эти данные свидетельствуют о целесообразности дальнейшей оптимизации длительности сигнала и частоты импульсов по отношению к концентрации агонистов для полного развертывания потенциала импульсного применения ПТГрП на хондрогенез МСК. Ввиду этого прохондрогенного и антигипертрофического эффекта, наблюдаемого in vitro и первых перспективных результатов in vivo (Kudo S., et al., 2011), сейчас целесообразно рассматривать инъекции ПТГрП, используемые для профилактики остеопороза, в качестве средства поддержки стратегий регенерации хряща на основе МСК в клинических обстоятельствах.
Исследование влияния факторов роста и ПТГрП на раннюю и позднюю хондрогенную дифференциацию мезенхимальных стволовых клеток человека позволило констатировать, что основной фактор роста фибробластов (bFGF) или ПТГрП ингибировали TGF-бета-индуцированную экспрессию коллагена X типа и индукцию щелочной фосфатазы. Позднее повышение регуляции мРНК ПТГ/ПТГрП-рецептора предполагает, что ранние эффекты ПТГрП могут быть опосредованы рецептор-независимым путем. Таким образом основной фактор роста фибробластов и ПТГрП являются мощными ингибиторами раннего и позднего хондрогенеза, и не избирательно подавляют экспрессию коллагена X типа (Weiss S., et al., 2010).
Утверждается, что паракринная секреция аутологичных хондроцитов (например, связанная с ПТГрП) и/или прямые клеточные клеточные контакты (например, образование щелевых контактов) отвечают за улучшение хондрогенеза МСК (Yang Y., et al., 2012; Aung, A., et al., 2011; Lee J.S. Im, G.I., 2010; de Windt T.S. et al., 2015). Использование системы совместного культивирования суставных хондроцитов и МСК может усилить хондрогенез и подавить гипертрофию при хондрогенезе МСК. Методы культивирования МСК и аутологичных хондроцитов часто используются для улучшения индукции хондрогенной дифференцировки МСК вместо включения в культуру факторов роста (Yang H.N., et al., 2009; Chen J., et al., 2005). Совместная культура МСК с хондроцитами доказывает эффективную стратегию для образования стабильного хряща в нехондрогенной среде (Ko C.Y., et al., 2016; Kang N., et al., 2013). Совместное культивирование МСК и аутологичных хондроцитов изучалось в различных условиях с контактами клеток или без них. Основное внимание было привлечено к выявлению влияния аутологичных хондроцитов, оказываемого на МСК. Исследования совместного культивирования суставных хондроцитов и МСК свидетельствуют о том, что хондроциты усиливают хондрогенез МСК путем межклеточного взаимодействия посредством прямого клеточного контакта и/или путем секреции морфогенетических факторов в кондиционированной среде, которые еще не полностью охарактеризованы. Как описано в ряде исследований (Hubka K.M. et al., 2014), МСК и суставные хондроциты в соматических культурах прямого контакта с гранулами и каркасами показали улучшенный хондрогенез с более высокой экспрессией генов и синтезом белков хрящевой матрицы, чем один из типов клеток в монокультуре.
Помимо влияния хондроцитов, усиливающего хондрогенез МСК, недавние исследования также показали трофические эффекты МСК на функции хондроцитов. Однако результаты, полученные в ходе этих исследований противоречат друг другу и требуют дальнейшего изучения. Например, было обнаружено, что МСК, полученные из костного мозга оказывают трофические эффекты в хондрогенезе путем стимулирования пролиферации хондроцитов и формирования внеклеточного матрикса (Wu L. et al., 2011), и МСК из разных источников ткани, включая синовиальную мембрану, костный мозг и жировую ткань, оказывают эти трофические эффекты, независимо от происхождения ткани (Wu L. et al., 2012). С другой стороны, существуют также исследования, описывающие ингибирующее влияние трофических факторов МСК на хондроциты, где МСК снижали регуляцию хондроцитов и осаждение матриц (Lee et al., 2012; Xu et al., 2013).
Механизм, посредством которого совместная культура способствует устойчивому хондрогенезу, включает несколько факторов. Был продемонстрирован трофический эффект МСК, способствующий стимулированию пролиферации хондроцитов и формированию матриц (Wu L., et al., 2011; Wu L., et al., 2012). Прямой контакт клеток и связь через щелевые соединения могут также играть роль в хондрогенезе МСК (de Windt T.S., et al., 2015). Продемонстрировано, что растворимые факторы, производимые хондроцитами во время совместного культивирования с МСК, являются основной причиной хондрогенеза (Liu X., et al., 2010). Сообщалось, что хондроциты выделяют ряд растворимых факторов, которые способствуют хондрогенезу МСК во время культивирования in vitro, регулируя ремоделирование матрикса, пролиферацию клеток и синтез внеклеточных матричных компонентов стволовыми клетками (Acharya C., et al., 2012; Lettry V., et al., 2010; Cooke M.E., et al., 2011). Растворимые факторы, индуцированные хондроцитами, и прямая совместная культура являются мощными средствами улучшения хондрогенеза и подавления гипертрофического развития МСК. Cекретируемый хондроцитами ПТГрП был идентифицирован как фактор, участвующий в этом эффекте посредством ингибирования продукции коллагена X типа в совместной культуре МСК и человеческих суставных хондроцитов (Fischer et al., 2010). В этом исследовании авторы сравнили экспрессию щелочной фосфатазы, Ihh, коллагена X типа, мРНК ПТГрП суставными хондроцитами и МСК при их раздельном, а также совместном культивировании во время хондрогенеза in vitro, индуцированного TGFβ. Установлено, что суставные хондроциты продуцировали мРНК ПТГрП в течение всего периода культивирования. Среда, кондиционированная человеческими суставными хондроцитами, вызывала значительное ингибирование их гипертрофии, о чем свидетельствовала понижающая регуляция in vitro отношения мРНК коллагена X типа к мРНК коллагена II типа, относительное количество осаждения коллагена X типа и активность фермента щелочная фосфатаза. Напротив, МСК секретировали ПТГрП только на ранней фазе дифференцировки до 2–3 недель, а затем уровни мРНК ПТГрП снизились. В последующие недели культивирования МСК была зафиксирована сильная индукция Ihh. Таким образом, МСК отличались от фенотипически стабильной культуры суставных хондроцитов потерей эндогенной экспрессии ПТГрП во время культивирования, в то время как в культуре хондроцитов не наблюдалось такой аутокринной регуляции ПТГрП-Ihh. Дифференцировка МСК в изолированной хондрогенной среде напоминала события в эндрохондральных ростовых пластинах, в которых ПТГрП секретируется незрелыми хондроцитами, тогда как Ihh секретируется позже, что позволяет индуцировать фазу гипертрофии клеток. При совместном культивировании МСК и суставных хондроцитов отмечено существенное улучшения хондрогенеза, вызванного TGFβ, путем подавления развития гипертрофии и эктопической матричной минерализации МСК. ПТГрП был идентифицирован как важный растворимый фактор, участвующий в этом действии. Регуляция ПТГрП-Ihh, обнаруженная в этом исследовании, модулирует генерацию хондроцитов, которые не проявляют гипертрофического фенотипа и, таким образом, более подходят для использования в регенерации хряща.
Bian L. et al. (2011) исследовали влияние добавление хондроцитов к культурам МСК на свойства тканевого хряща и гипертрофии МСК при культивировании в гидрогелях гиалуроновой кислоты. Смешанные клеточные популяции были инкапсулированы в гидрогели и демонстрировали значительно более высокие модули Юнга, динамические модули, уровни гликозаминогликанов и содержание коллагена, чем конструкции, засеянные только МСК или хондроцитами. Кроме того, осаждение коллагена X типа, маркера гипертрофии МСК, было значительно ниже в конструкциях совместной культуры, чем в конструкциях, засеянных только МСК. Когда МСК и хондроциты культивировали в отдельных гелях, не было улучшения биомеханических и биохимических свойств сконструированной ткани. Авторы полагают, что совместное культивирование МСК и хондроцитов может быть использовано для улучшения свойств и предотвращения кальцификации инженерного хряща, образованного из МСК-сеяных гидрогелей.
В недавних исследованиях также изучали паракринные факторы, высвобождаемые хондроцитами, и их роль в системах культивирования с МСК. Сообщалось, что хондроциты выделяют ряд растворимых факторов, которые способствуют хондрогенезу МСК во время культивирования in vitro, регулируя ремоделирование матрикса, пролиферацию клеток и синтез внеклеточных матричных компонентов стволовыми клетками. Например, при объединении в непосредственной близости системы смешанных клеточных культур получали модифицированный хрящ с повышенными механическими свойствами (модуль Юнга и динамический модуль), и биохимическими характеристиками (уровни гликозаминогликанов и содержание коллагена) (Lettry V., et al., 2010; Kubosch E.J., et al., 2016). Интересно, что эти хондроциты также способствовали уменьшению осаждения коллагена X типа (Bian L., et al., 2011; Jikko A., et al., 1999), маркера гипертрофии МСК. Показано, что осаждение матрицы коллагена II типа в совместной культуре происходит исключительно из хондроцитов, а не из МСК (Mo X.T. et al., 2009). Эти результаты указывают на взаимную пользу для поддержания фенотипа в обоих типах клеток – наличие МСК в со-культурах стимулирует производство хондроцитами хрящевой матрицы, а хондроциты, по-видимому, предотвращают или замедляют гипертрофию дифференцирующихся МСК.
Важно отметить, что более полная характеристика взаимовлияния влияния этих двух клеточных систем необходима, чтобы полностью реализовать потенциал систем совместного их культивирования. В то время как в ряде исследований было обнаружено положительное влияние хондроцитов на хондрогенную дифференцировку МСК (Hwang N.S., et al., 2007; Alves da Silva M.L., et al., 2015; Zhong J. et al., 2016), в других исследованиях было обнаружено, что положительные эффекты обусловлены трофической ролью МСК в стимулировании пролиферации хондроцитов и осаждения матриц (Wu L., et al., 2011; Wu L., et al., 2012). Констатируется, что ПТГрП может способствовать хондрогенезу и подавлять гипертрофию во время хондрогенеза in vitro с понижающей регуляцией коллагена X типа и RUNX2 и повышающей регуляцией SOX9 и коллагена II типа (Kim Y.J., et al., 2008). Добавление ПТГрП в культуральную среду дозозависимо увеличивало содержание ДНК и глюкозоаминогликанов в гранулах человеческих MSC, Экспрессия гена коллагена I-A1 типа уменьшилась на три четверти,. МРНК SOX-9 увеличивалась до четырех раз, а экспрессия гена коллагена типа II-A1 резко увеличивалась в 4–7 раз Экспрессия гена коллагена типа X-A1 уменьшалось на треть, а экспрессия Runx-2 резко снизилась после воздействия ПТГрП. Mueller MB et al.,(2013) продемонстрировали, что ПТГрП (1-40) снижал экспрессию щелочной фосфатазы в гранулах МСК человека, культивируемых в стандартных хондрогенных условиях дозозависимым образом, Обнаружено, что включение ПТГрП в дозе 1 мкМ или 10 мкМ в хондрогенную индукционную среду привело к значительному подавлению активности коллагена типа X-A1 и щелочной фосфатазы в конструкциях хряща, сконструированных из костномозговых МСК пациентов с остеоартритом (Kafienah W., et al., 2007). Установлено, что изоформы ПТГрП оказывают различное влияние на хондрогенную дифференцировку и гипертрофию мезенхимальных стволовых клеток. ПТГрП (1-34) значительно увеличивал экспрессию гена и белка хондрогенного маркера коллагена типа II-a1 и уменьшал показатели гипертрофических маркеров коллагена типа X-a1 и щелочной фосфатазы, в то время как другие изоформы показали противоречивые эффекты. Все изоформы ПТГрП значительно подавляют экспрессию гена и белка Ihh. Из четырех изоформ ПТГрП (1-34, 1-86, 7-34 и 107-139) наиболее значительно улучшает хондрогенез и подавляет гипертрофию в человеческих МСК ПТГрП (1-34), поддерживая их использование для тканевой инженерии хряща (Lee J.M., Im G.I., 2012).
В качестве одного из ключевых факторов препятствующих гипертрофии хондроцитов ПТГрП активирует протеин-фосфатазу II (PP2A) (Huang W., et al., 2000), что приводит к дефосфорилированию HDAC4 и инактивации MEF2C (Kozhemyakina E., et al., 2009). Активация протеинкиназы С ингибирует активность p38 MAPK (Zhen X., et al., 2001). уменьшая фосфорилирование MEF2C (Stanton L.A., et al., 2004) и, в конечном счете, экспрессию гипертрофических генов (Han Y.S., et al., 2004). ПТГрП путем дефосфорилирования кальций/кальмодулин-зависимой протеинкиназы II (CaMKII), существенно блокирует переход от пролиферации хондроцитов к их гипертрофии (Li Y., et al., 2011). Кроме того, ПТГрП блокирует гипертрофию, стимулируя Nkx3,2 (Provot S. et al., 2006) и предотвращая экспрессию RUNX2 (Zhang M., et al., 2009).
Nkx3.2 подавляет экспрессию фактора созревания хондроцитов Runx2, а экспрессия Runx2 может нивелировать индуцированную Nkx3.2 блокаду созревания хондроцитов. В совокупности эти результаты показывают, что сигналы ПТГрП блокируют гипертрофию хондроцитов, частично поддерживая экспрессию Nkx3.2/Bapx1, которая, в свою очередь, подавляет экспрессию генов, необходимых для созревания хондроцитов (Provot S. et al., 2006). Сигналы Sonic Hedgehog (Shh) и BMP работают последовательно, чтобы установить положительный регуляторный цикл между SOX9 и Nkx3.2 (Zeng L., et al., 2002).
Тенденция к формированию гипертрофированных хондроцитов в ходе дифференцироовки МСК ограничивающая их клиническое применение может быть связана с тем, что МСК, используемые в существующих подходах к тканевой инженерии хрящевой ткани, находятся в условиях, отличающихся от условий их трансформации in vivo. Особенности временной регуляции передачи сигналов ПТГрП в хондрогенетически дифференцирующих МСК, влияние пространственной ПТГрП-сигнализации на созревание хондроцитов, которое более соответствует физиологическим сигнальным взаимосвязям in vivo, все еще недостаточно исследованы. Fahy N., et al., (2018) исследовали влияние пространственного градиента передачи сигналов ПТГрП на хондрогенную дифференциацию МСК. Обычно используемые протоколы для хондрогенной дифференциации МСК in vitro включают в себя определенную среду, содержащую фактор роста (TG-b) 3,4 (Johnstone B., et al., 1998 Barry F., et al., 2001). Однако такие стратегии ограничены из-за тенденции хондрогенно дифференцирующихся МСК трансформироваться в гипертрофические хондроциты после нескольких недель культивирования in vitro, что приводит к нестабильному фенотипу хряща (Pelttari K., et al., 2006; Hellingman C.A., et al., 2010). В отличие от хряща in vivo, МСК, используемые в протоколах продукции тканей хряща, находятся на одном и том же этапе развития и потеряли физиологические пространственные и временные сигналы, которые могут регулировать формирование стабильного суставного хряща. Во время развития скелета последовательная пролиферация и дифференциация хондроцитов жестко контролируется с помощью множества сигнальных путей, играющих жизненно важную роль в регуляции фенотипа хондроцитов.
Способность ПТГрП регулировать созревание и гипертрофию хондроцитов определила интерес к ПТГрП-индуцированному модулированию хондрогенной дифференцировки МСК, которая активно исследуется. В текущей литературе подчеркивается важность временного регулирования передачи сигналов ПТГрП в хондрогенезе дифференцирующихся МСК (Fischer J., et al., 2016; Fischer J., et al., 2014). Полученные из костного мозга, МСК человека, трансдуцировали аденовирусными векторами, сверхэкспрессирующими ПТГрП и высеваемыми в различные зоны фибрин-полиэстер-уретанового каркаса, которые культивировали в присутствии или в отсутствие трансформирующего фактора роста (TGF-β1). Экспрессия ПТГрП с помощью 3D-трансдуцированных МСК оказывала ингибирующее действие на гипертрофический маркер MMP-13, который был активирован МСК в ответ на стимуляцию TGF-β1 (Fahy N., et al., 2018). Избыточная экспрессия ПТГрП уменьшала секрецию MMP-13 по сравнению с контролем, а также увеличивала эндогенную продукцию белка TGF-β1. Этот эффект ПТГрП на продукцию TGF-β1 варьировал в зависимости от концентрации ПТГрП, которая изменялась в соответствии с применяемой стратегией аденовирусной трансдукции. Авторы продемонстрировали индукцию хондрогенеза МСК в ответ на избыточную экспрессию ПТГрП в отсутствие экзогенной стимуляции TGF-β1. Выявлено значительное увеличение уровней экспрессии гена aggrecan, SOX9 и ПТГрП-рецептора с помощью 3D-трансдуцированных ПТГрП сверхэкспрессирующих МСК по сравнению с контролем. Рецептор ПТГрП не экспрессируется недифференцированными МСК, и он активируется во время хондрогенной дифференциации. (Sekiya I. et al., 2002). Кроме того, 3D-трансдуцированные МСК значительно увеличивают-секрецию глюкозоаминогликана при отсутствии дополнительных хондрогенных стимулов. Эти данные свидетельствуют о потенциальном хондроиндуктивном эффекте гиперэкспрессии ПТГрП на МСК при отсутствии дополнительных стимулов. Наличие пространственного градиента ПТГрП-сигналов способствовало формированию более стабильного фенотипа хондроцитов в активно дифференцирующихся МСК. В дополнение к стимулированию хондрогенной дифференцировки сверхэкспрессия ПТГрП может усилить паракринную активность МСК за счет увеличения продукции TGF-β1, что также может быть выгодным эффектом в области инженерии хрящевой ткани.