Что такое десквамация эпителия
ДЕСКВАМАЦИЯ
Смотреть что такое «ДЕСКВАМАЦИЯ» в других словарях:
Десквамация — Шелушение кожи вследствие десквамации … Википедия
десквамация — шелушение, отслаивание, слущивание Словарь русских синонимов. десквамация сущ., кол во синонимов: 3 • отслаивание (5) • … Словарь синонимов
ДЕСКВАМАЦИЯ — (от лат. desquamo снимаю чешую) 1) чешуйчатое отслаивание горных пород со скалистых поверхностей под влиянием резких колебаний температур (главным образом суточных), преимущественно в пустынях и высокогорных районах.2) Слущивание клеток с… … Большой Энциклопедический словарь
ДЕСКВАМАЦИЯ — [desquamare снимать чешую] шелушение и отслаивание г. п. под влиянием резких колебаний температур. Обычно наблюдается в пустынях и в высокогорных р нах. В результате Д. образуется скопление плоских остроугольных обломков п. Син.: шелушение горных … Геологическая энциклопедия
десквамация — Шелушение и отслаивание горных пород под влиянием резких колебаний температуры. Обычно проявляется в пустынях и высокогорных областях. [Словарь геологических терминов и понятий. Томский Государственный Университет] Тематики геология, геофизика… … Справочник технического переводчика
десквамация — Отслаивание тонких округлых чешуй с обнаженных скалистых поверхностей горных пород под влиянием резких, главным образом суточных, колебаний температуры … Словарь по географии
десквамация — (лат. desquamare снимать чешую) 1) мед. шелушение кожи, отпадение, слущивание клеток покровных тканей; 2) геол. отслаивание вещества горных пород чешуйками под влиянием резких колебаний температуры (напр., в пустынных областях, высокогорных… … Словарь иностранных слов русского языка
десквамация — (от лат. desquamo снимаю чешую), 1) чешуйчатое отслаивание горных пород со скалистых поверхностей под влиянием резких колебаний температур (главным образом суточных), преимущественно в пустынях и высокогорных районах. 2) Слущивание клеток с… … Энциклопедический словарь
десквамация — rus десквамация (ж) eng desquamation, exfoliation fra desquamation (f), exfoliation (f) deu Desquamation (f), Abschuppung (f), Exfoliation (f) spa descamación (f), exfoliación (f) … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
десквамация — (desquamatio; от лат. desquamo, desquamatum снимать чешую) физиологический или патологический процесс слущивания эпителиальных клеток … Большой медицинский словарь
Десквамативный глоссит
Что провоцирует / Причины Десквамативного глоссита:
Этиология и патогенез окончательно не выяснены. Наиболее часто десквамативный глоссит (glossitis desquamativa, «географический» язык, эксфолиативный, или мигрирующий, глоссит) встречается при заболеваниях желудочно-кишечного тракта, вегетативно-эндокринных нарушениях, ревматических заболеваниях (коллагенозах). Предполагают также, что в возникновении десквамативного глоссита определенную роль играют вирусная инфекция, гиперергическое состояние организма, наследственные факторы. Заболевание встречается одинаково часто в разных возрастных группах, чаще у женщин.
Симптомы Десквамативного глоссита:
Процесс начинается с появления беловатосерого участка помутнения эпителия диаметром несколько миллиметров. Затем этот участок выбухает и в его центре нитевидные сосочки слущиваются, обнажая яркорозовый или красный участок округлой формы, выделяющийся на фоне окружающей его слегка приподнятой зоны помутнения эпителия. Участок десквамации быстро увеличивается, сохраняя ровные круглые очертания, но интенсивность десквамации уменьшается. Зона десквамации эпителия может быть разной формы и величины и представляет собой пятна красноватого цвета. Иногда участки десквамации имеют форму колец или полуколец. В области десквамации хорошо видны грибовидные сосочки в виде яркокрасных точек. Когда очаг десквамации достигает значительных размеров, границы его расплываются в окружающей слизистой оболочке, а в центре вслед за десквамацией начинает восстанавливаться нормальное ороговение нитевидных сосочков, в участках же ороговения, наоборот, наступает десквамация.
Очаги десквамации могут быть одиночными; но чаще они множественные и в результате постоянно сменяющихся процессов ороговения и десквамации наслаиваются друг на друга. На фоне старых очагов образуются новые, вследствие чего форма участков десквамации и окраска языка постоянно меняются, что придает поверхности языка вид, напоминающий географическую карту. Это и послужило обоснованием для названий «географический язык», «мигрирующий глоссит». Характерна быстрая смена очертаний очагов десквамации, картина меняется даже при осмотре на следующий день. Очаги десквамации локализуются на спинке и боковых поверхностях языка, обычно не распространяясь на нижнюю поверхность.
У большинства больных, особенно у детей, изменения на языке протекают без какихлибо субъективных ощущений и выявляются случайно, во время осмотра полости рта. Лишь некоторые больные жалуются на жжение, покалывание, парестезии, боли от раздражающей пищи. Пациентов также беспокоит странный вид языка; может развиться канцерофобия. Эмоциональные стрессовые со стояния способствуют более тяжелому течению процесса. Десквамативные глосситы, возникающие на фоне патологии желудочнокишечного тракта и других системных заболеваний, могут периодически обостряться, что часто обусловлено обострением соматических заболеваний. Обострение десквамативного глоссита сопровождается повышением интенсивности десквамации эпителия слизистой оболочки языка. Десквамативный глоссит примерно в 50 % случаев сочетается со складчатым языком.
Заболевание длится неопределенно долго, не причиняя беспокойства больным, иногда исчезает на длительный срок, затем вновь появляется на тех же или других местах. Встречаются случаи, когда десквамации возникают преимущественно на одном и том же месте.
Диагностика Десквамативного глоссита:
Распознавание заболевания особых трудностей не представляет, поскольку клиническая симптоматика его весьма характерна. Десквамативный глоссит следует дифференцировать от:
Лечение Десквамативного глоссита:
В случае отсутствия жалоб и неприятных ощущений лечение не проводят. При появлении жжения, болях рекомендуется санация и рациональная гигиена полости рта, устранение различных раздражителей. Особенно актуальны гигиенические рекомендации в случае сочетания десквамативного глоссита со складчатым языком, при котором анатомические особенности строения создают благоприятные условия для размножения микрофлоры в складках, что может служить причиной воспаления, вызывающего болевые ощущения. При наличии чувства жжения, болей целесообразны легкие антисептические полоскания, ирригации и ротовые ванночки с раствором цитраля (25-30 капель 1 % раствора цитраля на полстакана воды), аппликации 5-10 % взвеси анестезина в масляном растворе витамина Е, аппликации кератопластических средств (масляный раствор витамина А, масло шиповника, каротолин и др.). Хорошие результаты дает лечение кальция пантотенатом (по 0,1-0,2 г 3 раза в день внутрь в течение месяца). У некоторых больных положительный эффект отмечается от применения новокаиновых блокад в область язычного нерва (на курс 10 инъекций). При выраженной болезненности целесообразно назначать местные обезболивающие препараты. Обязательны выявление и лечение сопутствующих заболеваний. Указанное лечение является симптоматическим, оно направлено на устранение или уменьшение болезненных ощущений, снижение частоты рецидивов. Однако до сих пор не существует средств полного устранения рецидивов заболевания, особенно в пожилом возрасте. Нередко развивается канцерофобия. Профилактикой таких состояний могут быть индивидуальные беседы с больными и правильная деонтологическая тактика.
Прогноз заболевания для жизни благоприятный, возможность малигнизации десквамативного глоссита исключается.
К каким докторам следует обращаться если у Вас Десквамативный глоссит:
Географический язык (K14.1)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Период протекания
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Некоторые авторы выделяют в течении заболевания стадии обострения (острая фаза) и ремиссии.
Этиология и патогенез
Эпидемиология
Признак распространенности: Распространено
Соотношение полов(м/ж): 0.5
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
У подавляющего большинства пациентов заболевание протекает без жалоб и выявляется как случайная находка при осмотре.
Диагностика
Лабораторная диагностика
Дифференциальный диагноз
— химический ожог языка;
— рак слизистой полости рта;
— кандидоз;
— контактный стоматит;
— складчатый язык;
— красный плоский лишай;
— псориаз;
— вторичный рецидивный сифилис;
— плоская форма лейкоплакии;
— гиповитаминоз В1, В2, В12;
— системная красная волчанка;
— герпес;
— лекарственные поражения.
Осложнения
Лечение
В случае отсутствия жалоб и неприятных ощущений лечение географического языка не проводится. Специфическое лечение отсутствует.
Ключевые моменты
1. Диета. Исключение горячей и острой пищи.
2. При появлении чувства жжения или боли рекомендуются санация полости рта, устранение различных раздражителей, рациональная гигиена полости рта. Гигиенические рекомендации особенно важны при сочетании десквамативного глоссита со складчатым языком (благоприятные условия для размножения микрофлоры в складках).
Что такое десквамация эпителия
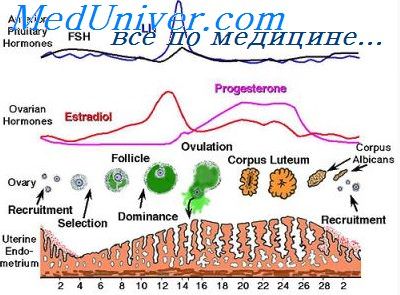
В этой фазе цикла слизистая оболочка матки, особенно ее функциональная зона, в значительной мере переполнена кровью. В связи с расширением капилляров, по которым вместе с кровью поступает материал, необходимый для образования секрета, постепенно наступает стаз (застой) крови в сосудах слизистой оболочки с его последующей транссудацией в окружающую ткань собственной пластинки. В результате этого слизистая оболочка, насыщенная кровяным транссудатом и слизистым секретом желез, набухает (приобретает отечную консистенцию) и размягчается, благодаря чему возникают благоприятные условия для нидации зародыша.
Во время фазы секреции в яичнике функционирует желтое тело, которое к концу фазы начинает постепенно дегенерировать и подвергаться обратному развитию. В этот период яйцевая клетка, выброшенная из граафова фолликула, передвигается по яйцеводу; в случае оплодотворения она нидирует в подготовленную таким образом слизистую оболочку матки. Фаза секреции, начавшись с 14—15-го дня менструального цикла, продолжается до 28-го дня включительно.
Фаза десквамации (отторжения — menstruum). В том случае, если оплодотворения и нидации яйцевой клетки к слизистой оболочке матки не произошло, желтое тело постепенно гибнет, а функциональная зона слизистой оболочки, перенасыщенная кровью в фазе секреции, становится ишемической, с недостаточным кровонаполнением, из-за сокращения сосудов и затрудненного притока крови; в связи с этим она все больше пропитывается жидкостью и размягчается при одновременной дегенерации ткани.
Таким образом распадающаяся, отслаивающаяся и дегенерирующаяся ткань функционального слоя слизистой оболочки, пропитанная кровяным транссудатом и секретами, постепенно в виде кусков, вместе с поверхностным эпителиальным слоем отторгается от базального слоя (decidua menstruationis). Отторженная слизистая вместе с кровью, изливающейся из нарушенных сосудов, смешивается с секретами маточных желез и выделяется из матки через влагалище.
Такое менструальное отделение крови (менструация) длится обычно четыре дня, то есть, начиная с первого дня менструального цикла и кончая четвертым днем включительно.
В яичнике в это время продолжается обратное развитие желтого тела, и начинает созревать новый фолликул, что представляет собой вступление к повторному восстановлению нарушенной слизистой оболочки.
Фаза регенерации (postmenstruum). После десквамации, отторжения функционального слоя слизистой оболочки матки поверхность ее полости покрыта одним лишь обнаженным базальным слоем слизистой; в это время базальный слой очень тонок, в нем располагаются основания маточных желез. В фазе регенерации, благодаря размножению эпителиальных клеток этих остатков желез, происходит регенерация поверхностного эпителия, который затем очень быстро покрывает раневую внутреннюю поверхность маточной полости. Сразу же после этого следует новая фаза пролиферации следующего менструального цикла.
Фаза регенерации заканчивается на 5-ый день менструального цикла.
Под регулярным двадцативосьмидневным повторением маточного цикла и менструального отделения крови подразумеваются средние сроки в рамках биологических вариаций. Менструальный цикл может подвергаться отдельным индивидуальным колебаниям; его отклонения как в отношении общей длительности всего цикла, так и в отношении продолжительности его отдельных фаз по сравнению со средними сроками (от 24 до 32 дней) еще не означают ничего ненормального или патологического, если они не связаны с иными нарушениями или же затруднениями. Таким образом, если менструация не длится в течение четырех дней, то это еще не является доказательством какого-либо нарушения.
Нередко наблюдаются трех- или же пятидневные менструальные отделения крови.
Этиопатогенетические механизмы десквамативных поражений кожи и обоснование терапии
Показано, что комбинированная терапия с применением этиотропных, энтеросорбирующих и иммунотропных средств для лечения десквамативных поражений кожи оказывает выраженный клинический эффект, удлиняет ремиссию и коррегирует иммунологические нарушения.
It was stated that combined therapy using etiotropic, enterosorbent and immunotropic medications for treatment of desquamative skin affections has a pronounced clinical effect, prolongs the remission and correct immunologic disorders.
Себорейный дерматит (СД) представляет собой хроническое рецидивирующее заболевание кожи волосистой части головы, лица и гладкой кожи тела, характеризующееся повышенным шелушением, гиперемией, сухостью кожных покровов и зудом.
Это распространенная патология, которая встречается как у детей грудного возраста, так и у пациентов старше 50 лет [1, 2]. Согласно современным данным ведущую роль в возникновении СД играет антропофильный гриб Malassezia furfur, относящийся к условно-патогенным микроорганизмам.
С дрожжеподобными грибами связывают возникновение и других кожных заболеваний. Показано, что этиологическим фактором экземы наружного слухового прохода у больных являются M. furfur, выделяемые из сухих серных пробок [3]. При таком заболевании, как фолликулит, из содержимого пустул высевают большое количество мицелиальных форм гриба M. furfur [4]. Также большой интерес вызывает M. furfur как микроорганизм, колонизирующий кожу у больных атопическим дерматитом, способный индуцировать высокий уровень специфических IgE-антител [5]. В других источниках сообщается о наличии специфичного гуморального ответа к антигенам M. furfur у больных псориазом [3].
Грибы рода M. furfur обитают на здоровой коже человека, потребляя жироподобные компоненты и выделяя антибактериальные и антигрибковые вещества. На сегодняшний день остаются не до конца выясненными причины трансформации Malassezia и переход ее из непатогенной формы бластоспоры в патогенную мицелиальную.
В последние годы проводятся многочисленные исследования по изучению роли специфического и гуморального иммунного ответа у больных десквамативными поражениями кожи. Выявлено увеличение в периферической крови интерлейкина (ИЛ) 10 на фоне депрессии интерферона гамма (ИНФ-γ) и снижения продукции провоспалительных интерлейкинов: ИЛ-1 альфа, ИЛ-2, ИЛ-6 и фактора некроза опухолей альфа (ФНО-альфа) у больных СД [6, 7]. В других работах обнаружено увеличение числа естественных киллеров (NK-клеток) и уровня антителообразования IgG и IgA. Показано, что у больных СД отмечается супрессия Т-клеточной функции [8, 9].
В пользу иммунной теории свидетельствуют факты о распространенности СД среди ВИЧ-позитивных пациентов и больных СПИДом, где частота встречаемости заболевания варьирует от 34% до 83% [10]. F. Ippolito и соавт. [11] рассматривают СД как клинический маркер ВИЧ-инфекции.
Среди многих причин развития СД существенная роль принадлежит нейроэндокринным нарушениям и гиперсекреции кожного сала. Повышенное салообразование, обнаруженное у пациентов с болезнью Паркинсона, способствует развитию дрожжей Malassezia [12], а механизм возникновения себорейного дерматита у пациентов с паркинсонизмом обусловлен нарушениями в эндокринной системе [13, 14].
К развитию заболевания предрасполагают изменения ферментативной активности органов желудочно-кишечного тракта и печени, вегетодистонические расстройства [15], нарушения гормонального равновесия [16].
Резюмируя данные литературы, следует все же отметить, что ни один из этиопатологических факторов не может считаться универсальным для обоснования механизмов развития СД.
Недостаточная изученность этиопатогенеза СД предопределяет трудности в лечении. Рекомендуемые лекарственные препараты остаются малоэффективными. В лучшем случае удается достичь временного улучшения и редко ремиссии. Ни одно из существующих средств не дает полного излечения.
Учитывая актуальность данной проблемы, целью настоящей работы явилось определить клинико-патогенетическое значение инфекционных патогенов и иммуногенетического статуса при десквамативных поражениях кожи, сформулировать концепцию патогенеза и разработать комплексную терапию.
Под наблюдением находилось 320 человек: у 146 (45,6%) пациентов был диагностирован себорейный псориаз (СП), у 174 (54,4%) — себорейный дерматит. По характеру клинической картины выделяли 2 разновидности СД: 79 пациентов с клиническими признаками жирной себореи, 95 — сухой себореи.
У 235 пациентов (73,4%) были выявлены сопутствующие заболевания, причем в 66,2% случаев относящиеся к категории хронических очаговых инфекций в виде гастрита, панкреатита, дискинезии желчного пузыря, холецистита.
С целью выявления микробиологических и иммунологических изменений у больных десквамативными поражениями кожи был проведен комплекс лабораторных методов исследования. Методы исследования подбирались таким образом, чтобы можно было раскрыть патогенетические механизмы формирования десквамативных заболеваний кожи.
Проведенное комплексное обследование позволило уточнить решенные и выявить нерешенные вопросы десквамативных поражений кожи, позволяющие по-новому представить патогенез этих заболеваний и выработать тактику к совершенствованию терапии.
Результаты проведенных исследований помогли выявить у больных себорейным дерматитом грубые изменения как в количественном, так и в качественном составе микробиоценоза кожи и кишечника. Сущность этих изменений в том, что в зоне себорейных поражений неизменно возрастает число S. capitis и S. epidermidis в 80% высева (lg КОЕ/см 2 = 4,91 ± 1,18) и в 53,3% (lg КОЕ/см 2 = 3,81 ± 0,89) соответственно. С меньшей частотой (26,6%), но довольно с высокой степенью обсемененности (lg КОЕ/см 2 = 4,79 ± 1,88) на пораженных участках кожи волосистой части головы присутствуют Micrococcus и Acinetobacter (13,3%) — типичные оппортунистические патогены.
Существенные различия в составе микрофлоры и степени обсемененности пораженных участков кожи головы были выявлены в зависимости от варианта течения СД. В группе больных СД, протекающим с признаками жирной себореи, чаще, чем у больных с признаками сухой себореи, на пораженных участках кожи волосистой части головы присутствовал S. epidermidis, Micrococcus spp. и Acinetobacter spp.
При сравнительном анализе частоты высева (%) и степени обсемененности (lg КОЕ/см 2 ) микрофлорой пораженных участков волосистой части головы у больных себорейным дерматитом в зависимости от распространенности патологического процесса существенных различий не выявлено, но при локализации процесса только на коже головы доминирующее место среди выделенной микрофлоры занимают S. capitis и Micrococcus spp. В то время как при распространении патологического процесса и на кожу лица существенно возрастает частота высева S. epidermidis.
При изучении дисбиотических изменений микрофлоры кишечника в зависимости от распространения процесса у больных десквамативными поражениями кожи волосистой части головы степень выраженности дисбиотических изменений микрофлоры кишечника с вовлечением в патологический процесс кожи лица и кожи головы становится более выраженной. В этой группе больных уровень концентрации бифидобактерий, E. coli lac+/hem был достоверно ниже по сравнению с группой пациентов с локализацией клинических проявлений на лице.
При сравнительном анализе выраженности дисбиотических изменений в зависимости от варианта течения заболевания, концентрация Lactobacterium spp., Bacteroides spp., Clostridium spp. (H2S+, Lec-) и Enterococcus spp. в группе больных с признаками жирной себореи присутствовали у больных в меньшем проценте случаев и в более низких концентрациях, чем у больных с признаками сухой себореи. Частота высева в этой группе Enterococcus spp. была снижена на 3–4 порядка от нормы.
Очевидно, что в условиях дисбиотических нарушений в коже волосистой части головы создаются условия для образования и действия биологически активных веществ, обеспечивающих прогрессирование патологического процесса, распространения его на кожу лица. Известно, что при дисбактериозе нарушается одна из главных функций нормальной микрофлоры — ее антагонистическая активность в отношении условно-патогенных микроорганизмов.
При исследовании микроэкологического статуса организма методом масс-спектрометрии выявлялись изменения, связанные с пятикратным ростом концентрации фузобактерий и более чем двадцатикратным увеличением концентрации Eubacterium moniliforme. Eubacterium — родственные клостридиям микроорганизмы, являющиеся одними из основных обитателей кишечника. Род Eubacterium в настоящее время насчитывает более 30 видов, из которых 28 являются сахаролитическими, т. е. способны ферментировать углеводы с накоплением смеси низкомолекулярных жирных кислот. Именно эта группа эубактерий является физиологической для организма-хозяина и представляет собой один из компонентов микробиоты, в норме сосуществующей с макроорганизмом на основе взаимовыгодных симбиотических отношений. Отдельные варианты сахаролитических эубактерий способны синтезировать витамины, в частности кобаламин, аминокислоты (аланин, валин, изолейцин), расщеплять целлюлозу, участвовать в обмене стероидных гормонов. Вместе с тем, как и в случае бактероидов, сахаролитический кластер эубактерий в кишечном биотопе поддерживается благодаря регулирующей деятельности ключевых эндогенных анаэробов из родов: Bifidobacterium, Lactobacillus, Propionibacterium. Следует отметить, что при данной патологии практически у всех больных (95,4%) существенно (в среднем в 2,1 раза) снижено количество лактобактерий, которые в тонкой кишке в кооперации с организмом хозяина являются основным микробиологическим звеном колонизационной резистентности.
Также более чем вдвое растет концентрация маркеров Clostridium ramosum и актинобактерий Streptomyces, почти у всех больных возрастает количество Clostridium perfringens, — до 10 и 100 раз в двух случаях. Хотя этот микроб не дает существенного абсолютного вклада в изменение микроэкологии больных СД в целом, его нельзя недооценивать в патологическом плане: Clostridium perfringens образует как минимум 12 токсинов и энтеротоксин. Мишени для основных токсинов — биологические мембраны в различных тканях. Поражения обуславливают ферментативные процессы, катализирующие гидролитическое расщепление и нарушение клеточной проницаемости с последующим отеком и аутолизом тканей, характерными для газовой гангрены.
При исследовании концентрации Malassezia оказалось, что и в самой культуре дрожжей Malassezia эти вещества присутствуют в большой концентрации, особенно 10h16 (10-гидрокси-пальмитиновая кислота), содержание которой достигает 10 мг/г биомассы. Она и была принята в качестве основного маркера при исследовании концентрации Malassezia в различных биоматериалах и ее изменении при заболеваниях кожи. В результате было найдено, что концентрация 10h16 на коже в норме у доноров (n = 15) составляет в среднем 14,4 нг/мл кожного сала, в крови — 6 нг/мл, ногтях — 2 нг/мл, фекалиях — 33 нг/мл. При акне (n = 50) содержание Malassezia не отличается от нормы и составляет 15,2 нг/мл, при алопеции (n = 30) — 5–8 нг/мл. При этом как у доноров, так и у больных отмечены единичные случаи высоких концентраций маркера Malassezia — до 200 нг/мл. Однако при СД в капиллярной крови с кожи головы (n = 10), равно как и в кожном сале (n = 15), получен устойчиво повышенный уровень его содержания 52,7 нг/мл в среднем. Измерения проведены одним методом в количественно сопоставимом режиме при биологической воспроизводимости 20% относительных. Этот опыт убедительно показывает, что только в случае себорейного дерматита дрожжи Malassezia можно рассматривать в качестве одного из инфекционных агентов.
Таким образом, у всех больных СД в зоне поражения отмечается чрезмерный рост отдельных микроорганизмов, что ведет за собой создание благоприятных условий для образования множества токсических метаболитов, которые оказывают повреждающее действие на биологические мембраны. Аналогичные изменения у этих больных возникают и в биоценозе кишечника, формируется пролонгированное состояние эндотоксинемии с фиксацией эндотоксинов на клетках кожи, что в конечном итоге приводит к хроническому воспалению, в том числе и за счет включения кожи в иммунопатологический процесс.
Для определения эндотоксинемии оценивались показатели эндотоксина у больных десквамативными заболеваниями кожи. Было выявлено увеличение интегральных показателей концентрации липополисахарида (ЛПС) в общем кровотоке у больных СП и СД (1,95 ± 1,4 EU/мл, где EU — единица эндотоксина (EU — Endotoxin Unit), и 1,45 ± 0,67 EU/мл соответственно при норме 0–1 EU/мл).
При изучении гуморального звена антиэндотоксинового иммунитета выявлено снижение титров антител к гликолипиду (ГЛП) хемотипа Re и к ЛПС Escherichia coli O14 c общим антигеном у больных СП на 30% (138,3 ± 33,2 у.е. О.П. (титры антиэндотоксиновых антител в условных единицах оптической плотности)) и 35% (259,4 ± 72,4 у.е. О.П.) соответственно, у больных СД на 26% (146,8 ± 57,1 у.е. О.П.) и 37% (251,0 ± 40,7 у.е. О.П.) соответственно.
Проведенный анализ средних показателей концентрации антибактериальных антител (АТ) в исследуемых группах показал, что для пациентов СП характерны следующие изменения: увеличение концентрации антител к стафилококку и бактероидам и синегнойной палочке, на фоне снижения концентрации АТ к пневмококку, E. coli, клебсиелле и ГЛП.
Для больных СД преимущественно изменения проявлялись в увеличении уровня концентрации АТ к C. albicans, синегнойной палочке, протею, а также к бактероидам, с уменьшением концентрации АТ к ГЛП, клебсиелле и E. coli.
Таким образом, у пациентов десквамативными поражениями кожи отмечается снижение активности гуморального антиэндотоксинового иммунитета (АЭИ), что свидетельствует о развитии эндотоксинемии, этиологическими факторами которой могут быть различные условно-патогенные и сапрофитные представители бактерий кишечной микрофлоры.
При изучении иммунного статуса больных СД выявлялись существенные нарушения в характере иммунологического реагирования: у 70% и 50% больных количество моноцитов и палочкоядерных нейтрофилов было выше, уровень спонтанной хемилюменинсценции, хемилюменинсценции, индуцированной зимозаном, и индуцированной форболмиристатацетатом хемилюменинсценции оказался выше нормы на 75%, 60% и 50% соответственно.
Нарушения в субпопуляции состава Т-клеток сопровождались активацией естественных киллеров на 45% и активированных NK-клеток, экспрессирующих HLA-DR-молекулы, на 65% и резким увеличением фенотипа NK-клеток CD16 + 56 + на 90%, что является характерными признаками хронической инфекции.
Анализ некоторых показателей гуморального звена иммунитета показал, что в 65% больных повышалось содержание IgG в крови, что свидетельствует об усиленной продукции антител в течение длительного времени. В то же время у 90% больных отмечалась усиленная экспрессия молекул CD25 (α-цепь рецептора интерлейкина-2) на CD4 + T-клетках, что свидетельствует об активной фазе инфекционно-воспалительного процесса.
Были исследованы изменения иммунного статуса в зависимости от степени выраженности клинических проявлений. Больных распределили на 2 группы: с обычными признаками неосложненного СД — десквамацией и зудом (1-я группа — 12 человек) и наличием эритемы наряду с десквамацией и зудом (2-я группа — 8 человек).
Увеличение площади распространения у больных СД коррелировало с достоверно более высоким уровнем экспрессии молекул HLA-DR на CD4 + Т-хелперах (p = 0,008), CD8 + Т-клетках (p = 0,06) и NK-клетках (p = 0,08). Также на 60% (p = 0,02) увеличена функциональная активность нейтрофильных гранулоцитов и достоверно повышена цитолитическая активность комплемента (p = 0,02).
Для изучения корреляционных связей между клиническими и иммунологическими показателями был изучен иммунный статус у больных СД в зависимости от продолжительности заболевания. Больные были распределены на 3 группы с длительностью заболевания от 1 до 5 лет, от 5 до 10 лет, более 10 лет.
У больных со сроком заболевания до 5 лет происходит активация иммунной защиты в виде накопления CD8 + Т-клеток-киллеров, содержащих в цитоплазме киллерный белок перфорин.
С увеличением длительности заболевания более 10 лет происходит истощение активированных звеньев иммунитета на фоне дополнительной компенсаторной активации экспрессии рецепторов интерлейкина-2 (CD25) на CD8 + и CD4 + Т-клетках и существенного нарастания продукции IgG и IgA, что характерно для хронического инфекционного воспаления эпителиальных покровов. Проведенное сравнение иммунологических сдвигов у больных СД, имевших сопутствующие заболевания желудочно-кишечного тракта (ЖКТ), с больными СД без сопутствующих заболеваний ЖКТ, показало отсутствие корреляционных связей описанных выше изменений иммунограмм.
Таким образом, результаты проведенного исследования свидетельствуют о нарастании изменений иммунограмм в зависимости от степени выраженности клинических симптомов болезни. В то же время динамика иммунологических показателей находится в корреляционной зависимости от продолжительности клинического процесса. Очевидно, что на начальных стадиях заболевания (до 5 лет) происходит активация иммунопатологических механизмов, за счет вовлечения в реакции иммунологического реагирования различных звеньев иммунной системы. При продолжительности заболевания более 10 лет возникают признаки недостаточности отдельных звеньев иммунитета, связанные с недостаточностью компенсаторных возможностей организма.
При исследовании полиморфизма генов системы HLA-I класса и специфичности DRB1, DQA1, DQB1 II класса у пациентов себорейным дерматитом было обнаружено, что степень вероятности развития болезни у пациентов выявлена по HLA-антигенам А2 (54,2% и 49,3%), А1 (41,7% и 23,4%), А3 (20,8% и 24%), А9 (37,5% и 22%) соответственно. Кроме того, при СД выявлена ассоциативная связь с конкретными антигенами А10 и А23. Изучение связей между антигенами системы HLA-I класса и СД по локусу В корреляций не выявило.
Анализ результатов проведенных исследований показал, что самыми распространенными в локусе DRB1 являются антигены DRB1 (4), (13) и (15). В локусе DQA1 c высокой частотой обнаруживаются гаплотипы DQA1 (501) и DQA1 (102). С наибольшей частотой 55% в локусе DQB1 встречается DQB1 (602).
При изучении достоверной связи исследуемых HLA специфичности II класса статистически значимая взаимосвязь аллелей локусов установлена не была.
Полученные результаты свидетельствуют о наличии ассоциативных связей системы HLA с СД, что позволяет относить заболевание к генетически детерминированным.
Очевидно также, что появление в крови бактериальных антигенов реализуется в условиях повышенной проницаемости сосудистой стенки, чему способствует снижение антибактериальных антител в крови, вследствие чего в общем кровотоке возрастает концентрация эндотоксина и реализуется механизм эндотоксиновой агрессии, исходом которой будет фиксация бактериальных антигенов на субстрате кожи волосистой части головы, что, очевидно, возможно в условиях генетической предрасположенности.
Исходя из представленной гипотезы патогенеза, становится очевидным, что для обеспечения эффективной терапии десквамативных заболеваний кожи волосистой части головы в высшей степени обосновано применять прежде всего этиотропные препараты, направленные на подавление бактериальной флоры, на восстановление нормального биоциноза кишечника и очагов поражения, на снижение факторов эндотоксиновой агрессии, подавление реакций иммунного восстановления, с одновременным усилением реакций иммунологического реагирования (иммунокорректоры) с целью элиминации факторов бактериологической агрессии.
Таким образом, все вышеперечисленные направления лечебных мероприятий позволяют предложить для терапии десквамативных поражений кожи следующие лекарственные средства: Гептрал (активное вещество — адеметионин (S-аденозил-L-метионин)) по 5 мл внутримышечно, ежедневно в течение 10 дней; Энтеросгель — (энтеросорбент) в дозе 1,5 г/кг в сутки; Бифидум № 791 — биологически активная добавка, которая представляет собой комплекс антагонистических активных бифидобактерий, а также витамины группы В, С, РР и незаменимые кислоты. Схема применения по 3 мл per os однократно на ночь; Виферон® — рекомбинантный aльфа-2b интерферон в сочетании с антиоксидантами (витаминами Е и С) в суппозиториях по 500 000 МЕ 2 раза день 3 раза в неделю; Виферон® — рекомбинантный aльфа-2b интерферон в виде геля, содержащий 36 000 МЕ в 1 г геля, и антиоксиданты (токоферол ацетат, бензойная и лимонная кислота).
Под наблюдением находились 65 пациентов, получавших различные виды терапии. 30 пациентов десквамативными поражениями кожи, из них 17 пациентов себорейным псориазом и 13 себорейным дерматитом получали комбинированную терапию с учетом всех вышеперечисленных лекарственных средств.
Остальные 35 (19 больных — СП и 16 — СД) находились на традиционной схеме лечения: сосудистые препараты, седативные и витаминные комплексы.
Наружно все больные, находившиеся на комбинированной и традиционной терапии, получали антимикотические и кератолитические средства в виде шампуней. Продолжительность лечения составила 21 день.
В результате проведенного лечения средние показатели концентрации эндотоксина в общем кровотоке у пациентов десквамативными поражениями кожи остались без каких-либо существенных изменений. Но интегральные показатели гуморального звена антиэндотоксинового иммунитета и титр антител к Re-гликолипиду в обеих группах, наоборот, имели тенденцию к нормализации на 20% и 19% при СП соответственно, при СД на 15% и 4,5% соответственно.
Также у больных СП прослеживалась тенденция к нормализации средних показателей АТ к бактериям: стафилококку и синегнойной палочке в сторону уменьшения на 39% (7,6 ± 2,1 МЕ/мл) и 53,1% (5,9 ± 4,0 МЕ/мл) соответственно, показатели к клебсиелле — в сторону увеличения.
У пациентов СД концентрация АТ к С. albicans имела тенденцию к нормализации, к протею и синегнойной палочке уменьшилась в 1,3 и 1,4 раза соответственно. Значение других грамотрицательных бактерий были без существенных изменений.
В результате проведения комбинированной терапии у больных СП произошла активация Th1 лимфоцитов CD4 хелперов и снижение CD8 + лимфоцитов, индекс иммунорегуляции составил 1,75. Следует отметить, что при применении иммунокорригирующей терапии отмечалось снижение уровня апоптоза (CD95) по сравнению с исходными данными с 15% до 10,9% и уменьшение содержания CD25 (ИЛ2r + клеток) с 4,6% до 1,7%. Кроме того, повысился уровень лимфоцитов с фетотипом цитотоксичности NK (CD16 + клеток) и В-лимфоцитов (CD19 + ). Концентрация иммуноглобулинов G, A и М осталась без значимых изменений. Абсолютный фагоцитарный показатель приближался к норме.
У больных СД до и после лечения изменения в иммунорегуляторном звене характеризовались повышением CD4 Т-хелперов, в то время как уровень CD8 + клеток не изменился. Индекс иммунорегуляции достиг нормативных значений, а уровень апоптоза клеток CD95 снизился с 24,3% до 7,73%. Первоначальные показатели субпопуляции лимфоцитов с фенотипом цитотоксичности ИЛ2r + клеток были снижены. После проведения курса терапии значения были изменены незначительно. Остальные показатели не отличались от исходных.
Оценку эффективности проводимой терапии у больных десквамативными поражениями кожи осуществляли по комплексу наиболее информативных клинических признаков, в том числе субъективных симптомов заболевания — эритемы, отека, папулы, зуда и других оценочных критериев.
В исследуемой группе больных десквамативными поражениями кожи, получавших комбинированную терапию, установлен достаточно быстрый регресс клинических признаков воспаления. Положительный эффект начинал проявляться с 3–5 дня после начала терапии. Клиническое выздоровление наступало в более поздние сроки.
Сравнительный анализ клинической эффективности выявил, что в группе больных СП, получавших комплексную терапию, клиническое выздоровление отмечалось у 18% пациентов, в то время как в группе сравнения клиническое выздоровление не было зарегистрировано ни у одного наблюдавшегося больного. Отсутствие эффекта у пациентов, находившихся на традиционной терапии, встречалось в 5,2 раза чаще, чем у больных, получавших комплексное лечение.
При сравнении клинической эффективности комплексной и традиционной терапии у больных СД клиническое выздоровление отмечалось в 30% и 6% случаев соответственно. Значительное улучшение — в 46% и 25% соответственно. В группе пациентов, получавших комплексное лечение, улучшение патологического процесса регистрировалось у 24%, отсутствие клинического эффекта не отмечали.
У 50% пациентов, находившихся на традиционной терапии, было диагностировано улучшение клинического процесса, а в 19% проводимое лечение оказалось не эффективным.
Таким образом, комбинированная терапия с применением этиотропных, энтеросорбирующих и иммунотропных средств оказывает выраженный клинический эффект, удлиняет ремиссию в среднем на 6–8 месяцев и корригирует иммунологические нарушения, что патогенетически обосновывает назначение комплексной терапии, которая может быть использована в качестве основы базисного лечения десквамативных поражений кожи.
Литература
И. В. Полеско, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва