Что такое деполяризация мембраны
Что такое деполяризация мембраны
• Потенциал действия обеспечивает клеткам способность быстро взаимодействовать друг с другом
• Ключевыми элементами потенциала действия являются потоки ионов Na+, К+ и Са2+
• Деполяризация мембраны обеспечивается потоком в клетки ионов Na+ через потенциал-зависимые Na+-каналы
• Реполяризация возникает за счет транспорта ионов К+ через несколько различных К+-каналов
• Электрическая активность органов выражается как сумма векторов потенциала действия
• Нарушения генерации или распространения потенциала действия могут предрасполагать к развитию аритмий или эпилепсии
Нейроны, мышечные и эндокринные клетки относятся к числу возбудимых клеток, поскольку они могут создавать электрические сигналы и/или отвечать на них. В этих клетках происходят быстрые обратимые изменения мембранного потенциала, которые переводятся в электрические сигналы, например в нервный импульс, распространяющийся по аксону нейрона, или в сигнал, который приводит к мышечному сокращению. Такой электрический сигнал называется потенциал действия.
Процесс восприятия в головном мозгу включает обработку огромного количества потенциалов действия. Эти потенциалы действия могут возникать до появления стимула, одновременно с ним, или после него, и имеют различные пространственные и временные характеристики. В клетках скелетных мышц и миокарда потенциал действия играет критическую роль в инициации и координации процесса их синхронного сокращения. Амплитуда и продолжительность потенциала действия измеряются электрофизиологическими методами. В нейронах продолжительность потенциала действия составляет несколько миллисекунд, а в клетках миокарда — сотни миллисекунд.
Более высокая продолжительность потенциала действия в клетках миокарда необходима для координации процессов активации в миллионах мышечных клеток, ответственных за сердечные сокращения. Распространение потенциала действия по мембране происходит со скоростью несколько метров в секунду. Этим обеспечивается быстрая взаимосвязь на значительном расстоянии между клетками. Такая связь является основой для реализации сложных физиологических функций головного мозга и сердца.
Ключевую роль в генерации потенциала действия играет трансмембранный потенциал. В состоянии покоя в клетке поддерживается отрицательное значение мембранного потенциала, т. е. внутренняя ее среда по отношению к внешнему окружению заряжена несколько более отрицательно.
Мембранный потенциал покоя поддерживается, главным образом, за счет действия Na+/K+. АТФаз, которые нагнетают в клетку три иона Na+ на каждые два иона К+, транспортируемые из клетки, а также за счет функционирования К+-каналов.
Около пятидесяти лет назад на основании электрофизиологических данных была предложена модель механизма возникновения потенциала действия. Модель предусматривает два ключевых момента, определяющих возникновение потенциала действия:
• наличие обратимых скоординированных изменений в селективной проводимости клеточной мембраны для ионов Na+ или К+;
• эти изменения проводимости зависят от мембранного потенциала.
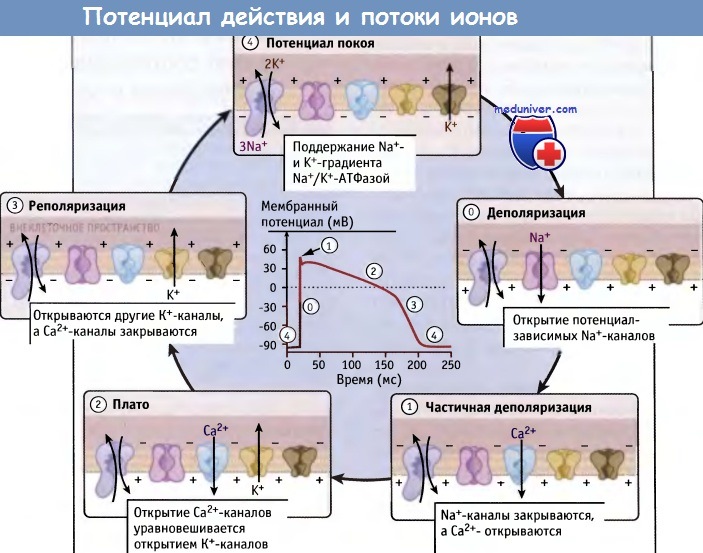
Потенциал действия клеток миокарда подразделяется на пять фаз.
Каждая фаза связана с открытием и/или с закрытием определенных ионных каналов.
Разные типы К+-каналов, которые открываются и закрываются в различные фазы потенциала действия, неспецифичны для данной фазы и показаны одинаковым образом.
Во время генерации и распространения потенциала действия функционирует Na+/K+-ATФазa,
однако скорость ее работы меняется по мере изменения мембранного потенциала.
Потенциал действия возникает за счет скоординированных процессов активации и инактивации ионных каналов нескольких различных типов. Возникновение электрических сигналов в мембране становится возможным при реализации сенсорной функции потенциал-зависимых ионных каналов и их реакции на изменения мембранного потенциала. Как показано для клеток миокарда, открытие и закрытие различных типов ионных каналов происходит последовательным образом в различных фазах потенциала действия.
Быстрые изменения мембранного потенциала обусловлены локальными трансмембранными изменениями концентрации ионов, которые почти не влияют на общую их концентрацию в клетке.
Потенциал действия возникает при быстром скачке заряда (фаза 0), который инициируется открытием потенциал-зависимых Na+-каналов и обеспечивает быстрый поток в клетку ионов натрия в направлении их концентрационного градиента. В результате транспорта ионов натрия происходит деполяризация мембраны, и внутриклеточная среда приобретает более положительный заряд по сравнению с внеклеточным окружением.
Через несколько миллисекунд, по мере того как происходит быстрая инактивация Na+-каналов, деполяризация прекращается, и наступает ранняя реполяризация (фаза 1). Когда в клетках миокарда происходит закрытие потенциал-зависимых Na+-каналов, открываются потенциал-зависимые Са2+-каналы и выводящие К+-каналы. Эти каналы активируются по мере роста положительного мембранного потенциала, который происходит при деполяризации мембраны. Устанавливается новая величина мембранного потенциала. Эта величина определяется тонким балансом между токами деполяризации и реполяризации мембраны в фазе 2.
Для того чтобы Na+-каналы снова приобрели способность к активации, они должны выйти из фазы инактивации, а для этого необходима реполяризация мембранного потенциала. Небольшая часть Na+-каналов не инактивируется и обеспечивает небольшой, но постоянный поток ионов, который наряду с поддерживающим транспортом Са2+ в клетку способствует продолжительности пребывания клеток миокарда в деполяризованном состоянии. По сравнению с потенциалом действия нейронов, потенциал действия клеток миокарда проявляется в течение более длительного промежутка времени. Длительный потенциал действия необходим для того, чтобы обеспечить достаточно времени для высвобождения внутриклеточного кальция, необходимого для мышечного сокращения и предотвращения при этом аберрантной мембранной деполяризации.
В клетках крупных животных и человека фазы 1 и 2 потенциала действия разделены небольшим пиком. В фазе 2 (плато-фазе) при последовательной активации нескольких различных К+-каналов из клетки выходят ионы К+. При этом их убыль быстро уравновешивается положительно заряженными ионами, поступающими в клетку по Na+- и Са2+-каналам. Более того, Na+/Ca2+ обменник вытесняет ионы Са2+ из цитозоля, создавая деполяризующий поток, направленный внутрь клетки. Вместе с тем, Na+/К+-АТФаза продолжает вытеснять из клетки три иона Na+ в обмен на два иона К+, что сдвигает мембранный потенциал в сторону реполяризации (фаза 3).
Попеременное открытие и закрытие различных ионных каналов снижают потенциал действия, и в клетке устанавливается отрицательный мембранный потенциал покоя (фаза 4). Для прекращения эффекта потенциала действия необходима высокая скорость транспорта ионов. Это достигается с помощью К+-каналов, которые к тому же проявляют высокую селективность. Например, для того чтобы быстро снять эффект потенциала действия в нейронах, из клетки за миллисекунду выходят миллионы ионов К+
Суммарная электрическая активность, которая складывается из индивидуальных потенциалов действия всех нейронов мозга, всех клеток определенной группы мышц, или всех клеток миокарда, после амплификации может быть зарегистрирована в виде электроэнцефалограммы (ЭЭГ), электромиограммы (ЭМГ) или электрокардиограммы (ЭКГ) соответственно. Процедура регистрации изменений электрической активности используется для контроля над развитием различных патологических состояний: эпилепсии, миотоний или аритмий. Развитие этих патологических состояний может явиться следствием мутаций, влияющих на функционирование определенных типов ионных каналов.
Мутации, возникающие в генах, кодирующих белки потенциал-зависимых Na+-, К+- или Са2+-каналов, обусловливают нарушения функций головного мозга и сердца. Например, мутации в гене SCN5A, кодирующем белок потенциал-зависимого натриевого канала клеток миокарда, вызывают некоторые болезни сердца. В результате некоторых типов мутаций в этом гене развивается синдром удлиненного QT, при котором неполная инактивация Na+-каналов увеличивает продолжительность потенциала действия. Наряду с этим, мутации в гене одного из белков Cavl,2 канала, который определяет длительность плато-фазы потенциала действия, приводят к развитию синдрома удлиненного QT и аритмий.
Последние вызывают задержку реполяризации сердца и увеличивают у больных риск внезапной смерти. Другие мутации, затрагивающие белки потенциал-зависимых Na+-каналов, приводят к развитию различных болезней сердца, параличам скелетных мышц или к наследственным формам эпилепсии. Примером мутации в белках потенциал-зависимого К+-канала, связанной с болезнью сердца, является мутация в гене HERG. Она увеличивает скорость инактивации канала, что снижает поток ионов К+ из клетки и замедляет фазу реполяризации потенциала действия. Таким образом, эта мутация увеличивает продолжительность потенциала действия, подобно тому как это происходит при мутациях в генах, кодирующих потенциал-зависимые Na+-каналы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое деполяризация мембраны
В экспериментах, проведённых на миелинизированных нервных волокнах амфибий [10], было показано, что добавление ТЭА в наружный раствор, содержащий 30-60 мМ KCl, ведёт к восстановлению сниженного избытком ионов калия мембранного потенциала. Чуть позже [4] способность ТЭА восстанавливать сниженный гиперкалиевым раствором мембранный потенциал была подтверждена. Если сведения об уменьшении калиевой деполяризации под влиянием ТЭА в упомянутых работах [4, 10] были приведены, то относительно того, восстанавливалась ли под влиянием ТЭА генерация угнетённого гиперкалиевым раствором ПД, ничего не сказано. Этот пробел удалось устранить В.И. Беляеву и Б.И. Ходорову [1, 3], которые показали, что, помимо увеличения мембранного потенциала под влиянием ТЭА, в миелинизированных нервных волокнах амфибий происходит восстановление амплитуды ПД, до этого значительно уменьшенного гиперкалиевым раствором.
Различные нервные волокна по-разному реагируют на повышение концентрации ионов калия в среде [8, 9]. Разная чувствительность нервных волокон к калиевой деполяризации связывалась [8, 9] с тем, насколько хорошо были отпрепарированы волокна: в неповреждённых нервных волокнах увеличение концентрации ионов калия до 20 мМ приводило к небольшой и медленно нарастающей деполяризации, тогда как у плохо отпрепарированных волокон деполяризация возникала мгновенно, достигая уровня теоретического калиевого равновесного потенциала. По мнению автора [9], именно устойчивые к калиевой деполяризации волокна находятся в подобном in vivo состоянии.
Материал и методы исследования
Результаты исследования и их обсуждение
В ответ на приложение к нервному волокну одиночного деполяризующего стимула возникал ПД, сопровождающийся хорошо выраженной следовой деполяризацией (СД), амплитуда и длительность которой составили в среднем 2,12 ± 0,64 мВ и 175,27 ± 39,12 мс соответственно. Замена нормального раствора Рингера, содержащего 2,5 мМ К+, на гиперкалиевый (30 мМ К+) раствор вела к двум совершенно различным реакциям. В первом случае нервные волокна реагировали на повышение концентрации ионов калия в растворе падением амплитуды ПД и СД (35 % случаев), тогда как во втором случае амплитуда ПД достоверно не изменялась, а амплитуда СД существенно росла (65 % случаев). Итак, если в первом случае СД как по своей амплитуде, так и длительности уменьшалась (рис. 1, а), то во втором случае СД значительно увеличивалась (рис. 1, б). То, каким образом нервные волокна реагировали на избыток калия, зависело от исходного состояния волокна. В нормальном растворе Рингера амплитуда ПД нервных волокон, реагирующих на гиперкалиевый раствор по первому типу, составила 60,13 ± 16,64 мВ, тогда как у волокон, реагирующих по второму типу, она была равной 85,36 ± 11,87 мВ (различие статистически достоверно, р + и 10 мМ ТЭА, составила 0,45 ± 0,12 мс, в то время как в растворе, содержащем 30 мМ К + и 10 мМ ТЭА, в серии экспериментов с нервными волокнами, чувствительными к гиперкалиевому раствору, она составила 1,17 ± 0,41 мс (различия статистически достоверны, p
БИОЛОГИЧЕСКИЙ ОТДЕЛ ЦЕНТРА ПЕДАГОГИЧЕСКОГО МАСТЕРСТВА
Потенциал покоя и потенциал действия
Автор статьи Зыбина А.М.
Потенциал покоя, как и любой мембранный потенциал формируется за счет избирательной проницаемости клеточной мембраны. Как известно, плазмолемма состоит из липидного бислоя, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом, для формирования потенциала покоя ведущую роль играют ионы калия, кроме них важны ионы натрия и хлора.
Рис. 1. Концентрации и распределение ионов с внутренней и внешней стороны мембраны.
Большинство ионов распределяются неравномерно с внутренней и внешней стороны клетки (рис. 1). Внутри клетки концентрация ионов калия выше, а натрия и хлора – ниже, чем снаружи. В состоянии покоя мембрана проницаема для ионов калия и практически непроницаема для ионов натрия и хлора. Несмотря на то, что калий может свободно выходить из клетки, его концентрации остаются неизменными благодаря отрицательному заряду на внутренней стороне мембраны. Таким образом, на калий действуют две силы, находящиеся в равновесии: осмотические (градиент концентрации К + ) и электрические (заряд мембраны), благодаря чему число входящих в клетку ионов калия равно выходящим. Движение калия осуществляется через калиевые каналы утечки, открытые в состоянии покоя. Величину заряда мембраны, при которой ионы калия находятся в равновесии можно вычислить по уравнению Нернста:
Чтобы учесть проникновение других ионов в клетку существует уравнение Нернста-Гольдмана:
Потенциал действия (ПД) может возникать в возбудимых клетках. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то ПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет кратковременная перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной, после чего восстановится ПП. Это кратковременное изменение ПП, происходящее при возбуждении клетки называется потенциалом действия.
Рис. 2. Потенциал действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
На записи ПД выглядит как кратковременный пик (рис. 44), имеющий несколько фаз.
Во время ПД происходит изменение полярности заряда мембраны. Фаза ПД, при которой заряд мембраны положителен, называется овершутом (рис. 2).
Для генерации ПД оказывается очень важной система активации и инактивации потенциал-управляемых натриевых каналов (рис. 3). Эти каналы имеют две створки: активационную (М-ворота) и инактивационную (Н-ворота). В состоянии покоя М-ворота открыты, а Н-ворота закрыты. Во время деполяризации мембраны М-ворота быстро открываются, а Н-ворота начинают закрываться. Ток натрия в клетку возможен пока М-ворота уже открыты, а Н-ворота еще не закрылись. Вход натрия приводит к дальнейшей деполяризации клетки, приводя к открытию большего количества каналов и запуская цепочку положительной обратной связи. Деполяризация мембраны будет продолжаться до тех пор, пока все потенциал-управляемые натриевые каналы не окажутся инактивированными, что происходит на пике ПД. Минимальная величина стимула, приводящая к возникновению ПД называется пороговой. Таким образом, возникший ПД будет подчиняться закону «все или ничего» и его величина не будет зависеть от величины стимула, вызвавшего ПД.
Благодаря Н-воротам инактивация канала происходит раньше, чем потенциал на мембране достигнет равновесной величины по натрию. После прекращения поступления натрия в клетку, происходит реполяризация за счет выходящих из клетки ионов калия. При этом к каналам утечки в этом случае подключаются еще и потениал-активируемые калиевые каналы. Во время реполяризации, в быстром натриевом канале быстро закрываются М-ворота. Н-ворота открываются гораздо медленнее и остаются закрытыми еще некоторое время после возвращения заряда к потенциалу покоя. Этот период принято называть периодом рефрактерности.
Рис. 3. Работа потенциал-управляемого натриевого канала.
Концентрации ионов внутри клетки восстанавливает натрий-калиевая АТФаза, которая с затратой энергии в виде АТФ откачивает из клетки 3 иона натрия и закачивает 2 иона калия.
По немиелинизированному волокну или по мембране мышцы потенциал действия распространяется непрерывно. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до порогового значения, в результате чего на соседнем участке возникает деполяризация. Главную роль в возникновении потенциала на новом участке мембраны предыдущий участок. При этом на каждом участки сразу после ПД наступает период рефрактерности, за счет которое ПД распространяется однонаправленно. При прочих равных условиях распространение потенциала действия по немиелинизированному аксону происходит тем быстрее, чем больше диаметр волокна. У млекопитающих скорость составляет 1-4 м/с. Поскольку у беспозвоночных животных отсутствует миелин, в гигантских аксонах кальмара скорость ПД может достигать 100 м/c.
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах немиелинизированных волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до порогового значения, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Сальтаторное проведение увеличивает скорость проведения ПД 15-20 раз до 120 м/с.
Работа нейронов
Нервная система состоит из нейронов и глиальных клеток. Однако, главную роль в проведении и передаче нервных импульсов играют нейроны. Они получают информацию от множества клеток по дендритам, анализируют ее и передают или не передают на следующий нейрон.
Передача нервного импульса с одной клетки на другую осуществляется с помощью синапсов. Различают два основных типа синапсов: электрические и химические (рис. 4). Задача любого синапса – передать информацию с пресинаптической мембраны (мембрана аксона) на постсинаптическую (мембрана дендрита, другого аксона, мышцы или другого органа-мишени). Большинство синапсов нервной системы образуется между окончанием аксонов и дендритами, которые в области синапса образуют дендритные шипики.
Преимущество электрического синапса состоит в том, что сигнал с одной клетки на другую переходит без задержки. Кроме того, такие синапсы не утомляются. Для этого пре- и постсинаптические мембраны соединены поперечными мостиками, через которые ионы из одной клетки могут перемещаться в другую. Однако, существенным минусом такой системы является отсутствие однонаправленной передачи ПД. То есть, он может передаваться как с пресинаптической мембраны на постсинаптическую, так и наоборот. Поэтому, такая конструкция встречается достаточно редко и в основном – в нервной системе беспозвоночных.
Рис. 4. Схема строения химического и электрического синапсов.
Химический синапс весьма распространен в природе. О устроен сложнее, так как необходима система преобразования электрического импульса в химический сигнал, затем, вновь в электрический импульс. Все это приводит к возникновению синаптической задержки, которая может составить 0,2-0,4 мс. Кроме того, может произойти истощение запасов химического вещества, что приведет к утомлению синапса. Однако, такой синапс обеспечивает однонаправленность передачи ПД, что является его главным преимуществом.
Рис. 5. Схема работы (а) и электронная микрофотография (б) химического синапса.
В состоянии покоя окончание аксона, или пресинаптическое окончание, содержит мембранные пузырьки (везикулы) с нейромедиатором. Поверхность везикул заряжена отрицательно, чтобы предотвратить связывание с мембраной, и покрыта специальными белками, и принимающими участие в высвобождении везикул. В каждом пузырьке находится одинаковое количество химического вещества, которое называется квантом нейромедиатора. Нейромедиаторы весьма разнообразны по химическому строению, однако, большинство из них производятся прямо в окончании. Поэтому, в нем могут находиться системы, для синтеза химического посредника, а также аппарат Гольджи и митохондрии.
Постсинаптическая мембрана содержит рецепторы к нейромедиатору. Рецепторы могут быть в виде как ионных каналов, открывающихся при контакте со своим лигандом (ионотропные), так и мембранными белками, запускающими внутриклеточный каскад реакций (метаботропные). Один нейромедиатор может иметь несколько как ионотропных, так и метаботропных рецепторов. При этом, часть из них может быть возбуждающими, а часть – тормозными. Таким образом, реакцию клетки на нейромедиатор будет определять тип рецептора на ее мембране, и разные клетки могут совершенно по-разному реагировать на одно и то же химическое вещество.
Между пре- и постсинаптической мембраной располагается синаптическая щель, шириной 10-15 нм.
При приходе ПД на пресинаптическое окончание, на нем открываются потенциал-активируемые кальциевые каналы и ионы кальция входят в клетку. Кальций связывается с белками на поверхности везикул, что приводит к их транспортировке к пресинаптической мембране с последующим слиянием мембран. После такого взаимодействия нейромедиатор оказывается в синаптической щели (рис. 5) и может связаться со своим рецептором.
Ионотропные рецепторы – это лиганд-активируемые ионные каналы. Это значит, что канал открывается только в присутствии определенного химического вещества. Для разных нейромедиаторов это могут быть натриевые, кальциевые или хлорные каналы. Ток натрия и кальция вызывает деполяризацию мембраны, поэтому такие рецепторы называют возбуждающими. Хлорный ток приводит к гиперполяризации, что затрудняет генерацию ПД. Следовательно, такие рецепторы называют тормозными.
Метаботропные рецепторы к нейромедиаторам относят к классу рецепторов, ассоцированных с G-белками (GPCR). Эти белки запускают разнообразные внутриклеточные каскады реакций, приводящих в конечном итоге либо к дальнейшей передачи возбуждения, либо к торможению.
После передачи сигнала необходимо быстро удалить нейромедиатор из синаптической щели. Для этого в щели присутствуют либо ферменты расщепляющие, нейромедиатор, либо на пресинаптическом окончании или соседних глиальных клетках могут располагаться транспортеры, закачивающие медиатор в клетки. В последнем случае он может использоваться повторно.
Каждый нейрон получает импульсы от 100 до 100 000 синапсов. Одиночная деполяризация на одном дендрите не приведет к дальнейшей передаче сигнала. На нейрон могут приходит одновременно множество как возбуждающих, так и тормозных стимулов. Все они суммируются на соме нейрона. Такая суммация называется пространственной. Далее, может возникнуть или не возникнуть (в зависимости от пришедших сигналов) ПД в области аксонного холмика. Аксонный холмик – это область аксона, примыкающая к соме и обладающая минимальным порогом ПД. Далее импульс распространяется по аксону, конец которого может сильно ветвиться и образовывать синапсы со множеством клеток. Помимо пространственной, существует временная суммация. Она происходит в случае, поступления часто повторяющихся импульсов от одного дендрита.
Помимо классических синапсов между аксонами и дендритами или их шипиками, существуют также синапсы, модулирующие передачу в других синапсах (рис. 6). К ним относят аксо-аксональные синапсы. Такие синапсы способны усиливать или тормозить синаптическую передачу. То есть, если на окончание аксона, образующего аксо-шипиковый синапс, пришел ПД, а в это время по аксо-аксональному синапсу на него пришел тормозный сигнал, высвобождения нейромедиатора в аксо-шипиковом синапсе не произойдет. Аксо-дендритные синапсы могут изменять проведение мембраной ПД на пути от шипика к соме клетки. Также существуют аксо-соматические синапсы, которые могут влиять на суммацию сигнала в области сомы нейрона.
Таким образом, существует огромное многообразие различных синапсов, отличающихся по составу нейромедиаторов, рецепторов и их местоположению. Все это обеспечивает разнообразие реакций и пластичность нервной системы.
Рис. 6. Разнообразие синапсов в нервной системе.
