Что такое буферные смеси
Буферный раствор
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 


См. также
Полезное
Смотреть что такое «Буферный раствор» в других словарях:
БУФЕРНЫЙ РАСТВОР — БУФЕРНЫЙ РАСТВОР, раствор, к которому можно добавить умеренное количество сильной кислоты или сильного основания без существенных изменений его рН (кислотности или щелочности). Обычно состоят из смеси либо слабой кислоты с одной из ее солей,… … Научно-технический энциклопедический словарь
Буферный раствор — Раствор с определенной устойчивой концентрацией водородных ионов, представляющий собой смесь слабой кислоты и ее соли или слабого основания и его соли и используемый для воспроизведения и поддержания числовых значений рН в растворах различного… … Словарь-справочник терминов нормативно-технической документации
буферный раствор — buffer буфер, буферный раствор. Pаствор, обеспечивающий сохранение показателя рН (или каких либо других его показателей) на постоянном уровне; Б. широко применяются в большинстве генетических и цитогистологических методик, имеющих дело с жидкими… … Молекулярная биология и генетика. Толковый словарь.
Буферный раствор — Buffer Буферный раствор. (1) Вещество, которое при добавлении или присутствии имеет тенденцию минимизировать физические и химические эффекты тех или иных количеств материалов в смеси. Часто свойства, оказывающие буферное действие, включают рН,… … Словарь металлургических терминов
буферный раствор — buferinis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, palaikantis tam tikrą pH, redokso potencialą, metalo jono koncentraciją ar kitą terpės charakteristiką. atitikmenys: angl. buffer; buffer solution rus. буфер; буферный раствор… … Chemijos terminų aiškinamasis žodynas
БУФЕРНЫЙ РАСТВОР — поддерживает при изменении состава среды постоянство значения к. л. характеристики, напр. рН (кислотно основной Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Значение рН кислотно основного Б. р. зависит от… … Химическая энциклопедия
буферный раствор — буферная смесь, буфер … Cловарь химических синонимов I
буферный раствор для корректировки общей ионной силы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN total ionic strength adjustment buffer solution … Справочник технического переводчика
буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС) — 3.6 буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС): Буферный раствор с высокой ионной силой, добавляемый к анализируемому и контрольным растворам для выравнивания их ионной силы. Примечание Для некоторых электродов состав… … Словарь-справочник терминов нормативно-технической документации
Буфер буферный раствор — Буфер, буферный раствор * буфер, буферны раствор * buffer раствор, содержащий смесь слабой кислоты и щелочи, который препятствует изменению концентрации ионов водорода (рН) в растворе при добавлении кислоты или щелочи, а также поддерживает… … Генетика. Энциклопедический словарь
Буферные растворы
Полезное
Смотреть что такое «Буферные растворы» в других словарях:
Буферные растворы — (англ. buffer, от buff смягчать удар) растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NН3 и NH4CI). Величина рН буферного… … Википедия
БУФЕРНЫЕ РАСТВОРЫ — поддерживают при изменении состава среды постоянное значение какой либо характеристики, напр. водородного показателя pH (кислотно основный буферный раствор) или окислительно восстановительного потенциала (окислительно восстановительный буферный… … Большой Энциклопедический словарь
БУФЕРНЫЕ РАСТВОРЫ — БУФЕРНЫЕ растворы, поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя pH. Такие буферные растворы содержат слабую кислоту и ее соль или слабое основание и его соль. Многие… … Современная энциклопедия
Буферные растворы — БУФЕРНЫЕ РАСТВОРЫ, поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя pH. Такие буферные растворы содержат слабую кислоту и ее соль или слабое основание и его соль. Многие… … Иллюстрированный энциклопедический словарь
буферные растворы — поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя рН (кислотно основный буферный раствор) или окислительно восстановительного потенциала (окислительно восстановительный… … Энциклопедический словарь
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Буферные растворы — см. Буферные системы … Большая советская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — поддерживают при изменении состава среды пост. значение к. л. характеристики, напр. водородного показателя рН (кислотно основный Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Кислотно основные Б. р. содержат слабую к… … Естествознание. Энциклопедический словарь
Буферные растворы Гуда — Good’s buffers (буферные растворы Гуда) двенадцать буферных растворов, разработанных Норманом Гудом с соавторами в 1966 году. Гуд отбирал буферы для биохимических исследований по нескольким критериям. Многие из буферов используются до… … Википедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
Буферные растворы (буферные смеси, буферы)
Дата добавления: 2015-10-19
Размер файла: 31.11 KB
Работу скачали: 143 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
[2.1] Кислотно-основные буферные растворы
[2.2] Классификация буферных систем
[2.3] Расчет рН буферных растворов
[2.4] Свойства буферных растворов
[2.5] Сущность буферного действия
[2.6] Значение рН в буферных растворах
[2.7] Буферная емкость
[2.8] Буферные свойства растворов сильных кислот и оснований.
[2.9] Приготовление буферных растворов
[2.10] Применение буферных растворов в химическом анализе
[4] БИБЛИОГРАФИЧЕСКИЙ СПИСОК
ВВЕДЕНИЕ
БУФЕРНЫЕ СМЕСИ
Если к раствору какой-либо кислоты или щелочи прибавить воду, то, разумеется, концентрация ионов водорода или гидроксила соответственно уменьшается. Но если прибавить некоторое количество воды к смеси уксусной кислоты и ацетата натрия или к смеси гидроокиси аммония и хлорида аммония, то концентрация ионов водорода и гидроксила в этих растворах не изменится.
Свойства некоторых растворов сохранять неизменной концентрацию ионов водорода при разбавлении, а также при добавлении небольших количеств сильных кислот или щелочей известно под названием буферного действия.
Растворы, содержащие одновременно какую-либо слабую кислоту и ее соль или какое-либо слабое основание и его соль и оказывающие буферное действие, называют буферными растворами. Буферные растворы можно рассматривать как смеси электролитов, имеющих одноименные ионы. Присутствие в растворе слабой кислоты или слабого основания и их солей уменьшает влияние разбавления или действия других кислот и основании на рН раствора.
Буферный растворы, представляющие собой смеси слабых кислот и их солей, как правило имеют кислую реакцию (рН 3 СООР + 0,1М раствора СН 3 СО ONa имеет рН = 4,7.
Буферные растворы, представляющие собой смеси слабых основании и их солей, как правило, имеют щелочную реакцию (рН>7). Например, буферная смесь 0,1М раствора N Н 4 ОН + 0,1М раствора N Н 4 С1 имеет рН = 9,3.
Кислотно-основные буферные растворы
В широком смысле буферными называют системы, поддерживающие определенное значение какого-либо параметра при изменении состава. Буферные растворы могут быть
— окислительно-восстановительными сохраняют постоянным потенциал системы при введении окислителей или восстановителей.
известны металлобуферные растворы, которые поддерживают постоянное значение рН.
Во всех случаях буферный раствор представляет собой сопряженную пару. В частности, кислотно-основные буферные растворы содержат сопряженную кислотно-основную пару. Буферное действие этих растворов обусловлено наличием кислотно-основного равновесия общего типа:
о снование сопряженная
Так как в данном разделе рассматриваются только кислотно-основные буферные растворы, будем называть их буферными, опуская в названии «кислотно-основные».
Буферными растворами называют растворы, поддерживающие постоянное значение рН при разбавлении и добавлении небольших количеств кислоты или основания.
Классификация буферных систем
1. смеси растворов слабых кислот и их солей. Например, ацетатный буферный раствор.
2. смеси растворов слабых оснований и их солей. Например, аммонийный буферный раствор.
3. смеси растворов солей многоосновных кислот различной степени замещения. Например, фосфатный буферный раствор.
4. ионы и молекулы амфолитов. К ним относятся, например, аминокислоты и белковые буферные системы. Находясь в изоэлектрическом состоянии, аминокислоты и белки не являются буферными. Буферное действие проявляется только тогда, когда к ним добавляется некоторое количество кислоты или щелочи. При этом образуется смесь двух форм белка: а) слабая «белок кислота» + соль этой слабой кислоты; б) слабое «белок основание» + соль этого слабого основания. Таким образом, этот тип буферных систем можно отнести к буферным системам первого или второго типа.
Расчет рН буферных растворов
В основе расчета рН буферных систем лежит закон действующих масс для кислотно-основного равновесия. Для буферной системы, состоящей из слабой кислоты и ее соли, например, ацетатной, концентрацию ионов H + легко вычислить, исходя из константы равновесия уксусной кислоты:
Из (1) следует, что концентрация ионов водорода равна
В присутствии CH 3 COONa кислотно-основное равновесие уксусной кислоты сдвинуто влево. Поэтому концентрация недиссоциированной уксусной кислоты практически равна концентрации кислоты, т.е. [СН 3 COOH ] = с кисл.
Главный источник ацетат-ионов сильный электролит CH 3 COONa :
Отсюда получают уравнение Гендерсона-Хассельбаха для буферных систем, состоящих из слабой кислоты и ее соли:
Для буферной системы, состоящей из слабого основания и его соли, например, аммиачной, концентрацию ионов водорода в растворе можно рассчитать исходя из константы диссоциации слабого основания.
Из (6) следует, что концентрация ионов водорода равна
В присутствии NH 4 Cl кислотно-основное равновесие сдвинуто влево. Поэтому концентрация недиссоциированного аммиака практически равна концентрации аммиака, т.е. [ NH 4 OH ] = с осн.
Главный источник катионов аммония сильный электролит NH 4 Cl :
Отсюда получают уравнение Гендерсона-Хассельбаха для буферных систем, состоящих из слабого основания и его соли:
Аналогичным образом можно рассчитать рН буферной системы, состоящей из смеси растворов солей многоосновных кислот различной степени замещения, например, фосфатной, состоящей из смеси растворов гидрофосфата ( Na 2 HPO 4 ) и дигидрофосфата ( NaH 2 PO 4 ) натрия. В основе ее действия лежит кислотно-основное равновесие:
слабая кислота сопряженное основание
Выразив из (10) концентрацию ионов водорода и сделав следующие допущения:
Прологарифмировав это выражение и поменяв знаки на противоположные, получим уравнение Гендерсона-Хассельбаха для рассчета рН фосфатной буферной системы
Свойства буферных растворов
Значение рН буферных растворов остается неизменным при разбавлении, что следует из уравнения Гендерсона-Хассельбаха. При разбавлении буферного раствора водой концентрации обоих компонентов смеси уменьшаются в одинаковое число раз. Следовательно, величина рН при этом не должна изменяться. Однако опыт показывает, что некоторое изменение рН, хотя и незначительное, все же происходит. Это объясняется тем, что уравнение Гендерсона-Хассельбаха является приближенным и не учитывает межионных взаимодействий. При точных расчетах следует учитывать изменение коэффициентов активности сопряженных кислоты и основания.
В соответствии с принципом Ле Шателье равновесие смещается влево.
Кислотно-основное равновесие согласно Ле Шателье смещается вправо.
Сущность буферного действия
Если к указанной буферной смеси прибавить сильную кислоту, то произойдет реакция:
Значение рН в буферных растворах
Меняя соотношения и можно получить буферные
растворы, отличающиеся плавным изменением рН от них минимально возможных значений. В водном растворе слабой кислоты
pH = − lg [ Н + ] = − − lg K HAn − − lg C HAn
Тогда получим, что в водном растворе слабой кислоты:
рН = − lg [Н + ] = − − pK HAn − − pC HAn
По мере прибавления к водному раствору слабой кислоты ее соли рН раствора будет меняться.
Согласно уравнению, в растворе, содержащем смесь слабой кислоты и ее соли [Н + ] = K HAn
Аналогично выводим формулу применительно к слабым основаниям:
[ОН ] = √K KtOH * C KtOH
pOH = − lg [ ОН ] = − − lg K KtOH − − lg C KtOH
рН = pK w − (− pK KtOH − − lg C KtOH )
Согласно уравнению, в растворе, содержащем смесь слабого основания и его соли
рН = − lg [ Н + ] = − lg K w + lg K KtOH − lgC Kt А n + lg C KtOH.
Нет никакой необходимости запоминать выведенные формулу значении рН, так как они очень легко выводятся путем логарифмирования простых формул, выражающих значение [Н + ].
Буферная емкость
Способность буферных растворов поддерживать постоянство значения рН небезгранична и зависит от качественного состава буферного раствора и концентрации его компонентов. При добавлении к буферному раствору значительных количеств сильной кислоты или щелочи наблюдается заметное изменение рН. причем для различных буферных смесей, отличающихся друг от друга по составу, отличающихся друг от друга по составу, буферное действие неодинаково. Следовательно, буферные смеси можно различать по силе оказываемого ими сопротивления по отношению к действию кислот и щелочей, вводимых в буферный раствор в одинаковых количествах и определенной концентрации. Предельное количество кислоты или щелочи определенной концентрации (в моль/л или г-экв/л), которое можно добавить к буферному раствору, чтобы значение рН его изменилось только на одну единицу, называют буферной емкостью.
Если величина [Н + ] одного буферного раствора изменяется при добавленной сильной кислоты меньше, чем величина [Н + ] другого буферного раствора при добавлении того же количества кислоты, то первая смесь обладает большей буферной емкостью. Для одного и того же буферного раствора буферная емкость тем больше, чем выше концентрация его компонентов.
Буферные свойства растворов сильных кислот и оснований.
Приготовление буферных растворов
1. Разбавлением в мерной колбе соответствующих фиксаналов.
2. Смешением рассчитанных по уравнению Гендерсона-Хассельбаха количеств подходящих сопряженных кислотно-основных пар.
3. Частичной нейтрализацией слабой кислоты сильной щелочью или слабого основания сильной кислотой.
Так как буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого, буферные растворы часто готовят смешением растворов равной концентрации обоих компонентов или прибавлением к раствору одного компонента соответствующего количества реагента, приводящего к образованию равной концентрации сопряженной формы. В справочной литературе имеются подробные рецепты приготовления буферных растворов для различных значений рН.
Применение буферных растворов в химическом анализе
Буферные растворы широко применяют в химическом анализе в тех случаях, когда по условиям опыта химическая реакция должна протекать при соблюдении точного значения рН, не меняющегося при разбавлении раствора или при добавлении к нему других реагентов. Например, при проведении реакции окисления-восстановления, при осаждении сульфидов, гидроокисей, карбонатов, хроматов, фосфатов и др.
Приведем некоторые случаи использования их в целях анализа:
— Ацетатный буферный раствор (СНзСООН + СН 3 СОО Na ; рН = 5) применяют при осаждении осадков, неосаждаемых в кислых или щелочных растворах. Вредное влияние кислот подавляет ацетат натрия, который вступает в реакцию с сильной кислотой. Например:
НС1 + СН 3 СОО N а → СН 3 СООН + Na С1
или в ионной форме
Н + + СН 3 СОО → СН 3 СООН.
— Формиатный буферный раствор (НСООН + НСОО N а; рН = 2) применяют при отделении ионов цинка, осаждаемых в виде ZnS в присутствии ионов кобальта, никеля, марганца, железа, алюминия и хрома.
— Фосфатный буферный раствор ( N а 2 НРО 4 + N аН 2 РО; рН = 8) использует при проведении многих реакции окисления-восстановления.
Для успешного применения буферных смесей в целях анализа необходимо помнить о том, что не всякая буферная смесь пригодна для анализа. Буферную смесь выбирают в зависимости от ее назначения. Она должна удовлетворять определенному качественному составу, а ее компоненты должны присутствовать в растворе в определенных количествах, так как действие буферных смесей зависит от соотношения концентрации их компонентов.
Выше перечисленное можно представить в виде таблицы.
Приготовление буферных растворов
Почему точность взвешивания так важна для качества буферного раствора?
Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
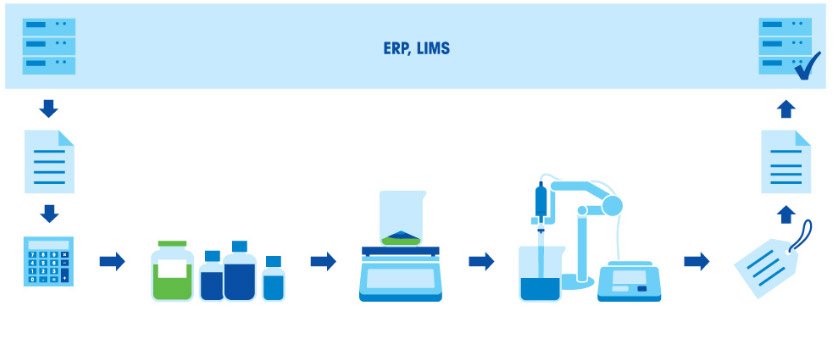
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Buffer Preparation
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
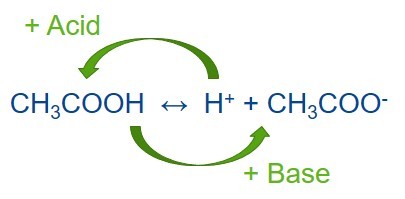
Буферный раствор — это раствор, сохраняющий свой показатель pH при добавлении небольшого количества кислоты или основания. Буферный раствор состоит из слабой кислоты и сопряженного с ней основания. Постоянный уровень pH в буферном растворе поддерживается благодаря поглощению протонов, которые высвобождаются в ходе реакции, или высвобождению протонов, если в ходе реакции они поглощаются. К созданию буферных растворов привело открытие того, что частично нейтрализованные растворы слабых кислот или оснований не меняют pH при добавлении к ним небольшого количества сильной кислоты или основания.
Сопряженная кислота — это основание, которое приобрело протон.
A + H + ↔ H + A
Основание + протон ↔ сопряженная кислота
Что происходит после добавления кислоты в буферный раствор?
Когда к равновесной смеси слабой кислоты и ее сопряженного основания добавляется сильная кислота (с большим количеством H+), точка равновесия смещается влево в соответствии с принципом Ле Шателье.
Что происходит после добавления основания в буферный раствор?
Аналогичным образом, если в смесь добавляется сильное основание, то концентрация ионов водорода снижается меньше, чем ожидалось с учетом количества добавляемого основания. Это происходит потому, что точка равновесия смещается вправо, чтобы компенсировать потерю H + в реакции с основанием.
Разновидности буферных растворов
Буферные растворы, состоящие из слабой кислоты и ее сопряженного основания, считаются кислыми и имеют рН 7. Примером щелочного буфера может служить водный раствор гидроксида аммония (слабое основание) и хлорида аммония (сопряженная кислота), имеющий рН 9,25.
На что следует обращать внимание при приготовлении буферного раствора
Буферы работают наиболее эффективно, если их pH примерно равен pH исследуемой системы или раствора. При изучении энзимов в биологии человека необходима система, соответствующая pH крови (7,35–7,45), в противном случае энзимы будут функционировать неправильно. Если у буферной системы pH выходит за пределы требуемого диапазона, это также отрицательно повлияет на анализ.
Поэтому необходимо знать, как приготовить буферные растворы с заданным pH. Это можно сделать несколькими способами:
где pKa — константа диссоциации слабой кислоты;
[A-] — концентрация сопряженного основания в точке равновесия;
[HA] — концентрация кислоты в точке равновесия.
Если в точке равновесия концентрации сопряженного основания и кислоты одинаковы, то pH равно константе диссоциации. В этой точке буферный раствор обладает максимальной буферной емкостью.
Уравнение Гендерсона — Гассельбаха также используется для определения константы диссоциации слабых кислот посредством прямых измерений pH.
Преимущества универсальных буферных растворов
Универсальные буферные растворы состоят из нескольких комбинаций кислотно-основных пар. Это позволяет использовать универсальные буферные растворы для поддержания уровня pH раствора в более широком диапазоне и, следовательно, в более широком круге задач.
Дополнительные советы по приготовлению и использованию буферных растворов