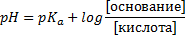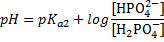Что такое буферные системы в химии
Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Химические буферные системы.



Тема: Патофизиология кислотно-основного состояния
Кислотно-основное состояние (КОС)–соотношение между концентрациями ионов водорода (Н+) и гидроксильных ионов (ОН-) в биологических средах организма.
Нарушение кислотно-основного состояния может осложнять течение многих заболеваний, являясь следствием изменений газового состава крови, метаболических расстройств, которые возникают, например, при недостаточности дыхания, кровообращения, при заболеваниях печени, почек, эндокринных органов и др.
Для оценки характера изменений КОС принято оценивать концентрацию ионов Н+ в артериальной крови, т.е. определять рН крови.
Ацидоз – любой процесс, который снижает рН крови, тогда как алкалоз – любой процесс, который повышает рН крови.
Сдвиг рН на 0,1 по сравнению с физиологической нормой способен привести к тяжелой патологии (например, нарушение дыхательной, сердечно-сосудистой систем). При сдвиге рН крови на 0,2 развивается коматозное состояние, на 0,3 – организм гибнет.
При существенных сдвигах рН в ту или иную сторону нарушаются функции клеток, прежде всего работа их многочисленных ферментных систем, изменяются направленность и интенсивность окислительно-восстановительных процессов. Изменяется водно-электролитный баланс, увеличивается проницаемость клеточных мембран и др.
Таким образом, для эффективного протекания процессов жизнедеятельности концентрация ионов Н+ должна находиться в жестких пределах. В противном случае нарушение этих процессов неминуемо приведёт к смерти.
Для поддержания концентрации ионов Н+ и соответственно рН в организме существуют специальные системы – это химические буферные системы и физиологические механизмы регуляции КОС.
Механизмы регуляции КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
В норме в организме образуется почти в 20 раз больше кислых продуктов, чем щелочных. В связи с этим доминируют системы, обеспечивающие нейтрализацию, экскрецию и секрецию избытка соединений с кислыми свойствами. К этим системам относятся:
• химические буферные системы;
• физиологические механизмы регуляции КОС (органы дыхания, почки, печень, поджелудочная железа, желудок).
Химические буферные системы.
Химические буферные системы представлены, в основном, гидрокарбонатным, фосфатным, белковым и гемоглобиновым буферами. Буферные системы начинают действовать сразу же при увеличении или снижении концентрации ионов Н+ во внеклеточной жидкости и способны устранить умеренные сдвиги КОС в течение 10-40 секунд. Ёмкость и эффективность буферных систем крови весьма высока (табл. 1).
Буфер – это вещество, которое либо связывает, либо выделяет ионы Н+ в зависимости от концентрации Н+ в окружающей среде. Поэтому буфер препятствует большим изменениям концентрации ионов Н+.
Буферная ёмкость – величина, равная соотношению между количеством ионов Н+ (или ОН-), добавленных в раствор, и изменением рН.
Принцип действия химических буферных систем заключается в трансформации сильных кислот и сильных оснований в слабые.
Табл. 1.Относительная ёмкость буферов крови
Гидрокарбонатная буферная система (бикарбонатная) – основной буфер крови и межклеточной жидкости. Гидрокарбонатный буфер – система открытого типа, она ассоциирована с функцией внешнего дыхания и почек (табл. 2).
Гидрокарбонатная буферная система представлена угольной кислотой (Н2СО3) и гидрокарбонатом натрия (калия), имеющим общий ион НСО3-. Этот ион в основном образуется при диссоциации гидрокарбоната и подавляет диссоциацию слабой угольной кислоты, которая легко диссоциирует:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
В норме соотношение «угольная кислота (Н2СО3)/гидрокарбонат (НСО3-)» поддерживается приблизительно на уровне 1:20. Это соотношение поддерживает рН на уровне 7,4.
Механизм действия гидрокарбонатной буферной системы заключается в следующем. При поступлении избытка кислот (ионы Н+) они нейтрализуются щелочным компонентом буфера (НСО3-) с образованием слабой угольной кислоты.
Образовавшийся затем углекислый газ (СО2) возбуждает дыхательный центр, и избыток СО2 удаляется из крови с выдыхаемым воздухом.
Гидрокарбонатный буфер способен нейтрализовать и избыток оснований, которые будут связаны углекислотой (Н2СО3) с образованием и последующим выделением гидрокарбоната натрия (NaНСО3) почками.
В результате рН изменяется незначительно. Эффективность гидрокарбонатной буферной системы более высокая, если рН ниже нормы, т.е. имеется ацидотический сдвиг.
Табл. 2.Начальные сдвиги и компенсаторные реакции при нарушениях КОС
| Нарушение КОС | Начальный сдвиг КОС | Реакция компенсации |
| Газовый ацидоз Газовый алкалоз Негазовый ацидоз Негазовый алкалоз | ↓рН, ↑рСО2 ↑рН, ↓рСО2 ↓рН, ↓НСО3- ↑рН, ↑НСО3- | ↑НСО3- ↓НСО3- ↓рСО2 ↑рСО2 |
Фосфатная буферная система играет существенную роль в регуляции КОС внутри клеток, особенно – канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках по сравнению с внеклеточной жидкостью.
Фосфатный буфер состоит из двух компонентов: роль кислоты выполняет дигидрофосфат натрия (NaH2PO4),роль основания–гидрофосфат натрия (Na2HPO4). Принцип действия фосфатного буфера аналогичен гидрокарбонатному. Этот буфер имеет большое значение в почечной регуляции КОС.
Белковая буферная система – главный внутриклеточный буфер. На его долю приходится примерно три четверти (75%) буферной ёмкости внутриклеточной жидкости.
Белковая буферная система способна проявлять свои свойства за счёт амфотерности белков, которые в одном случае реагируют со щелочами как кислоты (с образованием щелочных альбуминов), а в другом – с кислотами как щелочи (с образованием кислых альбуминов). В схематическом виде эту закономерность можно проиллюстрировать следующим образом:
Гемоглобиновая буферная система – наиболее ёмкий буфер крови. Гемоглобиновый буфер состоит из кислого компонента – оксигенированного гемоглобина (HbО2) и основного – деоксигенированного гемоглобина (Hb).
Карбонаты костной ткани функционируют как депо для буферных систем организма. В костях содержится большое количество солей угольной кислоты: карбонаты Na+, К+, Cа2+, Mg2+ (могут обмениваться на ионы Н+, компенсируя ацидоз). При быстром увеличении содержания кислот (например, при острой сердечной, дыхательной или почечной недостаточности и др. состояниях) костная ткань может обеспечить до 30-40 % буферной ёмкости.
Тема 7. Буферные растворы.



Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Тема несложная, и, что важно, она опирается на простую и красивую теорию. Очень рекомендуем вникнуть в теоретическое описание, приведённое перед разборами вопросов. На этот раз оно получилось кратким, содержательным и, хотелось бы надеяться, понятным. Тема имеет связи с настоящей медициной, еще и поэтому рекомендуется к подробнейшему изучению.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров
Тема 7. Буферные растворы.
Тема, как мы уже заметили, устроена очень красиво. Будет много проще, если Вы поймете эту красоту, тогда не будет нужды (она всё равно будет) в делении на вопросы, каких-то хитростях, и тому подобной хуите. Если теория — это не ваше, можете спокойно дропнуть этот раздел (только таблица обязательно нужна), в вопросах тоже есть всё нужное, чтобы еле-еле пройти порог. Так что мы настоятельно рекомендуем остаться с нами.
Итак, буферные растворы. Скорее всего, вы знаете, что в человеческом желудке сильнокислая среда, и нужно это затем, чтобы расщеплять белки до аминокислот. Но, что если человек выпьет три литра воды? Кислота разбавится, да еще и всё это стечет в кишечник, а там среда щелочная, в итоге все нейтрализуется, человек не сможет усваивать ни белки, ни углеводы, и всё пойдёт по пизде, и подопытный сдохнет? Однако, точно известно, что три литра воды к смерти не приводит, хотя и весёлого мало. Желающие идут проверять, остальные продолжают курить теорию вместе с нами.
Буферный раствор — раствор, поддерживающий рН (кислотность, короче) постоянным при добавлении кислот и щелочей в небольших количествах и разбавлении. Организм человека — почти сплошные Буферные растворы. Оговоримся: у буферного раствора есть ёмкость, при которой он может поддерживать рН относительно постоянным. Бесконечное количество кислоты или щелочи, конечено, ни один буферный раствор не нейтрализует.
К таблице мы ещё вернемся чуть позже. А сейчас фишка БР-ов.
1) Если к нему добавили сильную кислоту, например HCl. Так как в БР есть основание (сопряженное), оно будет её нейтрализовывать.
А если сократить хлорид
Или, сократив одинаковое
В рот мне ноги, это же сопряжённое основание. Охренеть, из сопряженной кислоты получилось сопряженное основание! А щелочь нейтрализовалась. Сами Гендерсон и Гассельбах охренели бы от такого поворота. А рН остается примерно постоянным. Этот мелкий засранец снова выкрутился. Вот же ж!
Подобные реакции могут быть написаны для любого другого БР и называются механизмами буферного действия. Хотя напрямую это не касается тестов, это может быть в колке, если он будет устным, и, кроме того, половина вопросов тестов как бы подразумевает, что механизм работы БР понятен.
Квадратные скобки в записях означают концентрации, однако в принципе на это можно класть хер и подставлять моли, результат всё равно будет верным.
В конце списка лежат аминокислотные буферные системы. Аминокислоты это — глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновая и глутаминовая кислоты, лизин и аргигнин, глутамин и аспарагин, фенилаланин и тирозин, гистидин и триптофан, пролин. Формулы не приводим за ненадобностью. Вам их всё равно скоро учить. Внимательно рассмотрите их, поймите, чем отличаются анионная/диполярная/катионная формы. Там выделено красным. Запомните, что у анионной рКа2, у катионной рКа1, объяснить это сложно, стоит запомнить.
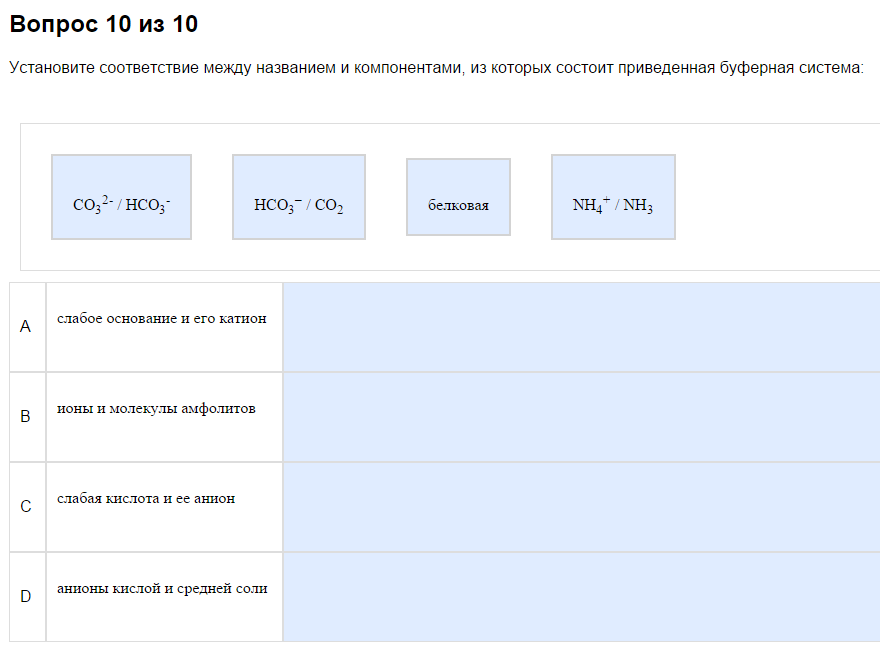
1. Типы буферных систем.
На первый взгляд путано, фактически несложно…
Как с этим бороться:
Всегда в наборе есть
1) Слабая кислота и её анион. Вспомните прошлую тему, найдите, какие кислоты слабые. Здесь то же самое. Чаще всего это что-то-СООН, но не обязательно. В примере это внезапно СО2, потому что обратимо превращается в Н2СО3 в растворе. Ориентир — один минус.
2) Слабое основание и его катион. См. прошлую тему про слабые основания. Чаще всего это амины и аммиак, что-то типа что-то там такое R-NHy. Катион — это один полюс.
2. Аминокислотные буфера.
Как с этим бороться:
Очень легкая задача. Сравниваем рН с рI. Если рН
pI, то в анионной и диполярной. Да, всё так просто. Нет, это не наёбка. Нет, ошибки в том, что диполярная использована два раза, нет, так и должно быть, см. таблицу. Осторожно! Во избежания повреждения мозга о том, что такое рI, задумываться не надо!
Как с этим бороться:
Например, может быть какая-то хрень нетабличная, NaHS+Na2S. Если подумать, то можно догадаться, что первое — кислота, второе — основание. Если сравнить с карбонтаной и гидрокарбонатной системой, можно догадаться, что тут нужна рКа2. Итого:
Самое жопошное — аминокислоты. Выучите или запишите, где рКа1, где рКа2, там это нельзя вывести. В примере ответ В.
4. Интервал буферного действия.
Как с этим бороться:
Тоже очень просто. Интервал буферного действия это область рН от рКа-1 до рКа+1. Например, если рКа=4,75, то интервал равен от 3,75 до 5,75. Подвох в том, что констант может быть дано несколько. Использовать надо ту же самую, по которой считали рН. Ту же самую, которая рКа кислоты в БР. Найти её можно в таблице. Например, если дана карбонатная буферная система (состоит из NaHCO3+Na2CO3), то её рН считается по рКа2 (см. таблицу БР) и следовательно, интервал тоже по ней же. В примере если в БР есть анионная форма, то рН считают по рКа2, следовательно интервал А.
5. Соотношение компонентов, рН и рКа.
Как с этим бороться:
Всего возможно три случая.
1) рН > pKa, тогда сопряженного основания больше, чем кислоты. Может быть, 10:1, а может просто c(CH3COOK) > c(CH3COOH).
С учетом добавления щелочи
Всё подставляем прямо, как есть переводить ничего никуда не нужно, прям хуярим моли:
Дальнейшие расчеты как в прошлой задаче, сначала под логарифмом, потом сам логарифм, потом всё остальное. Не приводим ввиду очевидности. Ответ рН=7,0, с точностью до десятых.
2) Добавили кислоту, например HCl. Всё то же самое, но формула:
Пример не приводим, он аналогичен прошлой задаче.
9. Задача про буферную ёмкость, Вк или Вщ.
Как с этим бороться:
Тоже по формулам, как ни странно. Буферная ёмкость определение можно посмотреть в методичке с САРСами, а формула:
Тут надо немного прокомментировать. Вк — буферная ёмкость по кислоте. Бывает еще и по щелочи, Вщ, считается почти так же. Ск и Vк — концентрация и объем добавленной кислоты (если считаем ёмкость по щелочи, то исправляем на щелочь). VБР — объем буферного раствора, ΔрН — изменение рН при добавлении кислоты или щелочи. Тонкость в том, что при добавлении щелочи рН увеличивется, а кислоты уменьшается. Чтобы не получить отрицательную ёмкость, правильнее писать
ёмкость по кислоте:
ёмкость по щелочи:
Вертикальные черты читаются как «модуль», это математический оператор, который убирает минус, если он есть.
Первая задача из скрина: всё подставить, посчитать, получить ответ. Заметьте, что концентрация в «М», то есть «моль/л», а ёмкость просят в «ммоль/л», то есть милимоль. Коварные, коварные. Перевод делается умножением на 1000. Получается
Прикиньте, какая фигня может привести к потере бала? EOIS же похер, что вы считаете правильно, но не видите перевод.
Вторая задача уже сложнее, там выводить надо. Вывод, не вдаваясь в тонкости, делается простой перестановкой.
10. Норма, ацидоз, алкалоз.
Как с этим бороться:
Норма — рН от 7,36 до 7,43.
Ацидоз — рН меньше 7,36
Алкалоз — рН больше 7,43
Больше нечего сказать.
11. Буферные системы крови.
Наконец-то что-то медицинское…
Как с этим бороться:
Буферные системы крови:
Аж три ответа, B, C, D.
Как с этим бороться:
Смиритесь, несчастные, химическая теория это не ваше. Никак, с этим невозможно ничего сделать. Нет, это не шутка. Поэтому мы просто приводим правильные ответы.
· рН буферного раствора зависит не только от соотношения концентраций сильного и слабого электролита в буферной системе, но и от константы диссоциации кислоты.
· Роль сопряженной кислоты в гидрокарбонатной буферной системе в условиях организма выполняет растворенный СО2
· Гидрокарбонатная буферная система состоит из слабой кислоты и ее аниона
· Анионная форма аминокислоты — частица, в виде которой аминокислота существует в растворах при рН >> pI
· Буферная емкость зависит от суммарной концентрации компонентов буферной системы в растворе
· Диполярный ион — частица, несущая две разноименно заряженных группы атомов
· Ацидоз — нарушение кислотно-основного состояния организма, обусловленное повышенным пониженным значением рН плазмы крови,
· Роль сопряженного основания в карбонатной буферной системе выполняет карбонат-ион
· Ацидоз — патологическое состояние, связанное с пониженной повышенной концентрацией ионов водорода
· Буферная емкость буферных систем организма по кислоте больше, чем по щелочи
· Изоэлектрическая точка α-аминокислоты не зависит от концентрации кислоты в растворе
· Ионы HCO3 – и HPO4 2– НЕ являются диполярными ионами
· Роль сопряженного основания в гидрокарбонатной буферной системе выполняет гидрокарбонат-ион
· Уравнение Гендерсона-Гассельбаха – уравнение, характеризующее зависимость рН буферного раствора только от концентрации от соотношения концентраций слабого электролита и его сопряженной кислоты (основания)
· Буферная емкость — количество кислоты или щелочи, которые нужно добавить к 1 л буферного раствора, чтобы значение его рН изменилось на единицу
· Изоэлектрическая точка – это значение рН раствора, при котором амфолит электронейтрален
· Буферный раствор способен поддерживать практически постоянное значение рН при разбавлении или при добавлении НЕ(!)больших количеств кислоты или щелочи
· Диполярная форма аминокислоты может выступать как в роли кислоты, так и в роли основания
· Изоэлектрическая точка α-аминокислоты НЕ(!)зависит от концентрации кислоты в растворе
· При добавлении к буферной системе щелочи ее буферная емкость по кислоте может увеличиться (в смысле «может»? увеличится)
· Интервал буферного действия определяется как рKа ± 1
· Ацидоз Алкалоз – нарушение кислотно-основного состояния организма, обусловленное повышением рН,
· Катионная форма аминокислоты — частица, в виде которой аминокислота существовует в растворах с рН