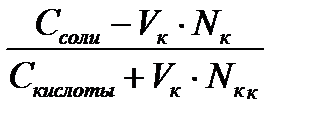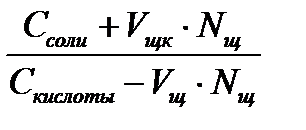Что такое буферные растворы
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Буферные растворы. Классификация буферных растворов. Механизм их действия



Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов.
Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию.
Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме.
Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:
— Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
рН = рК + lg 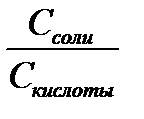
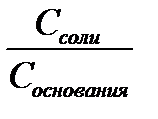
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н + в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН = рК + lg
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾ :
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н + практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН = рК + lg
3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от : константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для количественной характеристики буфера вводится понятие буферной ёмкости.
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Буферный раствор – химический реактив с постоянным pH
Буферный раствор – химический реактив с постоянным pH
Лабораторная посуда, лабораторное оборудование, приборы и химические 
В практике проведения лабораторных работ сотрудники часто сталкиваются с такими химическими растворами, которые имеют или должны обладать определенным показателем величины pH. Именно для этих целей изготавливают специальные буферные растворы.
Что представляет собой данный раствор?
Буферные растворы – химические реактивы с определенным стабильным показателем концентрации водородных ионов; смесь слабо концентрированной кислоты и ее соли. Данные растворы практически не изменяют свою структуру при концентрировании, разбавлении ее другими химическими реагентами или при добавлении в него в малом количестве высококонцентрированных щелочей или кислот. Чтобы получить буферный раствор с различным показателем pH, необходимо изменять концентрацию и соотношение используемых химических растворов.
Данный химический реактив способен сохранять определенный показатель pH до определенного уровня, в зависимости от конкретного количества агрессивных сред, щелочей и кислот. У каждой буферной смеси есть определенная буферная вместимость – эквивалентное соотношение количества элементов щелочи и кислоты.
К сожалению, сами кислоты и щелочи нельзя отнести к буферным смесям, так как при разбавлении их с водой уровень pH данных агрессивных сред изменяется.

Для работы как в лабораторных условиях, так и в частной практике, рекомендуется использование буферных смесей высокой стабильности, приготовленные в специализированных лабораториях с использованием лабораторной посуды из стекла на специальном лабораторном оборудовании и приборах. Самостоятельное приготовление данного химического реактива может быть получено с большой погрешностью.
Из чего состоит буферный раствор?
В состав этого химического реактива входит вода – растворитель и в равной степени 
Такие химические реактивы вместе с современным лабораторным оборудованием и приборами нашли широкое применение в исследованиях аналитической химии, биологии и микробиологии, генетике, медицине, фармацевтике, исследовательских центрах и других научных областях.
Важность буферного раствора для человека
Естественная буферная смесь очень важна и для нормальной жизнедеятельности организма, так как благодаря ей поддерживается постоянный уровень pH биологических жидкостей тканей, органов, лимфы и крови.
Хранить данный химический реактив необходимо в герметически закрытой емкости (стеклянных или пластиковых флаконах).
Где приобрести лабораторное оснащение высокого качества по доступной цене?
Химреактивы, приборы, оборудование, лабораторную посуду купить в Москве выгодно в современном специализированном магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». Именно здесь Вы найдете широкий ассортимент товаров высокого качества от известных торговых марок по приемлемым ценам. Также у нас возможна доставка как по городу, так и по области.
“Prime Chemicals Group” –лабораторное оснащение от перчаток смотровых до весов электронных лабораторных со знаком качества.
БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЕ РАСТВОРЫ (буферные смеси, буферы) — растворы, содержащие буферные системы и обладающие вследствие этого способностью поддерживать pH на постоянном уровне. Б. р. применяются для сохранения активной реакции среды (см.) на определенном неизменном уровне, если тот или иной процесс (напр., выращивание культуры бактерий, проведение ферментативной реакции и т. п.) должен быть проведен при постоянном pH; для определения водородного показателя (см.) — в качестве стандартных растворов с известными и устойчивыми значениями pH и в других случаях лабораторной практики.
Б. р. обычно готовят путем растворения в воде взятых в соответствующих пропорциях слабой кислоты и ее соли, образованной щелочным металлом, частичной нейтрализацией слабой кислоты сильной щелочью или слабого основания сильной кислотой, растворением смеси солей многоосновной кислоты. Величины pH приготовленных таким образом Б. р. незначительно меняются с температурой. Б. р., представляющие собой смеси слабых оснований с их солями, образованными сильными кислотами, ввиду значительной зависимости их pH от температуры, как правило, применяются на практике редко. Общая концентрация компонентов Б. р., употребляемых для практических целей, в большинстве случаев находится в пределах 0,05— 0,2 н. Такого рода Б. р. проявляют буферное действие, если отношение концентраций составляющих их слабых кислот к концентрациям соответствующих солей не меньше 0,1 и не больше 10. Интервал значений pH, в к-ром Б. р. обладает устойчивыми буферными свойствами, лежит в пределах рК±1 (рК — отрицательный десятичный логарифм константы диссоциации слабой кислоты, входящей в состав Б. р., т. е. рК= —lgK). Т. о., для приготовления Б. р., проявляющего буферное действие, напр, в области pH=3—5, следует взять кислоту с рК=4.
СОСТАВ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ БУФЕРНЫХ РАСТВОРОВ, ПРИМЕНЯЕМЫХ В ЛАБОРАТОРНОЙ ПРАКТИКЕ
1. Глициновый буфер Серенсена
Соляная кислота — у
2. Ацетатный буфер Вальполя
Уксусная кислота — х
3. Фосфатный буфер Серенсен
4. Боратный буфер Палича
5. Вероналовый буфер Михаэлиса
Соляная кислота — y
6. Карбонатный буфер Кольтгоффа
Соляная кислота — х
7. Универсальный вероналовый буфер Михаэлиса
Соляная кислота — х
Соляная кислота — х
Количества компонентов, необходимых для приготовления определенного Б. р., рассчитывают по уравнению соответствующей буферной системы или находят с помощью специальной таблицы (см. выше).
При пользовании таблицей следует иметь в виду: В левом вертикальном столбце перечислены наименования Б. р. и их составных частей (x, y).
Во всех горизонтальных рядах, соответствующих тому или иному Б. р., верхняя цифра обозначает искомые значения pH, нижние цифры (или цифра) — объем (в мл) составных частей (части) Б. р. (z, у). Значения х и у соответствуют объемам (в мл) каждого из компонентов Б. р. Напр., для получения Б. р. с pH 1,15 (второй цифровой столбец вверху) следует взять 1,0 мл раствора глицина и 9,0 мл HCl (из расчета приготовления 10,0 мл смеси).
Глициновый буфер Серенсена представляет смесь соответствующих объемов 0,1 М раствора глицина в 0,1 М растворе NaCl и 0,1М раствора HCl. Ацетатный буфер Вальполя — это смесь 0,2 М раствора уксусной к-ты и 0,2М раствора ее натриевой соли. Фосфатный буфер Серенсена готовят смешиванием М/15 растворов NaH2PO4 и Na2HPO4. Боратный буфер Палича — смесь соответствующих объемов 0,2 М раствора борной к-ты и 0,05 М раствора буры. Для приготовления вероналового буфера Михаэлиса используют 0,1 М раствор Na-веронала и 0,1 М раствор HCl.
Для приготовления карбонатного буфера Кольтгофа на каждые 50 мл 0,1 М раствора углекислого натрия берут х мл 0,1 М раствора HCl и доводят объем полученной смеси до 100 мл.
Для приготовления универсального вероналового буфера Михаэлиса растворяют в воде 9,714 г ацетата натрия (CH3COONa-3H2O) и 14,714 г диэтил барбитурата натрия. Объем раствора доводят дистиллированной водой до 500 мл. На каждые 5 мл раствора добавляют 2 мл 8,5% раствора хлорида натрия, х мл 0,1 М соляной к-ты и (18—х) мл дистиллированной воды.
Для приготовления трис-буфера используют раствор а — 24,3 г трис-(гидроксиметил)-аминометана в 1 л дистиллированной воды и раствор б — 0,1 н. HCl.
При приготовлении любых Б. р. следует употреблять очень чистые исходные вещества. Способность Б. р. сопротивляться изменению pH определяется его буферной емкостью, измеряемой количеством грамм-эквивалентов сильной кислоты или сильной щелочи, к-рое необходимо добавить к 1 л Б. р., чтобы изменить его pH на единицу. При неизменной величине отношения концентраций компонентов Б. р. его буферная емкость возрастает с увеличением концентрации этих компонентов.
Значение Б. р. для мед. практики — см. Буферные системы.
Библиография: Калинин Ф. Л., Лобов В. П. и Жидков В. А. Справочник по биохимии, с. 882, Киев, 1971; Швабе К. Основы техники измерения pH, пер. с нем., М., 1962.