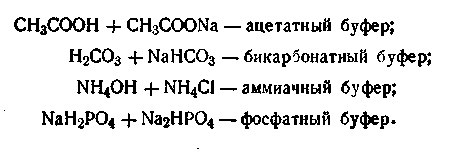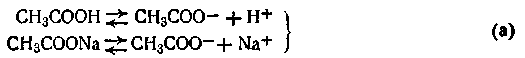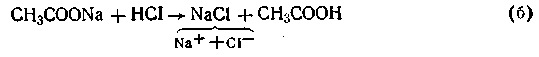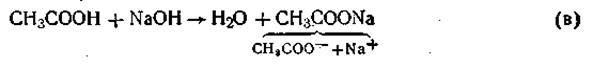Что такое буферное действие
Механизм действия буферных систем (на примере гидрокарбонатного буфера).
Буферная система – протолитическая равновесная система, способная сохранять практически постоянное значение рН при добавлении небольшого количества кислоты или основания.
Согласно протолитической теории кислоты и основания могут быть трех типов: нейтральные, анионные и катионные.Анионные основания и кислоты представляют собой отрицательно заряженные ионы, например: HSO4-, HPO42-, HS- (кислоты); OH-, Cl-, NO3- (основания).
В роли катионных оснований и кислот выступают положительно заряженные ионы, например: NH4+, H3O+ (кислоты); H2N-NH3+, H2N-(CH2)2-NH3+ (основания).
В живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определённым значением рН.
Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии.
Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Буферные растворы
Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного
СН3СООNa → Na+ + CH3COO-
• Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+избыток
NH4Cl → Cl- + NH4+кислоты
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
рН = рК + ℓg 

С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН = рК + ℓg
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН = рК + ℓg
3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для количественной характеристики буфера вводится понятие буферной ёмкости.
Количественные характеристики буферных систем: зона буферного действия и буферная емкость. Факторы влияющие на буферную емкость. Распределение буферных систем в цельной крови и сыворотке по буферной емкости.
Буферные растворы и буферное действие.
Как показывает опыт, разбавленные растворы сильных кислот и оснований, обладающие слабокислой или слабощелочной реакцией, характеризуются непостоянством рН. Однако смесь, например, уксусной кислоты и ее соли CH3COONa обладает способностью сохранять постоянство рН. Можно к этой смеси добавить небольшое количество кислоты или щелочи, а также разбавить ее, но рН раствора при этом почти не изменится. Свойство растворов сохранять определенное значение рН называется буферным действием. Растворы, обладающие буферным действием, получили название буферных растворов или буферных смесей.
Буферные растворы по своему составу бывают в основном двух типов. Они могут состоять из слабой кислоты и ее гидролитически щелочной соли и слабого основания и гидролитически кислой соли этого основания.
В качестве иллюстрации можно привести следующие буферные смеси:
Последний буфер, как видим, состоит из смеси двух солей, одна из которых — однозамещенная, вторая — двухзамещенная соль фосфорной кислоты. Причем первая соль (NaH2PO4) играет роль слабой кислоты. Буферным действием могут обладать растворы, состоящие из анионов разных слабых кислот, такие, как фосфатцитратный буфер Na2НРО4 + СбН8О7.
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. В этом растворе происходят следующие реакции электролитической диссоциации:
Как видим, сильная кислота в результате этой реакции заменяется эквивалентным количеством слабой кислоты. В соответствии с законом разбавления Оствальда увеличение концентрации уксусной кислоты понижает степень ее диссоциации, в результате чего концентрация ионов водорода в буферном растворе увеличивается очень незначительно.
Так же незначительно изменяется рН буферного раствора при добавлении к нему небольшого количества щелочи. При этом щелочь реагирует с уксусной кислотой (реакция нейтрализации), в результате чего гидроксид-ионы связываются с ионами водорода с образованием молекул воды:
В конечном итоге этой реакции добавляемая
Как показывает опыт, каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранить при добавлении к ней кислоты или щелочи. Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.
В соответствии с законом действующих масс константа диссоциации уксусной кислоты
 | 4.75 |
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Как уже отмечалось, добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию, в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т. е.
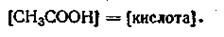 | 4.76 |
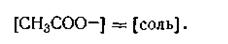 | 4.77 |
Подставляя значения (4.76) и (4.77) в уравнение константы диссоциации (4.75), получим
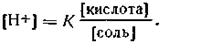 | 4.78 |
Логарифмируя это выражение и меняя знаки, запишем:
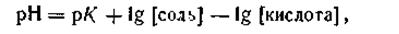 | 4.79 |
где рК— отрицательный логарифм константы диссоциации уксусной кислоты.
Отметим, что уравнение (4.79) справедливо и для буферных растворов, состоящих из смеси слабого основания и гидролитически кислой соли. В этом случае уравнение будет иметь вид
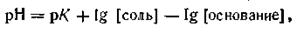 | 4.80 |
где рК — отрицательный логарифм константы диссоциации слабого основания. Из приведенных уравнений следует, что рН буферного раствора зависит от величины константы диссоциации слабой кислоты или слабого основания, а также от соотношения концентраций компонентов буферных смесей.
Для приготовления буферных смесей с желаемым значением рН необходимо взять слабые кислоты или основания с соответствующими значениями констант диссоциации, а также подбирать определенные соотношения компонентов.
На практике обычно пользуются готовыми таблицами, в которых указано, в каких отношениях должны быть взяты компоненты буферных смесей для получения буферных растворов с желаемым значением рН.
Поскольку константа электролитической диссоциации К при данных условиях постоянна, рН буферного раствора будет зависеть только от отношения концентраций кислоты (или основания) и соли, взятых для приготовления буферной смеси, и не зависит от абсолютного значения этих концентраций. Поэтому при разбавлении буферных растворов концентрация водородных ионов (рН) должна оставаться неизменной. Опыт показывает, что даже значительное разбавление буферных растворов в 10—20 раз и более мало отражается на их рН.
Способность буферных растворов противодействовать резкому изменению рН при прибавлении к ним кислоты или щелочи является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или щелочи не превышает определенной величины. Превышение этого количества вызывает резкое изменение рН, т. е. буферное действие раствора прекращается.
Предел, в котором проявляется буферное действие, называется буферной емкостью. Буферную емкость выражают количеством вещества эквивалента сильной кислоты или основания, которое следует добавить к 1 м 3 буферного раствора, чтобы сместить рН на единицу, т. е.
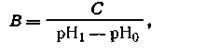 | 4.81 |
где В — буферная емкость, С — количество сильной кислоты или основания, кмоль; рН0— водородный показатель до добавления сильной кислоты или основания; pH1 — водородный показатель после добавления кислоты или щелочи.
Величина буферной емкости зависит от концентрации компонентов буферной смеси и отношения между этими концентрациями.
Зная сущность механизма действия буферных систем, нетрудно догадаться, что наибольшей буферной емкостью обладают растворы, содержащие большие концентрации входящих в состав буфера компонентов, и растворы, составленные из компонентов, взятых в равных количествах. Влияние величины соотношения компонентов буферных смесей на их емкость связано с тем, что при равных величинах числителя и знаменателя величина дроби наиболее устойчива к изменению своего числового значения. Поэтому и величина соотношения компонентов, входящих в состав буфера, будет меньше подвержена изменениям.
Таким образом, буферные растворы обладают следующими свойствами:
1) концентрация водородных ионов буферных смесей мало зависит от разбавления;
2) добавление к буферным смесям небольших количеств (в пределах буферной емкости растворов) кислоты или щелочи мало изменяет рН;
3) величина буферной емкости зависит от концентрации компонентов буферной смеси и от отношения между этими компонентами.
Механизм буферного действия



Буферные системы
Например, в процессе метаболических превращений в клетках организма образуются кислоты (угольная, серная, фосфорная, молочная и др.) и основания (аммиак, азотистые основания). Выделе-ние этих веществ в количествах, превышающих допустимую норму, может привести к ацидозу или алкалозу.
В процессе тканевого дыхания в организме высвобождается большое количество углекислого газа. Транспорт СО2 осуществля-ется кровью, которая представляет собой одну из важнейших внут-ренних сред организма и характеризуется определенным диапазоном колебаний рН – от 7,37 до 7,45 со средней величиной 7,38-7,40. Даже небольшие отклонения рН крови от нормы свидетельствуют о патологических нарушениях метаболизма. Величины рН крови ниже 6,8 и выше 7,8 несовместимы с жизнью.
Присутствие кислотных оксидов (таких как СО2) может вызвать сдвиг значений рН раствора в область более низких значений, что в данном случае может привести к серьезным физиологическим нару-шениям. Действительно, вопреки распространенному мнению, дли-тельное пребывание человека в замкнутом пространстве приводит к удушью и гибели не из-за недостатка кислорода, а из-за избытка СО2.
Однако, присутствие в крови допустимых концентраций кислот, оснований или углекислого газа не вызывает нарушений кислотно-основного гомеостаза. Это означает, что в организме присутствуют системы, способные поддерживать концентрацию ионов водорода на заданном уровне. Таких систем в организме человека три: дыхатель-ная система (легкие), выделительная система (почки) и комплекс буферных систем.
Действительно, от кислотных оксидов (CO2) организм освобож-дается благодаря процессу дыхания, а нелетучие кислоты и основа-ния выводятся через почки с мочевыведением. Однако эти физиоло-гические процессы протекают медленно, быстрая же нейтрализация этих веществ и поддержание постоянства pH в норме осуществляется за счет физико-химических процессов, среди которых главная роль принадлежит протолитическим равновесиям в буферных системах биологических сред организма.
Типы буферных систем
Буферные системы (буферы) – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему некоторого количества сильной кислоты или щелочи. Эта способность буферных систем называется буфер-ным действием.Растворы, содержащие одну или несколько буфер-ных систем называются буферными растворами.Интервал значений рН, в котором система проявляет буферные свойства, называется зоной буферного действия.
Буферные растворы применяются для сохранения активной реакции среды на определенном уровне, если тот или иной процесс (например, выращивание культуры бактерий, проведение фермента-тивной реакции и т.п.) должен быть проведен при постоянном значении рН.
Буферные системы могут быть двух типов. Некоторые примеры буферных систем и их характеристики приведены в таблице 1.
В биологических объектах буферные системы могут быть также образованы из ионов и молекул амфолитов, например, аминокислот-ные и белковые буферные системы.
В водных растворах a-аминокислоты присутствуют в виде равно-весной смеси биполярного иона, катионной и анионной форм:
Таблица 1. Типы буферных систем.

Полностью протонированная a-аминокислота (катионная форма), не содержащая ионогенных групп в радикале, с позиций теории Бренстеда является двухосновной кислотой, диссоциация которой описывается при помощи двух констант: 

Значение pH, соответствующее наибольшей концентрации бипо-лярного иона, называется изоэлектрической точкой (pI). В общем случае величину pI вычисляют по формуле:
 , , | (1) |
Для аминокислот, не содержащих ионогенных групп в радикале, величину pI вычисляют по формуле:
 | (2) |
Пример 1. Рассчитать величину pI аргинина, если для этой a-аминокислоты: 


Полностью протонированная форма аргинина выглядит так:
Видно, что n = 2. Поэтому:
Механизм буферного действия
С точки зрения протолитической теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
Таким образом, концентрация свободных ионов Н + в растворе, а следовательно, и величина рН практически не изменяется.
Рассмотренные случаи показывают, что каждый компонент буферного раствора выполняет строго определенную функцию: за нейтрализацию добавленной кислоты «отвечают» анионы соли, а за нейтрализацию добавленной щелочи – молекулы кислоты.
Таким образом, для буферных растворов I типа справедливы заключения:
Чем больше концентрация соли, тем большее количество кис-лоты можно добавлять к буферу без существенного понижения рН.
Чем больше концентрация кислоты, тем большее количество щелочи можно добавлять к буферу без существенного повышения рН.
Механизм действия буферных систем II типа рассмотрим на примере раствора, содержащего аммиак и хлорид аммония.
В водном растворе гидратная форма аммиака проявляет свойства частично распадающегося на ионы слабого основания, тогда как хлорид аммония является сильным электролитом, полностью диссо-циирующим на ионы:
Эти процессы описываются уравнениями:
NH3∙H2O + Н + 
из которых видно, что в буферной системе II типа каждый компонент также играет определенную роль: за нейтрализацию добавленной кислоты «отвечает» слабое основание, тогда как за нейтрализацию добавленной щелочи отвечает соль, создающая в растворе значитель-ную концентрацию катионов.
Таким образом, для буферных систем II типа можно заключить:
Чем больше концентрация слабого основания, тем большее коли-чество кислоты можно добавить к буферу без существенного снижения рН.
Чем больше концентрация соли, тем большее количество щелочи можно добавить к буферу без существенного повышения рН.
Значительное изменение рН буферного раствора произойдет только в том случае, когда большая часть одного или другого компо-нента раствора (более 90%) будет израсходована на связывание добавленных ионов в молекулы.
На основании приведенных примеров механизм буферного действия в общем случае можно определить следующим образом: