Что такое буферная система в биологии
Буферные системы организма животных и человека (физиологическая роль, первичные и вторичные буферные системы)
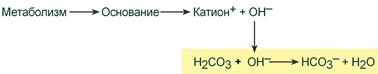
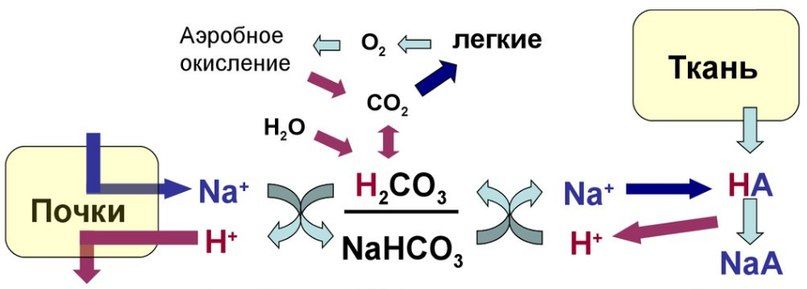
Следует добавить, что мощной буферной системой организма человека является гемоглобиногенная система буфера крови, доля которой составляет около 75% всей буферной емкости крови. Гемоглобиногенная кислотно-основная система состоит из неионизированного гемоглобина ННb (донор протонов, слабая органическая кислота) и калиевая соль гемоглобина КНb (основная соль, акцептор протонов). Важно то, что гемоглобиногенные основные буферные системы организма человека и животных могут взаимодействовать с гидрокарбонатной системой, которая является главным щелочным резервом крови. В капиллярах тканей взаимодействие гемоглобина с кислотой способствует сохранению гидрокарбонатов, то есть щелочных резервов (КНb + Н2СО3 → КНСО3 + ННb). В легких гемоглобин вытесняет из гидрокарбонатов Н2СО3, что сопровождается уменьшением щелочных резервов 2ННb + К2СО3 → Н2СО3 + 2КНb.
Именно так обеспечивается сохранение рН крови в пределах физиологически допустимых величин – от 7,2 до 7,4 условных единиц. Плазменная гидрокарбонатная буферная система живых организмов (H2CO3 / HCO3-) эффективно функционирует при рН приблизительно равному 7,4. При рН крови 7,4 соотношение концентрации H2CO3 и HCO3- приблизительно равно 20:1. При поступлении в кровь кислых продуктов метаболизма ионы Н+ взаимодействуют с гидрокарбонатом, образуется избыток угольной кислоты, которая распадается. Углекислота переходит в газовую форму в легких и выводится из организма. Это приводит возвращения соотношение H2CO3 / HCO3 к норме, а следовательно, и к восстановлению рН 7,4. Когда рН плазмы крови повышается, ионы ОН взаимодействуют с угольной кислотой, которая переходит в гидрокарбонат-ион HCO3-. Это вызывает растворения в плазме или сыворотке крови дополнительного количества углекислоты, которая содержится в газовом пространстве легких. Концентрация H2CO3 в плазме возрастает до нормального соотношения.
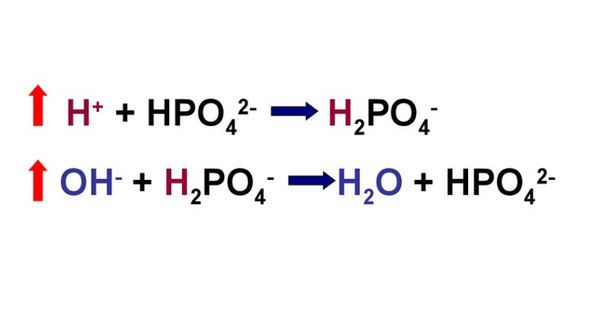
Фосфатная буферная система организма живых существ состоит из сопряженной кислотно-основной пары H2PO4- и HPO2-4. Эта пара имеет рН 6,86, поэтому фосфатная буферная система живых организмов служит буфером в пределах рН 6,1-7,7. Важную роль фосфатные буферные системы организма животных и человека играют в поддержании постоянства рН внутриклеточной жидкости, находящейся в пределах рН от 6,9 до 7,4 условных единиц. Буферные системы живых организмов составляют первую линию защиты организма от изменения рН. Дополнительные потенции обеспечивает деятельность почек и легких, которые выводят из организма СО2, щелочные и кислые продукты метаболизма. Так, при снижении рН дыхание стимулируется, что приводит к выведению из организма избытка СО2, и, наоборот, при повышении рН частота дыхания снижается для уменьшения выведения СО2 легкими.
В клинической практике определяют показатели кислотно-щелочного равновесия:
Литература
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Быстрая компенсация сдвигов рН
Буферные системы
Существует три буферные системы жидкостей организма – бикарбонатная, фосфатная, белковая (включая гемоглобиновую).Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Фосфатная буферная система
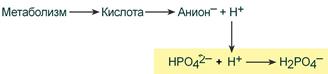
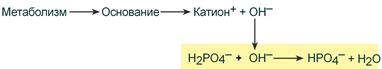
Фосфатная буферная система составляет около 2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована гидрофосфатом (HPO4 2– ) и дигидрофосфатом (H2PO4 – ). Дигидрофосфат слабо диссоциирует и ведет себя как слабая кислота, гидрофосфат обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 – равно 4 : 1.
При взаимодействии кислот (ионов Н + ) с двузамещенным фосфатом (HPO4 2‑ ) образуется дигидрофосфат (H2PO4 – ):
Удаление ионов H + фосфатным буфером
В результате концентрация ионов Н + понижается.
При поступлении в кровь оснований (избыток ОН – ‑групп) они нейтрализуются поступающими в плазму от H2PO4 – ионами Н + :
Удаление щелочных эквивалентов фосфатным буфером
Роль фосфатного буфера особенно высока во внутриклеточном пространстве и в просвете почечных канальцев. Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата (H 2 PO 4 – ), т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Бикарбонатная буферная система
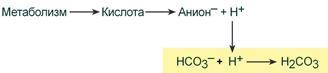
Эта система самая мощная, на ее долю приходится 65% всей буферной мощности крови. Она состоит из бикарбонат-иона (НСО3 – ) и угольной кислоты (Н2СО3). В норме отношение HCO3 – к H2CO3 равно 20 : 1.
При поступлении в кровь ионов H + (т.е. кислоты) ионы бикарбоната натрия взаимодействуют с ней и образуется угольная кислота:
Если в кровь поступают вещества с щелочными свойствами, то они реагируют с угольной кислотой и образуют ионы бикарбоната:
Работа бикарбонатного буфера неразрывно связана с дыхательной системой (с вентиляцией легких). В легочных артериолах при снижении плазменной концентрации СО2 и благодаря присутствию в эритроцитах фермента карбоангидразы угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Белковая буферная система
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
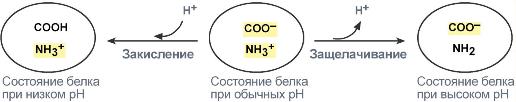
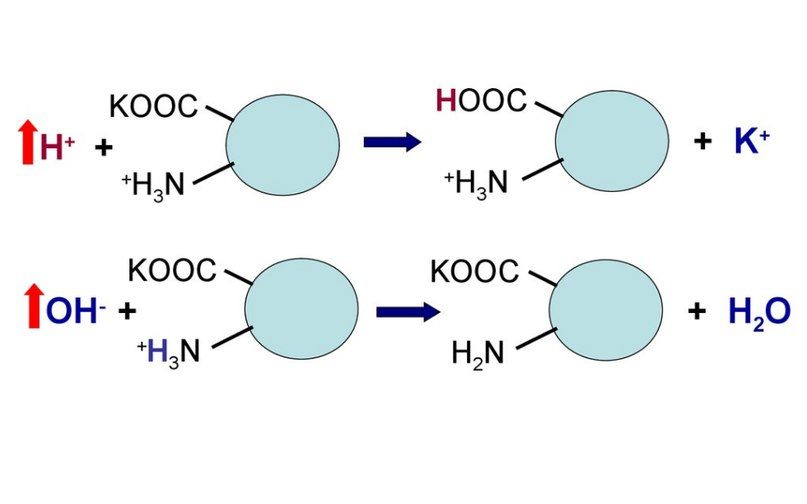
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н + связывают избыток ОН – ‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
Изменение заряда буферных групп белка при различных рН
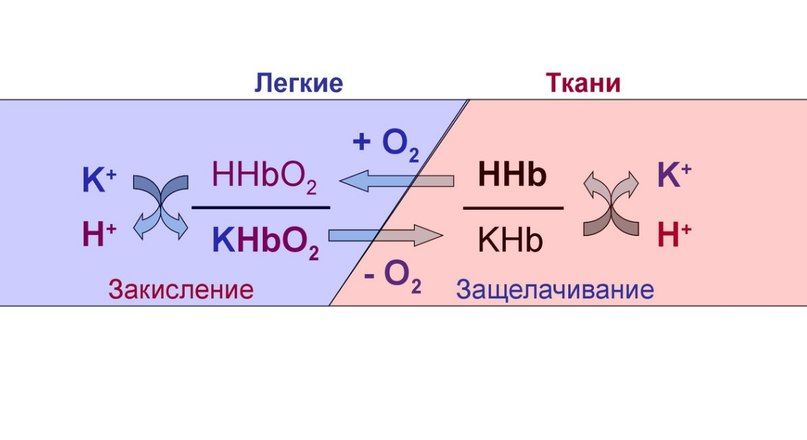
Гемоглобиновая буферная система
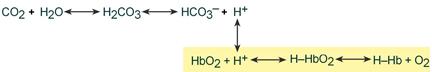
Изменение кислотности гемоглобина происходит в тканях и в легких, и вызывается связыванием соответственно H + или О2. Непосредственный механизм действия буфера заключается в присоединении или отдаче иона H + остатком гистидина в глобиновой части молекулы (эффект Бора).
В тканях более кислый pH в норме является результатом накопления минеральных (угольной, серной, соляной) и органических кислот (молочной). При компенсации pH данным буфером ионы H + присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора) и он превращается в восстановленный H‑Hb.
В результате снижается количество кислот, в первую очередь Н2СО3, продуцируются ионы НСО3 ‑ и тканевое пространство подщелачивается.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н + в среду, предотвращая повышение рН:
Работу гемоглобинового буфера рассматривают неотрывно от бикарбонатного буфера:
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газообмен в легких и тканях).
Что такое буферная система в биологии
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Буферность и кислотность
1. Буферность — свойство клетки поддерживать определенный уровень концентрации ионов водорода (pH).
2. В клетке сохраняется слабощелочная реакция — 7,2.
3. Буферным называют такой раствор, в котором содержится смесь какой-либо слабой кислоты и ее растворимой соли.
4. Механизм поддержания кислотности таков — когда в клетке увеличивается кислотность, анионы, источником которых служит соль, соединяются с ионами водорода и устраняют их из раствора. Если же кислотность снижается, ионы водорода высвобождаются.
Кислотность в клетке
1. В процессе жизнедеятельности в клетке возникают разнообразные соединения, в том числе кислоты и щелочи. Значения pH ниже 7 указывают на кислый раствор, значения выше делают раствор щелочным.
2. Шкала кислотности включает значения от 0 до 14. Эта шкала логарифмическая — изменения pH на одну единицу соответствует изменению концентрации ионов водорода в 10 раз.
3. Важно запомнить, что буферные свойства цитоплазмы зависят от концентрации анионов слабых кислот. При большом количестве анионов они легко могут удалить протоны водорода и понизить кислотность в клетке.
Фосфатная буферная система
2. Главная роль фосфатной буферной системы состоит в том, что она поддерживает кислотно-щелочной баланс в просвете канальцев почки, а также внутриклеточной жидкости.
3. Фосфатов вообще больше внутри клетки, чем вне ее. Эта буферная система имеет мало отношения к внеклеточной жидкости.
Бикарбонатная буферная система
Содержание химических соединений в клетке
1. На первом месте по массе в процентах на сырую массу стоит вода — 75–85 процентов.
2. Далее идут белки — 10–20 процентов, жиры — 1–5 процентов, углеводы — 0,2–2 процента.
3. При потере части воды организмы могут утрачивать признаки жизни — такое состояние называется анабиозом. При улучшении условий они могут снова стать активными. Гибель организмов происходит при потере значительной части воды.
Буферные системы крови
Во избежание недопонимания между читателями и автором в начале поста хотелось бы дать ряд определений, которые мы собираемся использовать в дальнейшем.
Первое — это определения кислот и оснований. Здесь стоит сделать оговорку, что существует несколько теорий кислот и оснований, охватывающих все множество кислотно-основных взаимодействий и рассматривающих кислотные и основные свойства с различных позиций для различных условий, но — для буферных систем крови мы воспользуемся протолитической теорией Бренстеда-Лоури, с разъяснения которой мы и начнем свой рассказ.
Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон (ион водорода, или H + ), а основания — вещества, присоединяющие протон. Сила кислоты зависит от ее способности отдать протон, а сила основания — от способности протон связать. Например, в растворе серной кислоты происходит следующее:
Серная кислота (H2SO4) передает протон основанию (H2O), при этом образуется новая кислота (H3О + ) и новое основание (HSO4 – ).
Подобным же образом может происходить реакция между соляной кислотой и аммиаком:
Соляная кислота (HCl) передает протон основанию (NH3), при этом образуется новая кислота (NH4 + ) и новое основание (Cl – ).
Как было сказано выше, кислоты и основания бывают сильными и слабыми. Например, H2SO4 и HCl представляют собой сильные кислоты, так как они очень легко отдают протон в раствор; таким образом, сильные кислоты диссоциируют быстро и полностью. И наоборот, HSO4 – и Cl – являются слабыми основаниями, так как слабо удерживают протон. В описанных выше реакциях равновесие сдвинуто в сторону образования более слабой кислоты (H3О + и NH4 + ) и более слабого основания (HSO4 – и Cl – ) соответственно. Слабые кислоты (например, H2CO3) диссоциируют не полностью, а значит, концентрация протонов в растворах этих кислот будет ниже. Сильные основания (например, OH – ) активно взаимодействуют с протонами в растворе, связывая их, а слабые основания (HCO3 – ) делают это менее активно.
Второе — единица рН — логарифмическая единица, выражающая концентрацию ионов водорода в растворе в эквивалентах на литр; обратно пропорциональна количеству протонов в растворе, т. е. при высоком содержании протонов рН понижается, при низком, соответственно, повышается.
Рассмотрим пример. Пусть есть 0,1 М (читается как децимолярный) раствор соляной кислоты. Попробуем рассчитать для него значение pH. Мы знаем, что pH = –lg[H + ]. Соляная кислота является сильной и в водном растворе будет диссоциировать полностью. Значит, количество моль/л, или М, [H + ] будет равно [HCl], то есть 0,1 М. Дальше нам нужно просто подставить это значение в формулу:
Таким образом, раствор 0,1 М соляной кислоты имеет pH, равную 1, что соответствует очень кислой среде.
Тут же стоит вспомнить, что нейтральный раствор характеризуется следующей особенностью — значение концентрации ионов водорода [H + ] равно значению концентрации гидроксильных ионов [OH–] = 10 –7 моль/л, или pH = pOH = 7,0.
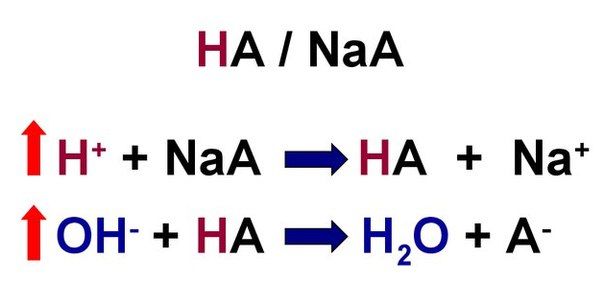
Третье — кислотно-основное равновесие (КОР) — последнее и самое главное. Буферные системы — это системы, состоящие из компонентов (например, слабой кислота и ее соль с сильным основанием или кислотно-основная пара), поддерживающих определенную концентрацию протонов в растворе, то есть определенный pH среды. Кислотность буферных растворов почти не меняется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований. Так, буферная система способна обратимо связывать протон (ион водорода). При связывании ионов водорода в условиях их повышенного количества в растворе получается слабая кислота и соль сильной кислоты, например:
И наоборот, при защелачивании среды происходит диссоциация вещества, выделяется слабое основание и вода:
В обоих случаях буферные системы препятствуют резкому изменению pH. С помощью буферных систем и осуществляется регуляция КОР в организме. Однако, при работе буферной системы один из ее компонентов расходуется и требует восстановления.
Рисунок 1 | Общий вид буферной системы
Значения рН в жидких средах организма в норме:
Диапазон патологических значений рН, при которых человек может жить в течение нескольких часов, варьируется от 6,8 до 8,0.
Выделяют 2 типа расстройств КОР: ацидозы и алкалозы.
Ацидоз — это типовой патологический процесс, характеризующийся относительным или абсолютным понижением pH. Алкалоз — это типовой патологический процесс, характеризующийся относительным или абсолютным увеличением pH. Ацидозы и алкалозы могут быть компенсированными, субкомпенсированными и декомпенсированными.
Компенсированные формы связаны с сохранением жизнедеятельности клетки, в то время как некомпенсированные формы вызывают нарушения функции клетки. Показателем компенсации является величина рН артериальной крови. В норме, как уже было сказано выше, рН = 7,4 ± 0,05. Если величина рН снижается до 7,24 или увеличивается до 7,56 (колебания составляют ± 0,16), то можно говорить о развитии субкомпенсированных форм. В том случае, если эта величина превышает ± 0,16, можно говорить о развитии декомпенсированных форм ацидоза или алкалоза. По происхождению ацидозы и алкалозы бывают газовые (дыхательные) и негазовые (метаболические), которые в свою очередь делятся на подтипы. Наряду с газовыми и негазовыми формами ацидозов и алкалозов встречаются смешанные формы. Кроме того, ацидозы и алкалозы могут быть острыми и хроническими.
Регуляция содержания ионов водорода в жидких средах
Существует три основные системы, регулирующие содержание протонов и препятствующих возникновению ацидоза и алкалоза:
1) Буферные системы организма — моментально регулируют содержание протонов в растворе путем их связывания, но они не способны вывести избыток протонов из организма. Работа буферных систем поддерживает рН крови в пределах 7,35–7,45, а сдвиг рН более чем на 0,4 в любую сторону ведет к гибели. В жидких средах организма существует несколько буферных систем:
— Бикарбонатная буферная система [H2CO3 / HCO3 – ] является основным буфером крови (до 53 % емкости от всех буферных систем);
— Гемоглобиновый буфер [HHb / Hb – ] — до 35 % буферной емкости от всех буферных систем, является внутриклеточным буфером;
— Белковый буфер [HPr / Pr – ] — до 7 % буферной емкости от всех буферных систем;
— Фосфатный буфер [H2PO4 – / HPO4 2– ] — до 5 % буферной емкости от всех буферных систем; действует преимущественно в костной ткани, моче и внутриклеточной жидкости;
— Аммонийный буфер [NH3 / NH4 + ] — действует преимущественно в моче.
2) Дыхательная система — регулирует КОР путем выведения избытка СО2, а следовательно и H2CO3, из внеклеточной жидкости.
3) Выделительная система — почки устраняют изменения КОР путем выведения избытка кислот или оснований с мочой; эта система работает гораздо медленнее, чем предыдущие, однако значительно эффективнее.
В первую очередь рассмотрим наиболее мощную систему из выше перечисленных, берущую на себя основную роль в регуляции КОР — бикарбонатную.
Бикарбонатная буферная система состоит из водного раствора, содержащего слабую угольную кислоту (H2CO3) и слабое основание — бикарбонат-ион (HCO3 – ), который во внеклеточной жидкости чаще всего находится в виде натриевой соли (NaHCO3). Вначале стоит разобрать такое понятие, как диапазон буферного действия — диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK.
Для бикарбонатного буфера pK будет равно 6,1 ± 1 — это далеко от среднего значения pH в организме, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во-первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3 – ) системами.
Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3 / NaHCO3 (CO2 / HCO3 – ). Бикарбонатный буфер является самым чувствительным и связывает до 40 % «лишних» ионов водорода. Он поддерживает pH=7,4. В связи с вышеперечисленными фактами бикарбонатный буфер является индикатором нарушения КОР и определение компонентов этого буфера — основа диагностики нарушения КОР.
Рисунок 2 | Схема работы бикарбонатной буферной системы
При добавлении сильной кислоты в буферный раствор протоны, образовавшиеся при ее диссоциации, нейтрализуются путем взаимодействия с ионом бикарбоната, в результате формируется угольная кислота, которая разлагается на воду и углекислый газ под воздействием фермента карбоангидразы. Избыток углекислого газа, стимулирует барорецепторы в области бифуркации аорты и каротидного синуса, усиливает вентиляцию легких и таким образом выводится из организма. В норме отношение HCO3 – / H2CO3 = 20/1. При этом, как уже упоминалось, работа этой системы неразрывно связана с легкими. Рассмотрим реакцию подробней. При поступлении в кровь кислоты более сильной, чем угольная, происходит реакция обмена и образуется новая соль и угольная кислота. В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
Обратная реакция происходит при добавлении к раствору сильного основания: гидроксид-ион взаимодействует с угольной кислотой с выделением иона бикарбоната, в результате чего концентрация угольной кислоты и, как следствие, углекислого газа в растворе снижается, что тормозит дыхательный центр, снижает вентиляцию легких и задерживает углекислый газ в организме. При этом повышается количество бикарбонат-ионов в плазме крови, что впоследствии компенсируется почками путем выделения их избытка с мочой. Рассмотрим реакцию подробней. При поступлении оснований они реагируют с угольной кислотой в результате чего образуются соль угольной кислоты. (К — катион)
Рисунок 3 | Схема работы фосфатной буферной системы
Фосфатная буферная система играет важную роль в регуляции КОР в просвете почечных канальцев в связи с тем, что концентрация фосфатов в канальцах растет. Кроме того рН мочи ниже рН других жидкостей организма и близок к значению константы диссоциации фосфатного буфера (pH = 6,8 = pK для фосфатного буфера), что позволяет ему работать на максимальных мощностях. По тем же причинам фосфатный буфер имеет большое значение в регуляции КОР во внутриклеточной жидкости.
Рассмотрим устройство фосфатной буферной системы подробней. Емкость фосфатной системы составляет около 1–2 % от всей буферной емкости крови и до 50 % буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение (NaH2PO4) слабо диссоциирует и ведет себя как слабая кислота, второе (Na2HPO4) обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 — равно 4 : 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4 (К — катион)
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и моче. Как уже было отмечено выше в моче его роль состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4.
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т. к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система играет основную роль в регуляции КОР внутри клетки в связи с их богатым содержанием во внутриклеточной жидкости.
Несмотря на разницу между значениями рН внутри клетки и вне ее, колебания внутриклеточного КОР находится в зависимости от внеклеточного. Компоненты бикарбонатной буферной системы медленно диффундируют через клеточную мембрану. Соответственно работа внутриклеточных буферных систем может оказывать посильную помощь в регуляции внеклеточного КОР, однако занимает этот процесс значительно большее время. Около 60–70 % буферной емкости всего организма приходится на белковые внутриклеточные системы, однако в связи с низкой скоростью переноса компонентов буфера через мембраны, коррекция КОР за счёт них может значительно опаздывать.
Сама по себе белковая буферная система состоит как из белков внутриклеточных, так и внеклеточных. Белки и их главные структурные компоненты, аминокислоты, являются амфолитами и потому в зависимости от величины pH среды способны принимать или отдавать ион водорода. Таким образом, кислые группы (например, COOH) могут отдавать ион водорода, при повышении pH, а аминогруппы (например, NH2) могут принимать ион водорода при падении pH. Пределы действия белковых кислотно-основных буферных систем ограничиваются количеством групп, способных отдавать или связывать ионы водорода. Жидкости организма, на основе их локализации, можно разделить на внеклеточные и внутриклеточные жидкости.
Рисунок 4 | Схема работы белковой буферной системы
К внеклеточным жидкостям тканей относятся межклеточные жидкости. Разновидностью межклеточных жидкостей является плазма крови. Плазма крови содержит белки, которые могут составляют одну буферных систем крови. Межклеточная жидкость в тканях содержит волокна внеклеточного белка и растворенные аминокислоты. Все эти компоненты составляют буферную систему межклеточных жидкостей в тканях. Основным белковым буфером в случае крови является гемоглобиновый буфер.
Гемоглобин осуществляет буферирование за счет имидазольных групп гистидиновых остатков и имеет pKa = 6,8. Величина pH крови остаётся постоянной благодаря тому, что гемоглобин способен связывать углекислый газ и ионы водорода, тут гемоглобин играет роль основания. В легких находится окисленная форма гемоглобина HHbO2, которая является более сильной кислотой (при этом кислотность HHbO2 в 70 раз выше, чем у HHb), чем угольная кислота (H2CO3), в результате чего подавляется диссоциация последней. HHbO2 отдает свои ионы Н + в среду, предотвращая повышение рН. В целом если говорить о крови, то ее буферные системы более устойчивы к действию кислот, чем оснований.
Рисунок 5 | Схема работы гемоглобиновой буферной системы
Изогидрическое правило
Поскольку в организме все буферные системы в том или ином соотношении представлены во всех жидкостных средах, они действуют сообща. Смысл изогидрического правила заключается в том, что изменение равновесия в одной буферной системе в растворе ведет за собой изменение и в других системах за счёт перераспределения между ними ионов водорода.
Регуляция кислотно-основного состояния в организме
Дыхательная система — регулирует концентрацию СО2 во внеклеточной жидкости. При повышении вентиляции СО2 активно выводится из организма, что вызывает снижение концентрации углекислоты и приводит к снижению количества протонов в крови. Снижение вентиляции вызывает повышение количества СО2 в крови, и концентрация ионов водорода в крови растет.
В клинической практике удобно использовать показатель парциального давления углекислого газа — рСО2, в норме равный 40 мм рт.ст. При повышении интенсивности метаболических процессов или уменьшении вентиляции легких рСО2 растет, накапливается углекислота и соответственно ионы водорода, приводя к снижению рН — ацидозу. Замедление метаболических процессов или рост вентиляции вызывает снижение СО2 в крови, количества протонов и приводит к алкалозу, что проявляется повышением рН.
Уровень рН в жидких средах организма очень чувствителен к изменению вентиляции. Так, увеличение вентиляции в 2 раза от нормы приводит к повышению рН на 0,23 единиц, при этом снижение альвеолярной вентиляции на ¼ ниже нормы влечет за собой снижение уровня рН на 0,45 единиц. Таким образом, становится понятно значение дыхательной системы в регуляции КОР.
В свою очередь деятельность дыхательной системы зависит от концентрации протонов в крови, то есть изменение рН во внеклеточной жидкости ведёт за собой изменение вентиляции, что является ярким примером принципа отрицательной обратной связи в системе (при работе такой связи, усилия системы направлены на возвращение к исходному состоянию организма). Рост концентрации протонов и сопутствующее ему повышение рН вызывает компенсаторное увеличение вентиляции вследствие стимуляции дыхательного центра. Напротив, уменьшение количества ионов водорода и повышение рН тормозят дыхательный центр. Таким образом, довольно быстро регулируется содержание протонов в системе.
Дыхательная система как физиологический буфер действует медленнее, чем любой из химических буферов, однако ее буферная емкость в 2 раза выше всех вместе взятых буферов внеклеточной жидкости. У нее довольно низкий коэффициент эффективности обратной связи, поэтому коррекция значений рН осуществляется в очень малых пределах, тем не менее, это позволяет выиграть время для стабилизации КОР с помощью выделительной системы.
При нарушениях функций дыхательной системы также происходит изменение уровня ионов водорода и соответственно показателя рН. При нарушении процесса нормальной вентиляции легких (например, при эмфиземе легких), снижается способность выведения СО2, в результате чего развивается дыхательный ацидоз. В такой ситуации коррекция КОР полностью перекладывается на выделительную систему.
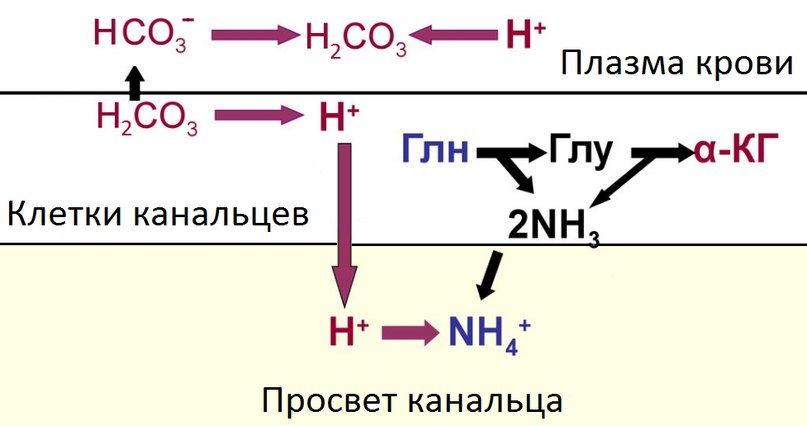
Выделительная система почек — осуществляют регуляцию КОР путем выделения кислых и основных продуктов обмена с мочой. В целом, принцип работы системы заключается в следующем: бикарбонат-ионы попадают в просвет канальцев с первичной мочой путем фильтрации, ионы водорода секретируются эпителиоцитами в просвет канальцев, где они связываются ионами бикарбоната и реабсорбируются обратно в кровь в форме угольной кислоты. Таким образом, осуществляется восполнение компонентов бикарбонатного буфера. Если количество протонов во внутриканальцевой жидкости превышает количество бикарбонат-ионов (при ацидозе), их избыток выводится с мочой, закисляя ее, и наоборот, избыток оснований способствует их выведению (при алкалозе). Эти процессы происходят во всех отделах канальцевой системы, исключая тонкий отдел петли Генле, при этом 80–90 % реабсорбции бикарбонатов и секреции протонов приходится на проксимальный каналец. В различных сегментах эти процессы осуществляются разными механизмами. Кроме того, с мочой выводятся нелетучие кислоты (те, которые не могут выделяться через дыхательную систему), полученные в ходе метаболических процессов, что в свою очередь увеличивает количество протонов в моче. Немаловажным механизмом регуляции КОР почками является образование новых ионов бикарбоната, опять же при участии карбоангидразы.
При выделении в мочу избытка протонов лишь небольшая их часть выводится в свободном виде, остальные связываются с буферными системами в просвете канальцев, способствуя выработке недостающего количества бикарбонатов внутри клеток канальцев с последующей их реабсорбцией в кровь при ацидозе. Наибольшее значение имеют фосфатная и аммонийная системы, меньшую роль играют цитратная и уратная.
Рисунок 6 | Схема работы аммонийной буферной системы
В заключение, приведенная в данной статье информация далеко не полная и не включает в себя многие нюансы, однако, прочитав данную информацию, можно получить общее представление о регуляции кислотно-основного равновесия в организме.