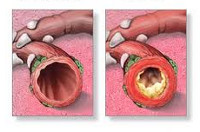
Что такое бронхообструктивный синдром
Обструктивный бронхит
Обструктивный бронхит – диффузное воспаление бронхов мелкого и среднего калибра, протекающее с резким бронхиальным спазмом и прогрессирующим нарушением легочной вентиляции. Обструктивный бронхит проявляется кашлем с мокротой, экспираторной одышкой, свистящим дыханием, дыхательной недостаточностью. Диагностика обструктивного бронхита основана на аускультативных, рентгенологических данных, результатах исследования функции внешнего дыхания. Терапия обструктивного бронхита включает назначение спазмолитиков, бронходилататоров, муколитиков, антибиотиков, ингаляционных кортикостероидных препаратов, дыхательной гимнастики, массажа.
МКБ-10
Общие сведения
Бронхиты (простые острые, рецидивирующие, хронические, обструктивные) составляют большую группу воспалительных заболеваний бронхов, различную по этиологии, механизмам возникновения и клиническому течению. К обструктивным бронхитам в пульмонологии относят случаи острого и хронического воспаления бронхов, протекающие с синдромом бронхиальной обструкции, возникающей на фоне отека слизистой, гиперсекреции слизи и бронхоспазма. Острые обструктивные бронхиты чаще развиваются у детей раннего возраста, хронические обструктивные бронхиты – у взрослых.
Хронический обструктивный бронхит, наряду с другими заболеваниями, протекающими с прогрессирующей обструкцией дыхательных путей (эмфиземой легких, бронхиальной астмой), принято относить к хронической обструктивной болезни легких (ХОБЛ). В Великобритании и США в группу ХОБЛ также включены муковисцидоз, облитерирующий бронхиолит и бронхоэктатическая болезнь.
Причины
Главными факторами, способствующими развитию хронического обструктивного бронхита, служат курение (пассивное и активное), профессиональные риски (контакт с кремнием, кадмием), загрязненность атмосферного воздуха (главным образом, двуокисью серы), дефицит антипротеаз (альфа1-антитрипсина) и др. В группу риска по развитию хронического обструктивного бронхита входят шахтеры, рабочие строительных специальностей, металлургической и сельскохозяйственной промышленности, железнодорожники, сотрудники офисов, связанные с печатью на лазерных принтерах и др. Хроническим обструктивным бронхитом чаще заболевают мужчины.
Патогенез
Суммация генетической предрасположенности и факторов окружающей среды приводит к развитию воспалительного процесса, в который вовлекаются бронхи мелкого и среднего калибра и перибронхиальная ткань. Это вызывает нарушение движения ресничек мерцательного эпителия, а затем и его метаплазию, утрату клеток реснитчатого типа и увеличение количества бокаловидных клеток. Вслед за морфологической трансформацией слизистой происходит изменение состава бронхиального секрета с развитием мукостаза и блокады мелких бронхов, что приводит к нарушению вентиляционно-перфузионного равновесия.
В секрете бронхов уменьшается содержание неспецифических факторов местного иммунитета, обеспечивающих противовирусную и противомикробную защиту: лактоферина, интерферона и лизоцима. Густой и вязкий бронхиальный секрет со сниженными бактерицидными свойствами является хорошей питательной средой для различных патогенов (вирусов, бактерий, грибков). В патогенезе бронхиальной обструкции существенная роль принадлежит активации холинергических факторов вегетативной нервной системы, вызывающих развитие бронхоспастических реакций.
Симптомы острого обструктивного бронхита
Как правило, острый обструктивный бронхит развивается у детей первых 3-х лет жизни. Заболевание имеет острое начало и протекает с симптомами инфекционного токсикоза и бронхиальной обструкции.
Инфекционно-токсические проявления характеризуются субфебрильной температурой тела, головной болью, диспепсическими расстройствами, слабостью. Ведущими в клинике обструктивного бронхита являются респираторные нарушения. Детей беспокоит сухой или влажный навязчивый кашель, не приносящий облегчения и усиливающийся в ночное время, одышка. Обращает внимание раздувание крыльев носа на вдохе, участие в акте дыхания вспомогательной мускулатуры (мышц шеи, плечевого пояса, брюшного пресса), втяжение уступчивых участков грудной клетки при дыхании (межреберных промежутков, яремной ямки, над- и подключичной области). Для обструктивного бронхита типичен удлиненный свистящий выдох и сухие («музыкальные») хрипы, слышимые на расстоянии.
Продолжительность острого обструктивного бронхита – от 7-10 дней до 2-3 недель. В случае повторения эпизодов острого обструктивного бронхита три и более раз в год, говорят о рецидивирующем обструктивном бронхите; при сохранении симптомов на протяжении двух лет устанавливается диагноз хронического обструктивного бронхита.
Симптомы хронического обструктивного бронхита
Основу клинической картины хронического обструктивного бронхита составляют кашель и одышка. При кашле обычно отделяется незначительное количество слизистой мокроты; в периоды обострения количество мокроты увеличивается, а ее характер становится слизисто-гнойным или гнойным. Кашель носит постоянный характер и сопровождается свистящим дыханием. На фоне артериальной гипертензии могут отмечаться эпизоды кровохарканья.
Экспираторная одышка при хроническом обструктивном бронхите обычно присоединяется позже, однако в некоторых случаях заболевание может дебютировать сразу с одышки. Выраженность одышки варьирует в широких пределах: от ощущений нехватки воздуха при нагрузке до выраженной дыхательной недостаточности. Степень одышки зависит от тяжести обструктивного бронхита, наличия обострения, сопутствующей патологии.
Обострение хронического обструктивного бронхита может провоцироваться респираторной инфекцией, экзогенными повреждающими факторами, физической нагрузкой, спонтанным пневмотораксом, аритмией, применением некоторых медикаментов, декомпенсацией сахарного диабета и др. факторами. При этом нарастают признаки дыхательной недостаточности, появляется субфебрилитет, потливость, утомляемость, миалгии.
Объективный статус при хроническом обструктивном бронхите характеризуется удлиненным выдохом, участием дополнительных мышц в дыхании, дистанционными свистящими хрипами, набуханием вен шеи, изменением формы ногтей («часовые стеклышки»). При нарастании гипоксии появляется цианоз.
Тяжесть течения хронического обструктивного бронхита, согласно методическим рекомендациям российского общества пульмонологов, оценивается по показателю ОФВ1 (объему форсированного выдоха в 1 сек.).
Осложнениями хронического обструктивного бронхита являются эмфизема легких, легочное сердце, амилоидоз, дыхательная недостаточность. Для постановки диагноза хронического обструктивного бронхита должны быть исключены другие причины одышки и кашля, прежде всего туберкулез и рак легкого.
Диагностика
В программу обследования лиц с обструктивным бронхитом входят физикальные, лабораторные, рентгенологические, функциональные, эндоскопичесике исследования. Характер физикальных данных зависит от формы и стадии обструктивного бронхита. По мере прогрессирования заболевания ослабевает голосовое дрожание, появляется коробочный перкуторный звук над легкими, уменьшается подвижность легочных краев; аускультативно выявляется жесткое дыхание, свистящие хрипы при форсированном выдохе, при обострении – влажные хрипы. Тональность или количество хрипов изменяются после откашливания.
Рентгенография легких позволяет исключить локальные и диссеминированные поражения легких, обнаружить сопутствующие заболевания. Обычно через 2-3 года течения обструктивного бронхита выявляется усиление бронхиального рисунка, деформация корней легких, эмфизема легких. Лечебно-диагностическая бронхоскопия при обструктивном бронхите позволяет осмотреть слизистую бронхов, осуществить забор мокроты и бронхоальвеолярный лаваж. С целью исключения бронхоэктазов может потребоваться выполнение бронхографии.
Необходимым критерием диагностики обструктивного бронхита является исследование функции внешнего дыхания. Наибольшее значение имеют данные спирометрии (в т. ч. с ингаляционными пробами), пикфлоуметрии, пневмотахометрии. На основании полученных данных определяются наличие, степень и обратимость бронхиальной обструкции, нарушения легочной вентиляции, стадия хронического обструктивного бронхита.
В комплексе лабораторной диагностики исследуются общие анализы крови и мочи, биохимические показатели крови (общий белок и белковые фракции, фибриноген, сиаловые кислоты, билирубин, аминотрансферазы, глюкоза, креатинин и др.). В иммунологических пробах определяется субпопуляционная функциональная способность Т-лимфоцитов, иммуноглобулины, ЦИК. Определение КОС и газового состава крови позволяет объективно оценить степень дыхательной недостаточности при обструктивном бронхите.
Проводится микроскопическое и бактериологическое исследование мокроты и лаважной жидкости, а с целью исключения туберкулеза легких – анализ мокроты методом ПЦР и на КУБ. Обострение хронического обструктивного бронхита следует дифференцировать от бронхоэктатической болезни, бронхиальной астмы, пневмонии, туберкулеза и рака легких, ТЭЛА.
Лечение обструктивного бронхита
При остром обструктивном бронхите назначается покой, обильное питье, увлажнение воздуха, щелочные и лекарственные ингаляции. Назначается этиотропная противовирусная терапия (интерферон, рибавирин и др.). При выраженной бронхообструкции применяются спазмолитические (папаверин, дротаверин) и муколитические (ацетилцистеин, амброксол) средства, бронхолитические ингаляторы (сальбутамол, орципреналин, фенотерола гидробромид). Для облегчения отхождения мокроты проводится перкуторный массаж грудной клетки, вибрационный массаж, массаж мышц спины, дыхательная гимнастика. Антибактериальная терапия назначается только при присоединении вторичной микробной инфекции.
Целью лечения хронического обструктивного бронхита служит замедление прогрессирования заболевания, уменьшение частоты и длительности обострений, улучшение качества жизни. Основу фармакотерапии хронического обструктивного бронхита составляет базисная и симптоматическая терапия. Обязательным требованием является прекращение курения.
Базисная терапия включает применение бронхорасширяющих препаратов: холинолитиков (ипратропия бромид), b2-агонистов (фенотерол, сальбутамол), ксантинов (теофиллин). При отсутствии эффекта от лечения хронического обструктивного бронхита используются кортикостероидные препараты. Для улучшения бронхиальной проходимости применяются муколитические препараты (амброксол, ацетилцистеин, бромгексин). Препараты могут вводиться внутрь, в виде аэрозольных ингаляций, небулайзерной терапии или парентерально.
При наслоении бактериального компонента в периоды обострения хронического обструктивного бронхита назначаются макролиды, фторхинолоны, тетрациклины, b-лактамы, цефалоспорины курсом 7-14 дней. При гиперкапнии и гипоксемии обязательным компонентом лечения обструктивного бронхита является кислородотерапия.
Прогноз и профилактика
Острый обструктивный бронхит хорошо поддаются лечению. У детей с аллергической предрасположенностью обструктивный бронхит может рецидивировать, приводя к развитию астматического бронхита или бронхиальной астмы. Переход обструктивного бронхита в хроническую форму прогностически менее благоприятен.
Адекватная терапия помогает задержать прогрессирование обструктивного синдрома и дыхательной недостаточности. Неблагоприятными факторами, отягощающими прогноз, служат пожилой возраст больных, сопутствующая патология, частые обострения, продолжение курения, плохой ответ на терапию, формирование легочного сердца.
Меры первичной профилактики обструктивного бронхита заключаются в ведении здорового образа жизни, повышении общей сопротивляемости к инфекциям, улучшении условий труда и окружающей среды. Принципы вторичной профилактики обструктивного бронхита предполагают предотвращение и адекватное лечение обострений, позволяющее замедлить прогрессирование заболевания.
Бронхообструктивный синдром
Что такое бронхообструктивный синдром?
Комплекс симптомов, приводящих к нарушению проходимости воздуха по бронхиальным путям, называется бронхообструктивным синдромом. Бронхообструктивный синдром является следствием воспалительного процесса слизистой оболочки, спазма гладких мышц и гиперсекреции подслизистых желёз бронхиального дерева.
По какой причине развивается бронхообструктивный синдром?
В качестве наиболее вероятных причин развития комплекса симптомов необходимо выделить инфекционные, вирусные, воспалительные заболевания и аллергические реакции организма. Бронхообструктивный синдром могут спровоцировать заболевания сердечно-сосудистой системы, болезни органов дыхания, патологии желудочно-кишечного тракта, психологические расстройства.
В соответствии с характером развития и в зависимости от причин, его спровоцировавших, бронхообструктивный синдром разделяют на следующие виды: аллергический, иммунный, аспирационный, инфекционный, обтурационный, ирритативный, гемодинамический, эндокринный, неврогенный, токсический. В зависимости от продолжительности и характерных проявлений синдром оценивают как острый (внезапный), затяжной и постоянный. Острый бронхообструктивный синдром продолжается не более двух недель, затяжной — более двух недель, а постоянный характеризуется появлением более трёх раз за год. Исходя из степени тяжести выделяют лёгкую, умеренную (среднюю) и тяжелые формы.
Симптомы бронхообструктивного синдрома
Симптоматика зависит от вида бронхообструктивного синдрома. Например, при аллергической форме синдрома возникают приступы внезапного кашля, слышны хрипы при дыхании, одышка, возникает чувство сильного беспокойства. Аспирационная форма сопровождается рвотой, усилением приступов кашля в лежачем положении, приступами удушья.
Проведение диагностики в медцентре
При появлении первых признаков бронхоаденита обратитесь за помощью к пульмонологу. Установить наличие бронхообструктивного синдрома позволяют анализ крови, кожные пробы, серологический анализ. В качестве наиболее информативных инструментальных видов диагностики могут назначать электрокардиограмму, бронхоскопию, бронхографическое исследование, сцинтиграфическое исследование лёгких, ангиопульмонографию, компьютерную и магнитно-резонансную томографии, рентгенографию. Проведение вышеуказанных методов инструментальной диагностики позволяет абсолютно точно определить причины появления бронхообструктивного синдрома.
Лечение бронхообструктивного синдрома
Лечение, прежде всего, направлено на устранения заболевания-провокатора. Медикаментозная терапия включает в себя противовоспалительные и бронхолитические лекарственные препараты. Улучшить проходимость в бронхиальных путях воздуха позволяют дренаж, массаж, дыхательная гимнастика. В процессе лечения активно используются методы физиотерапии, иммуностимуляторы и поливитаминные комплексы. Отсутствие адекватного лечения может спровоцировать развитие таких тяжелых патологий, как сердечная недостаточность, пневмония, бронхиальная астма. В отдельных случаях отсутствие лечения бронхообструктивного синдрома способно привести к летальному исходу.
Профилактика заболевания
В качестве основных профилактических мер рекомендуют ведение здорового образа жизни, занятия спортом, правильное и регулярное питание, приём поливитаминных комплексов, прогулки на свежем воздухе.
Обструктивный бронхит — симптомы, лечение у детей и взрослых
Обструктивный бронхит — это воспаление бронхов, сопровождающееся сужением их просвета, бронхоспазмом и нарушением нормальной проходимости воздуха. Стенка бронхов состоит из хрящевой ткани. Она становится тоньше по мере удаления от трахеи. При этом объем гладкомышечных клеток в результате уменьшения их калибра увеличивается. Заболевание широко встречается, как среди взрослых, так и среди детей. Рассмотрим подробнее, в чем его особенности.
Причины появления болезни
С обструктивным бронхитом сталкиваются люди всех возрастных категорий. Чаще всего он развивается, как ответ на респираторные вирусы. В редких случаях его провоцируют иные респираторные инфекции, среди которых:
У детей появление заболевания часто провоцируют грибковые инфекции, если они долгое время находятся в помещении с повышенной влажностью. У малышей дошкольного возраста его могут вызывать болезнетворные микроорганизмы (патогенные бактерии). Зачастую рецидивы обструктивного бронхита возникают из-за хронических инфекций (тонзиллита, синусита).
Среди факторов, способствующих появлению болезни у детей, отмечают:
Как у детей, так и у взрослых, к развитию обструктивного бронхита способны приводить негативные факторы со стороны внешней среды (в частности, воздействие аммиака, различных кислот, цементной пыли), частые переохлаждения, повышенная чувствительность к пищевым продуктам, пыли и шерсти животных, неблагоприятные климатические условия проживания.
Симптоматика напрямую зависит от формы болезни и прогрессирования патологических изменений в структуре бронхов. Среди распространенных признаков отмечают:
Если при кашле требуется занимать вынужденное положение тела — это явный признак дыхательной недостаточности (характерно для поздней стадии болезни). Среди других симптомов болезни — возникновение свистящего дыхания, слышимые сухие хрипы (даже на расстоянии).
В соответствии с причинами развития, длительностью терапии и выраженностью симптоматики, специалисты различают четыре формы заболевания, каждая из которых имеет свои особенности. Обструктивный бронхит бывает:
При появлении первых характерных признаков болезни не стоит затягивать с визитом к врачу. На первичном приеме он выслушает жалобы, проведет осмотр. В случае с бронхитом при простукивании грудной клетки будет определяться коробочный звук, расширение легких. При аускультации легких будет определяться удлинение выдоха. Характерный аускультативный признак болезни — свистящие сухие хрипы.
Дополнительно прибегают к лабораторной диагностике. Назначают общий и бактериологический анализ мокроты, общий анализ крови. Результаты анализов помогут поставить точный анализ и назначить целесообразное лечение.
Не обойтись без спирометрии — распространенного способа диагностики в пульмонологии, необходимый для оценки функционального состояния легких. С его помощью удается измерить объем легких.
Часто прибегают к пневмотахометрии — методике измерения максимальной скорости потока воздуха, достигаемой при форсированном вдохе и выдохе. Ее осуществляют с помощью прибора — спирометра. Пациент делает несколько спокойных дыхательных циклов, затем форсированный вдох и тут же, не задерживая дыхание, форсированный выдох. Такие манипуляции повторяют несколько раз, после чего специалист оценивает полученные результаты и на их основании формулирует заключение.
Также, не обойтись без инструментальных методик. Электрокардиография помогает обнаружить увеличение правых отделов сердца. Рентгенологическое исследование необходимо для определения признаков эмфиземы легких, чтобы исключить распространенное осложнение — пневмонию.
Как проводят лечение
Схема лечение у детей и взрослых схожа. Для борьбы с обструктивным бронхитом прибегают к консервативным методикам. В обязательном порядке требуется применение ингаляторов. При этом паровая ингаляция не походит, поскольку воздействием влажного тепла на слизистую оболочку приводит к увеличению отечности. Разрешено применять ультразвуковые или компрессионные ингаляторы. Ингаляции проводят с препаратами, которые расширяют бронхи и разжижают мокроту.
Если заболевание спровоцировано бактериальным агентом, то пациенту назначают прием антибиотиков. При повышении температуры до 38-39°C, требуются жаропонижающие средства. Также, назначают препараты, стимулирующие отхаркивание и разжижающие мокроту.
Во время лечения важно соблюдать питьевой режим (пить достаточное количество теплой воды), поскольку в противном случае не удастся поспособствовать нормальному выведению мокроты через бронхи. Детям особенно важно придерживаться молочно-растительной диеты, обогащенной витаминами и микроэлементами.
Помимо лекарственной терапии, хорошо себя зарекомендовала дыхательная гимнастика и вибрационный массаж. Количество сеансов устанавливает специалист в индивидуальном порядке. Если было установлено, что причина развития болезни — аллергия, то необходимо ограничить контакт с аллергеном.
Острые респираторные вирусные заболевания и бронхообструктивный синдром
Резюме. В статье изложена информация об острых респираторных вирусных заболеваниях, протекающих с бронхообструктивным синдромом. Представлены данные о механизме действия комбинированного препарата Бронхолитин, применяющегося в комплексной терапии заболеваний дыхательной системы с сухим непродуктивным кашлем.
Введение
Острые респираторные вирусные заболевания (ОРВЗ) занимают ведущее место в структуре инфекционной патологии человека. Воздушный путь передачи возбудителя, высокая восприимчивость населения практически ко всем вирусам-возбудителям острых респираторных заболеваний обусловливает их основную эпидемиологическую особенность — быстроту и широту их распространения. Они практически неограничены и существенно возрастают в периоды сезонного иммунодефицита, возникающего в зимний и зимне-весенний периоды. Данные возбудители ответственны за существенный уровень заболеваемости и смертности во всем мире. И, как подчеркивается экспертами ВОЗ, в последние годы сохраняется тенденция к неуклонному росту заболеваемости этой группой инфекций (Gaynor A.M. et al., 2007; МОЗ України, 2009; Печінка А.М., Дземан М.І., 2010).
Бронхообструктивный синдром: дефиниция, патогенез
Нередко ОРВЗ протекают с бронхообструктивным синдромом (БОС) — патологическим состоянием, связанным с нарушением бронхиальной проходимости и последующим повышением сопротивления потока воздуха при вентиляции (Юдина Л.В., 2007; Зайков С.В., 2009).
Клинические проявления БОС складываются из удлинения выдоха, появления экспираторного шума (свистящее, шумное дыхание), приступов удушья, участия вспомогательных мышц в акте дыхания; часто развивается малопродуктивный кашель. В англоязычной литературе этот клинический симптомокомплекс получил название «wheezing» — «синдром свистящего дыхания», поскольку свистящие звуки (дистантные или выслушиваемые при аускультации) являются основным клиническим проявлением БОС (Зайцева О.В., 2010). Генез свистящего дыхания связывают как с турбулентным движением воздуха против препятствия в дыхательных путях (трахеи, бронхах), так и с быстрыми осцилляциями просвета долевых и сегментарных бронхов. При этом происходят повышение внутригрудного давления, колебания скорости потока воздуха при выдохе, сдавление бронхов и их вибрация, а конечным результатом является возникновение свистящих хрипов (Сорока Ю.А., 2006).
Респираторная вирусная инфекция начинается с проникновения вируса в клетки эпителия дыхательных путей, затем вирусы реплицируются и инфицированные клетки начинают секретировать цитокины, хемокины и медиаторы, такие как фактор некроза опухоли, интерлейкин (ИЛ)-1, ИЛ-6, ИЛ-8, RANTES (regulated on activation, normal T-cell expressed and secreted), фактор, стимулирующий образование колоний гранулоцитов (granulocyte macrophage colony-stimulating factor/GM-CSF), макрофагальный воспалительный протеин-1α (macrophage inflammatory protein-1α/MIP-1α), интерферон (ИФН)-индуцируемый протеин 10 kDa (IP-10), эотаксин. Как результат в дыхательные пути привлекаются клетки воспаления — нейтрофильные, эозинофильные гранулоциты, лимфоциты (Singh A.M. et al., 2007; Dougherty R.H., Fahy J.V., 2009; Newcomb D.C., Peebles R.S., 2009), играющие важную роль в управлении инфекционным процесом, однако неадекватная экспрессия воспалительных медиаторов может быть связана с гиперреактивностью. ОРВЗ часто сопровождаются нейтрофилией в отделяемом из верхних и нижних дыхательных путей и, вероятно, что продукты активации нейтрофильных гранулоцитов вовлечены в обструкцию дыхательных путей и симптомы со стороны нижних дыхательных путей (Mohapatra S.S., Boyapalle S., 2008). Следствием вирусной инфекции является отек и утолщение слизистой оболочки бронхов, дистрофия и слущивание бронхиального эпителия; в мельчайших бронхах и бронхиолах, напротив, отмечается гиперплазия эпителия. Инфекционный воспалительный процесс в бронхах, особенно при аденовирусной инфекции, сопровождается выраженным экссудативным компонентом со слизистыми наложениями на эпителий, его разрыхлением и отторжением. Бронхиальный секрет при этом бывает густым и вязким, что приводит к угнетению мукоцилиарной активности, застою бронхиального содержимого (Сорока Ю.А., 2006).
Усугубляет клиническую картину обструктивного синдрома спазм гладких мышц бронхов, который может быть связан с нарушением равновесия вегетативной нервной системы, дисбалансом между возбуждающими и тормозящими путями адренергической (снижение β- и возрастание α-адренергической активности) и холинергической иннервации (Овсянникова Е.М., 2005). Активация холинергических нервных окончаний ведет к увеличению продукции ацетилхолина и повышению концентрации гуанилатциклазы, которая, в свою очередь, способствует поступлению ионов кальция внутрь клеток гладких мышц, тем самым стимулируя бронхоконстрикцию. Дети раннего возраста в силу слабого развития гладкой мускулатуры бронхов клинически типичного бронхоспазма не дают. Особенностью течения заболеваний с БОС у детей первых лет жизни является склонность к развитию обструкции и продукция очень вязкого бронхиального секрета. У детей старшего возраста одной из основных причин БОС является бронхоспазм (Сорока Ю.А., 2006).
Показано также, что под действием вирусов может снижаться активность нейтральной пептидазы, это приводит к усилению бронхоконстриктивного действия нейропептидов (субстанция Р, тахикинин, кальциеподобный пептид и др.), образующихся в эндокринноактивных клетках дыхательных путей (Овсянникова Е.М., 2005). Некоторые медиаторы (например эндотелин-1) оказывают прямое воздействие, вызывая бронхо- и вазоконстрикцию, что приводит к обструкции воздухоносных путей и нарушению газообмена (Mallia P., Johnston S.L., 2006).
При сохраненном балансе про- и противовоспалительных агентов по мере уничтожения возбудителей происходит обратное развитие воспаления с восстановлением структуры и функции бронхов и легких, однако нередко этот баланс нарушается и повреждающее действие медиаторов может оказаться преобладающим (Середа Е.В. и соавт., 2010).
БОС при ОРВЗ особенно ярко проявляется у детей. Бронхиальная обструкция на фоне респираторных заболеваний у детей, как правило, протекает в виде острого обструктивного бронхита. БОС преимущественно развивается остро, но может носить персистирующий характер (Юдина Л.В., 2007). По результатам исследований, проведенных на кафедре педиатрии № 1 Национальной медицинской академии последипломного образования им. П.Л. Шупика, у 29,2% детской популяции отмечаются рецидивы свистящего затрудненного дыхания с удлиненным выдохом (wheezing) (Охотнікова О.М., 2010).
Частота БОС, развившегося на фоне инфекционных заболеваний нижних дыхательных путей, по данным разных авторов составляет 5–40%. У детей с отягощенным семейным анамнезом по аллергии БОС, как правило, развивается чаще — в 30– 50% случаев; такая же тенденция имеется у детей, часто болеющих респираторными инфекциями (более 6 раз в год) (Зайцева О.В., 2010). P.W. Heymann и соавторы (2004) показали, что вирусные инфекции были основным фактором риска БОС среди детей в возрасте младше 3 лет, у детей старше 3 лет отмечалась сильная ассоциация БОС с атопией.
Факторами риска развития бронхиальной обструкции у детей являются (Сорока Ю.А., 2006; Волков И.К., 2010):
В исследовании R.F. Lemanske и соавторов (2005) установлено, что у детей группы высокого генетического риска развития аллергических респираторных заболеваний в возрасте 3 лет чаще развивается БОС при наличии в грудном возрасте следующих факторов риска: пассивное курение (отношение шансов (ОШ) 2,1), старшие сиблинги (ОШ 2,5), аллергическая сенсибилизация к пищевым продуктам в возрасте 1 года (ОШ 2,0), любое респираторное заболевание без БОС умеренной тяжести и тяжелое (ОШ 3,6), по меньшей мере один эпизод БОС, связанный с инфекцией респираторно- синцитиальным (РС)- вирусом (ОШ 3,0), риновирусом (ОШ 10,0) или другими патогенами (ОШ 3,9) в грудном возрасте.
Индуцированная вирусами продукция ИФН модифицирует риск БОС при вирусной инфекции (Guilbert T.W., Denlinger L.C., 2010). Нарушение продукции ИФН-β и клеточного апоптоза ведет к усиленной репликации вируса и в конечном счете к цитотоксической смерти клетки с высвобождением медиаторов воспаления и большему количеству интактных вирусных частиц (Mallia P., Johnston S.L., 2006).
Предшествующая бронхообструкция также повышает риск вирусной инфекции нижних дыхательных путей (Gern J.E., 2009). K.H. Carlsen и соавторы (1987) показали, что у 60% детей грудного возраста, госпитализированных с бронхиолитом, чаще отмечались респираторные инфекции и эпизоды бронхолегочной обструкции в течение 2 лет наблюдения по сравнению с контролем. Результаты исследования M. Murray и соавторов (1992) подтвердили, что дети, госпитализированные в грудном возрасте с бронхиолитом, в 2,8 раз чаще имели респираторные симптомы, включая БОС, в возрасте 5,5 года.
БОС как инфекционного, так и аллергического воспалительного происхождения всегда протекает тяжелее у лиц с гиперреактивностью бронхов и проявлениями атопии (Сорока Ю.А., 2006). Предшествующее аллергическое воспаление может вести к снижению ИФН-ответа, что способствует более успешной инфекции и, возможно, более выраженным симптомам (Newcomb D.C., Peebles R.S., 2009).
ОРВЗ с бронхообструктивным синдромом
БОС в виде свистящих хрипов на фоне ОРВЗ отмечается у до 50% детей в возрасте до 6 лет (Охотнікова О.М., 2010). В грудном возрасте наиболее распространенными причинами бронхиолита являются РС-вирус, риновирус и смешанная вирусная инфекция. Также причиной могут быть вирусы парагриппа, гриппа, метапневмовирус, энтеровирус, коронавирусы, бокавирус, полиомавирусы (WU, KIP), аденовирус. Клинические проявления инфекции этими вирусами достаточно схожи (Gern J.E., 2009). РС-вирус является причиной приблизительно 70% случаев госпитализаций детей в возрасте до 1 года с бронхиолитом. У детей старшего возраста доминируют пикорнавирусы (65% у детей в возрасте 1–2 года и 82% — у детей ≥3 лет) (Guilbert T.W., Denlinger L.C., 2010). В проведенном D. Jackson и соавторами (2008) исследовании у детей в возрасте до 3 лет с БОС в 90% случаев выявлены вирусы (чаще всего риновирус — 48%, РС-вирусы — 21%, вирусы парагриппа — 12%, метапневмовирус — 7%, коронавирусы — 5%, аденовирусы — 4%, вирусы гриппа — 4% и энтеровирусы — 2%). В другом исследовании (Chung J.Y. et al., 2007) у детей в возрасте 1 года — 5 лет с острым БОС вирусы определены в 61,5% случаев, причем в 16,0% наблюдалась смешанная вирусная инфекция. В 33,3% случаев определен риновирус, в 13,8% — РС-вирус, в 13,85 — бокавирус, в 7,8% — метапневмовирус и в 1,3% — коронавирус NL63. Несколько иные результаты получены московскими исследователями: в этиологии БОС у детей первого года жизни на первый план выступает сочетание РС-вируса и аденовируса (17%), на втором месте — аденовирус (14%) и только на третьем — РС-вирус (6%). У детей в возрасте старше 1 года первое место в этиологии БОС занимает РС-вирус (29%), на втором — аденовирусы (16%), на третьем — сочетание РС-вируса и аденовирусов. Независимо от возраста детей с одинаковой частотой в этиологии БОС отмечается грипп (3%) и парагрипп (3%) (Овсянникова Е.М., 2005).
РС-вирус (род Пневмовирусов семейство Парамиксовирусов) впервые изолирован в 1956 г. По оценкам ВОЗ РС-вирус ответственен за 64 млн заболеваний и 160 тыс. смертей ежегодно. РС-вирус обычно циркулирует в умеренном климате с ноября по апрель, с пиком заболеваемости в зимние месяцы. РС-вирус — один из наиболее контагиозных человеческих патогенов. Он быстро проникает и легко распространяется в больницах, домах престарелых и других закрытых учреждениях. При заболевании распространенным симптомом является кашель, ринорея и незначительное повышение температуры тела. Основной мишенью РС-вируса в нижних дыхательных путях является мерцательный эпителий бронхиол и пневмоциты І типа. Установлено, что РС-вирус нарушает работу ресничек мерцательного эпителия дыхательных путей. Патологические находки включают некроз эпителиальных клеток, изредка — пролиферацию эпителия бронхиол. Повреждение тканей чаще островковое, нежели диффузное. Имеют место признаки обструкции дыхательных путей вследствие слущивания эпителиальных клеток, секреции слизи и накопления иммунных клеток (Carroll K.N., Hartert T.V., 2008; Collins P.L., Graham B.S., 2008). Для таких вирусов, как РС, поражающих относительно небольшое количество клеток дыхательных путей, иммунный ответ может быть преимущественным механизмом возникновения симптомов со стороны дыхательных путей и их дисфункции. Индуцированное вирусом повреждение эпителия может также повысить проницаемость слизистой оболочки дыхательных путей, облегчая взаимодействие аллергена с иммунными клетками и активизируя нейрогенное воспаление (Oh J.W., 2006).
Хотя РС-вирус имеет только один серотип, естественный иммунитет к нему незначительный и реинфекция может произойти в течение жизни неоднократно, ежегодная реинфекция часто встречается в первые годы жизни. По достижению 1 года 50–65% детей, а к 2 годам жизни практически все дети имеют свидетельства перенесенной РС-инфекции, причем более половины перенесли 2 раза. Ежегодно у 5–10% взрослого населения отмечаются заболевания, связанные с РС-вирусом, а во время сезона РС-инфекции у до 25–50% работников сферы здравоохранения наблюдаются случаи реинфекции. Реинфекция обычно ассоциируется с менее тяжелым течением, хотя даже среди в остальном здоровых взрослых 84% РС-инфекций протекают симптомно и в 26% случаев — с вовлечением нижних дыхательных путей (Hall C.B. et al., 2001; Collins P.L., Graham B.S., 2008; Mohapatra S.S., Boyapalle S., 2008; Guilbert T.W., Denlinger L.C., 2010).
В 13-летнем проспективном исследовании, проведенном в США, РС-вирус определен у 43% детей с бронхиолитом, у 25% — с пневмонией, у 11% — с бронхитом и у 10% — с крупом. РС-вирус является причиной бронхиолита у 20–30% детей раннего возраста. Пик госпитализации вследствие бронхиолита РС-вирусной этиологии приходится на 2-й месяц жизни (Singh A.M. et al., 2007; Carroll K.N., Hartert T.V., 2008; Collins P.L., Graham B.S., 2008).
К группе повышенного риска тяжелого течения или смерти, связанной с РС-инфекцией, относятся пациенты пожилого возраста, а также пациенты любого возраста с компрометированной сердечно-сосудистой или дыхательной системой, с иммунодефицитом или иммуносупрессией. Фактором риска тяжелой РС-инфекции также является возраст младше 6 мес. На роль генетической предрасположенности к тяжелому течению РС-инфекции указывает ассоциация восприимчивости к вирусу и семейного анамнеза бронхиальной астмы (БА) или тяжелых заболеваний нижних дыхательных путей в грудном возрасте, а также различия в восприимчивости между расовыми, этническими и гендерными группами (Hall C.B. et al., 2001; Singh A.M. et al., 2007; Carroll K.N., Hartert T.V., 2008; Collins P.L., Graham B.S., 2008; Mohapatra S.S., Boyapalle S., 2008; Guilbert T.W., Denlinger L.C., 2010). Генетический полиморфизм, выраженный повышенной экспрессией ИЛ-4, ИЛ-8 и, предположительно, CCR5 (chemokine receptor type 5), ассоциирован с повышенной частотой тяжелых форм РС- инфекции в детском возрасте, означая, что эти факторы могут участвовать в патогенезе заболевания. При РС- инфекции у детей грудного возраста также описан повышенный апоптоз CD4+ и CD8+ лимфоцитов, ведущий к лимфопении, причем бόльший эффект отмечается у детей более раннего возраста и с более тяжелым заболеванием. В большом количестве клинических исследований зафиксирована ассоциация тяжести РС-инфекции у детей с увеличением соотношения Th1/Th2 цитокинов (или их информационной рибонуклеиновой кислоты (иРНК)) в назальных смывах. В некоторых исследованиях установлен стабильно повышенный уровень свободных РС- специфических иммуноглобулина Е и гистамина в секрете дыхательных путей у детей грудного возраста с РС- инфекцией и БОС (Collins P.L., Graham B.S., 2008).
В последние годы развитие новых молекулярных методов диагностики усилило выявление вирусов при острых респираторных заболеваниях и способствовало определению риновирусной инфекции как важной детерминанты острой обструкции дыхательных путей в раннем детстве (Martinez F.D., 2009). Большинство детей имеют признаки перенесенной риновирусной инфекции к концу 2-го года жизни. Отличительной чертой риновируса (семейство Пикорнавирусов) является большое количество серотипов и штаммов — значительно больше 100. Риновирус циркулирует круглый год с пиками заболеваемости осенью и весной и является лидирующей причиной инфекций верхних дыхательных путей. Репликация риновируса происходит при температуре 33–35 °С, поэтому ранее считалось, что риновирус поражает только верхние дыхательные пути. Однако при комнатной температуре и спокойном дыхании в респираторном тракте, включая бронхи 4-го порядка, имеются благоприятные условия для репликации риновируса. В многочисленных исследованиях установлено наличие риновируса у детей и взрослых с симптомами заболеваний нижних дыхательных путей (до 30% случаев), включая детей, госпитализированных по поводу пневмонии. Наличие риновируса подтверждено в бронхоальвеолярной жидкости и клетках бронхиального эпителия при экспериментальной инфекции верхних дыхательных путей. У детей грудного возраста с рецидивирующими респираторными симптомами риновирус определяется в нижних дыхательных путях в 45% случаев и у большинства этих детей также имеется повышенное сопротивление дыхательных путей. Подобно РС-инфекции, риновирус ассоциирован с БОС, однако отмечается гораздо меньшая заболеваемость среди детей в возрасте младше 6 мес (Carroll K.N., Hartert T.V., 2008; Collins P.L., Graham B.S., 2008; Gern J.E., 2009; Newcomb D.C., Peebles R.S., 2009; Guilbert T.W., Denlinger L.C., 2010). В исследовании М. Korppi и соавторов (2004) установлено, что госпитализированные с БОС риновирусной этиологии дети были старше и чаще имели атопический дерматит и эозинофилию. Исследования с применением полимеразной цепной реакции показали, что РС- вирус наиболее широко ассоциирован с БОС в грудном возрасте, тогда как риновирус играет главную роль после 2–3 лет жизни (Carroll K.N., Hartert T.V., 2008). В поперечном исследовании у детей с БОС в возрасте младше 2 лет в 82% случаев выделены респираторные вирусы, при этом в 68% случаев определялся РС-вирус. У детей с БОС в возрасте старше 2 лет респираторные вирусы выделены с такой же (83%) частотой, однако в большинстве случаев выявлен риновирус (71% в сравнении с 35% у детей группы контроля) (Rakes G.P et al., 1999).
При риновирусной инфекции отмечается усиленная продукция большого количества цитокинов, хемокинов и медиаторов, включая ИЛ-6, ИЛ-8, ИЛ-16, гранулоцит-колониестимулирующий фактор (granulocyte colony-stimulating factor — G-CSF) и RANTES. Эти цитокины также могут усиливать синтез лейкоцитов, их миграцию в дыхательные пути и, возможно, отвечать за активацию нейтрофильных гранулоцитов, способствуя дальнейшему воспалению. Вероятно, что генерация этих медиаторов в большей степени, чем прямое повреждение дыхательных путей риновирусом, является причиной воспаления дыхательных путей (Singh A.M. et al., 2007). Интересно также, что более высокое соотношение ИФН-γ/ИЛ-5 иРНК в клетках мокроты при риновирусной инфекции ассоциировано с меньшими симптомами и более быстрым очищением организма от вируса (Proud D., Chow C.W., 2006). Кроме того, установлено, что слабый ИФН-γ ответ на риновирусную инфекцию ассоциирован с повышенным распространением вируса, а сниженный пролиферативный ответ мононуклеаров периферической крови на риновирус ассоциирован с увеличением тяжести симптомов (Singh A.M. et al., 2007). Риновирусная инфекция может также опосредованно активировать дегрануляцию эозинофилов. Этот эффект может способствовать усилению риска вирус-индуцированного БОС у детей с аллергической сенсибилизацией (Gern J.E., 2009).
Ранее, несмотря на всесторонние исследования, в приблизительно 30% всех случаев респираторных заболеваний определить возбудитель не удавалось, что означало вероятность существования других патогенов. И действительно, в последнее десятилетие в образцах, взятых из респираторного тракта человека, установлены новые инфекционные агенты — метапневмовирус человека, SARS- коронавирус, коронавирус NL63, коронавирус HKU1, бокавирус человека и недавно описанный вирус KI (Gaynor A.M. et al., 2007).
Так, в 2001 г. исследователями из Нидерландов у детей и взрослых с острой респираторной инфекцией выделен новый РНК-содержащий вирус — метапневмовирус человека (human metapneumovirus — hMPV), наряду с РС-вирусом и вирусом парагриппа принадлежащий семейству Парамиксовирусов. Пик его активности часто совпадает или следует за пиком активности РС-вируса (более ¾ случаев отмечаются с декабря по апрель). hMPV выявлен повсеместно и является важным патогеном у людей всех возрастных групп, отвечая за приблизительно 2–12% заболеваний нижних дыхательных путей у детей и меньшее количество — у взрослых. У большинства ранее здоровых взрослых hMPV вызывает преимущественно заболевание средней тяжести, характеризующееся кашлем, охриплостью голоса, затруднением носового дыхания и ринореей. У более половины пациентов отмечается боль в горле, продукция мокроты и системные симптомы. Лихорадка не является обязательным симптомом. Тяжелое течение заболевания отмечается у очень молодых, или у пациентов с хроническими заболеваниями или иммунокомпрометированных. У детей инфекция hMPV вызывает (в нисходящем порядке по частоте возникновения) бронхиолит, круп, пневмонию, бронхит или обострение БА. hMPV-инфекция у детей в возрасте младше 5 лет ассоциирована с БОС и повышением индекса аллергизации у детей грудного возраста (Alto W.A., 2004; Williams J.V. et al. 2004; Fouchier R.A. et al., 2005; Евсеева Е.Л., 2009).
Бокавирус человека (Human bocavirus — HBoV), ДНК-содержащий вирус, впервые описан в сентябре 2005 г. сотрудниками клиники Каролинского университета (Karolinska University Hospital), Стокгольм, Швеция. HBoV — член семейства Парвовирусов. Название рода Bocavirus является результатом комбинации первых букв названий описанных ранее вирусов, принадлежащих к этому роду: бычьего парвовируса (bovine parvovirus) и минутного вируса собак (canine minute virus). HBoV распространен повсеместно. Описана сезонность с пиком заболеваемости зимой и ранней весной в умеренном климате. Трансмиссия HBoV, как полагают, осуществляется преимущественно воздушнокапельным путем, но не исключается и алиментарный путь распространения вируса. HBoV определяется у пациентов с инфекцией верхних дыхательных путей, бронхитом, бронхиолитом, пневмонией и обострениями БА (Schildgen O. et al., 2008; Козулина И.С. и соавт., 2009; Allander T. et al., 2007b).
Бокавирус ассоциирован примерно с 19% эпизодов острого БОС у детей. Наиболее восприимчивы к HBoV дети в возрасте 1–3 лет, у которых отмечается более тяжелое течение этой инфекции. Причем мальчики болеют чаще. Клинически HBoV-инфекция во многом сходна с типичными ОРВЗ (лихорадка, ринорея, кашель, осиплость голоса), нередко характеризуется явлениями диспепсии (гастроинтестинальные симптомы наблюдаются у 25% пациентов). В большинстве случаев развивается БОС. HBoV часто формирует ассоциации с другими респираторными вирусами, при этом чем младше ребенок, тем выше вероятность сочетанной инфекции. У детей с инфекцией нижних дыхательных путей, позитивных по HBoV, определены и другие вирусы в 37–90% случаев (Allander T. et al., 2007b; Longtin J. et al., 2008; Schildgen O. et al., 2008; Козулина И.С. и соавт., 2009; Hustedt J.W., Vazquez M., 2010).
Коронавирусы — семейство РНК- содержащих вирусов. Вирусная частичка имеет шипообразные протеины на мембранной поверхности, образующие форму короны. Коронавирусы человека (Human coronavirus — HCoV) известны с конца 1960-х, однако только недавно открыто 2 новых вируса: в 2004 г. в Нидерландах идентифицирован вирус HCoV-NL63 и в 2005 г. в Гонконге — вирус HCoVHKU1. У большинства пациентов, инфицированных HCoV-229E, HCoVOC43 и HCoV-NL63 и HCoVHKU1, отмечаются симптомы «простуды», более тяжелые клинические симптомы характерны для новорожденных, недоношенных или рожденных с недостаточной массой тела, с сопутствующими заболеваниями, у пациентов пожилого возраста или иммунокомпрометированных лиц. HCoV-NL63 и HCoVHKU1 определяются у 1–10% пациентов с острой респираторной инфекцией, однако в большинстве случаев сочетанно с другими респираторными вирусами, в основном РС- вирусом и вирусом гриппа. С высокой частотой HCoV-229E, HCoVOC43 и HCoV-NL63 определяются у детей грудного возраста и старше с бронхиолитом, бронхитом и пневмонией (Pyrc К. et al., 2007; Principi N. et al., 2010).
Полиомавирусы — ДНК-вирусы малого размера, способные к персистенции и имеющие онкогенный потенциал. Распространены у птиц и млекопитающих. KI-и WU-вирусы, принадлежащие к новому роду семейства Полиомавирусов, одинаково отмечаются на 4 континентах, выявляются в носоглоточных смывах детей и иммунокомпрометированных взрослых с инфекцией респираторного тракта. В некоторых случаях они также определяются сочетанно с другими вирусами у пациентов с желудочно-кишечными заболеваниями. WU-вирус выделен у 3% пациентов в Австралии и 0,7% — в Северной Америке, однако более чем в ⅔ случаев сочетании с другим инфекционным агентом. Большинство (86%) пациентов составили дети в возрасте ≤3 лет, взрослые имели нарушение иммунитета или наличие тяжелых сопутствующих заболеваний. У пациентов с WU- инфекцией отмечались бронхиолит, круп и пневмония. Распространенность KI- вируса в носоглоточных смывах исследуемой популяции составила 1%, причем почти 90% образцов, позитивных на KI- вирус, были ко-инфицированы другими респираторными вирусами. По мнению некоторых исследователей, доказательств патогенности указанных вирусов на данный момент недостаточно (Allander T. et al., 2007a; Gaynor A.M. et al., 2007).
ОРВЗ и риск развития БА
Десятилетний период наблюдений позволил норвежским ученым прийти к заключению, что у лиц, перенесших в раннем возрасте ОРВЗ, повышен риск возникновения БА к 10-летнему возрасту (Nafstad P. et al., 2005). Это совместимо с результатами когортного исследования U.K. IoW (Isle of Wight): скорригированный риск развития БА в возрасте 10 лет был в 4 раза выше у детей, перенесших в первые 2 года жизни повторные инфекции нижних дыхательных путей (Holgate S.T. et al., 2010). Проведенное в США популяционное исследование с участием более 90 тыс. детей установило корреляцию степени тяжести бронхиолита, перенесенного в грудном возрасте, с риском развития БА в дошкольном возрасте (Carroll K.N. et al., 2009). Известно также, что БА развивается у 30–50% детей, имевших в грудном возрасте рецидивирующий БОС вирусного происхождения (Oh J.W., 2006).
Острая риновирусная и другие инфекции могут индуцировать синтез различных факторов, регулирующих ремоделирование дыхательных путей и развитие альвеол, включая фактор роста эндотелия сосудов (vascular endothelial growth factor — VEGF), NO, трансформирующий фактор роста-β (transforming growth factor β — TGF-β), амфирегулин, активин A и фактор роста фибробластов (fibroblast growth factor — FGF). Более того, вирусная инфекция может повышать регуляцию нейротрофинов, потенциально способствующих ремоделированию нервной структуры дыхательных путей и, возможно, неспецифической реактивности дыхательных путей (Gern J.E., 2009). Однако влияние РС- вируса или риновируса на развитие БА после перенесенного бронхиолита может быть несомненным только на специфическом генетическом фоне и/или в комбинации с другими факторами окружающей среды (Singh A.M. et al., 2007). Наблюдение участников исследования COAST (Childhood Origins of ASThma) — детей группы высокого генетического риска развития БА (наличие как минимум у 1 родителя респираторной аллергии и/или БА) показало, что перенесенный в первые 3 года жизни БОС РС-вирусной этиологии повышает риск развития БА к 6 годам в 2,6 раза, а БОС риновирусной этиологии — почти в 10 раз (Jackson D. et al., 2008).
Вирусная инфекция действует синергически с аллергической сенсибилизацией и снижением функции легких в грудном возрасте, ведя к развитию БА в дальнейшем (Guilbert T.W., Denlinger L.C., 2010). Атопия является фактором риска развития БА после вирус-индуцированного БОС. Дети, перенесшие БОС в ранние годы жизни и имеющие такие признаки атопии, как аллергическая сенсибилизация, атопический дерматит, эозинофилию или аллергенспецифический иммуноглобулин Е, имеют наибольший риск развития БА (Guilbert T.W., Denlinger L.C., 2010).
Нарушенный ИФН-ответ может увеличить риск более тяжелого течения вирусной инфекции в грудном возрасте и, вероятно, способствовать длительному повреждению структур дыхательных путей. В исследовании, проведенном D.A. Stern и соавторами (2007), продемонстрирован сниженный ИФН-γ-ответ мононуклеаров периферической крови в течение первых лет жизни у детей, у которых в последующем развился персистирующий БОС. Отметим, что сниженный ИФН-γ-ответ в грудном возрасте также отмечается у детей с признаками атопии, что может помочь в объяснении, почему атопия является фактором риска вирус-индуцированного БОС (Gern J.E., 2009).
Бронхолитин ®
Уже более 30 лет отечественным специалистам известен Бронхолитин ® — комбинированный препарат с противокашлевым, бронходилатирующим и бронхоантисептическим действием. Препарат применяется в комплексной терапии заболеваний дыхательной системы, сопровождающихся сухим непродуктивным кашлем (острый и хронический бронхит, трахеобронхит, БА, пневмония, бронхоэктазы), у взрослых и детей в возрасте старше 3 лет. Комплексное действие препарата обусловлено свойствами его основных компонентов: глауцина гидробромида и эфедрина гидрохлорида (Компендиум 2010 — лекарственные препараты, 2010).
Эфедрин является алкалоидом, содержащимся в различных видах растения эфедра, в том числе в эфедре хвощевой (Ephedra equisetina). Эфедрин относится к группе симпатомиметиков смешанного действия, возбуждающих α- и β- адренергические рецепторы и вызывающих высвобождение норадреналина из депо. Эфедрин умеренно ингибирует активность моноаминоксидазы. Уменьшает отек слизистой оболочки бронхов, вызывает сужение артериол и повышает артериальное давление; улучшает предсердно-желудочковую проводимость; усиливает сердечную деятельность. Активирует процессы возбуждения в центральной нервной системе и стимулирует дыхательный центр. Эфедрин надежно устраняет бронхоспазм различного генеза. Бронходилатирующий эффект эфедрина, вызванный активацией β2— адренергических рецепторов гладкомышечных клеток бронхов, обусловливает облегчение отделения мокроты и снижение обструкции бронхов. При приеме внутрь бронходилатирующий эффект эфедрина реализуется через 30–40 мин, длительность его действия — 4–6 ч. Коронарные сосуды в ответ на действие эфедрина кратковременно суживаются за счет стимуляции α1— адренергических рецепторов, а затем имеют длительную фазу расширения за счет стимуляции β2— адренергических структур. Благоприятное влияние на кровоток, улучшение проведения электрических импульсов по проводящей системе сердца при блокадах, умеренное повышение частоты сердечных сокращений ведет к улучшению циркуляции в малом круге кровообращения, увеличению оксигенации крови, снижению гиперкапнии. Повышение возбудимости дыхательного центра наряду с бронхолитическим и противокашлевым эффектом приводит к увеличению глубины и снижению частоты дыхания, выравниванию его ритма. Увеличение времени дыхательной паузы ведет к более полному восстановлению энергетических резервов межреберных и других дыхательных мышц (Бабушкина А.В., 2010; Компендиум 2010 — лекарственные препараты, 2010).
Масло базилика, входящее в состав Бронхолитина в качестве вспомогательного компонента, придает препарату специфический приятный вкус. Его действие сходно с таковым глауцина и заключается в угнетении кашлевого рефлекса, умеренном бронхолитическом и седативном эффектах. Также масло базилика обладает противовоспалительным, антисептическим и секретолитическим действием (Бабушкина А.В., 2010; Компендиум 2010 — лекарственные препараты, 2010).
Терапевтическая эффективность и безопасность препарата Бронхолитин ® доказана в ходе клинических испытаний, проводившихся с участием взрослых пациентов и детей. У больных с доказанной обструкцией бронхов в результате лечения Бронхолитином отмечено существенное уменьшение выраженности одышки, бронхиальной обструкции, кашля, уменьшение количества и изменение характеристики мокроты. У пациентов наблюдалась положительная динамика показателей вентиляционной функции легких. Результаты проведенных клинических исследований показали хорошую переносимость препарата в терапевтических дозах у взрослых пациентов и детей (Бабушкина А.В., 2010).
Несмотря на многолетнее применение, Бронхолитин ® остается по-прежнему актуальным и эффективным лекарственным средством. Назначение Бронхолитина особенно показано при патологических процессах, протекающих с воспалением, повышенной бронхиальной реактивностью и/или бронхоспазмом. При применении 3 раза в сутки Бронхолитин ® надежно подавляет кашель, возникающий в различных рецепторных зонах бронхолегочной системы (Бабушкина А.В., 2010).
Выводы
Острые респираторные заболевания вирусной этиологии отвечают за существенный уровень заболеваемости и смертности во всем мире. Нередко данные заболевания протекают с бронхообструктивным синдромом — патологическим состоянием, связанным с нарушением бронхиальной проходимости и последующим повышением сопротивления потока воздуха при вентиляции. Синдром бронхиальной обструкции на фоне острого респираторного вирусного заболевания достаточно распространен у детей (отмечается у до 50% в возрасте до 6 лет). Этиологическими факторами данного состояния являются такие вирусы, как РС-вирус и риновирус, метапневмовирус, бокавирус, вирусы гриппа, парагриппа, аденовирус, энтеровирусы, коронавирусы, полиомавирусы.