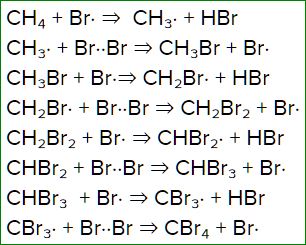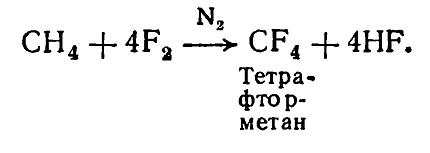Что такое бромирование в химии
БРОМИРОВАНИЕ
Смотреть что такое «БРОМИРОВАНИЕ» в других словарях:
БРОМИРОВАНИЕ — БРОМИРОВАНИЕ, введение атома брома в химическое соединение либо путем реакции с ненасыщенной молекулой, либо замещением водорода, как при получении бромбензола из бензола. Органические бромиды широко применяются при синтезе красителей и… … Научно-технический энциклопедический словарь
бромирование — brominimas statusas T sritis chemija apibrėžtis Bromo įjungimas į molekulę, veikimas bromu. atitikmenys: angl. bromination rus. бромирование … Chemijos terminų aiškinamasis žodynas
N-Бромсукцинимид — Статья содержит ошибки и/или опечатки. Необходимо проверить содержание статьи на соответствие грамматическим нормам русского языка … Википедия
ВОЛЯ-ЦИГЛЕРА РЕАКЦИЯ — замещение атома Н в положении к связи СЧС на атом Вг (аллильное бромирование) с помощью N бромамидов или N бромимидов (обычно N бромсукцинимида), напр.: Р цию проводят в кипящем СС14 в присут. бензоилпероксида или 2,2 азо бис изобутиронитрила. В … Химическая энциклопедия
НАФТИРИДИНЫ — (пиридопиридины), мол. м. 130,15. Известно шесть возможных изомеров: 1,5 Н. (ф ла I), т. пл. 75°С; 1,6 Н. (II), т. пл. 35 36°С; 1,7 Н. (III), т. пл. 64°С; 1,8 Н. (IV), т. пл. 98 99°С; 2,6 Н. (V), т. пл. 118 119°С, 2,7 Н. (VI) … Химическая энциклопедия
Адамантан — Адамантан … Википедия
Кубан — Кубан … Википедия
Бромид фосфора(V) — Общие … Википедия
бромирование
Смотреть что такое «бромирование» в других словарях:
БРОМИРОВАНИЕ — БРОМИРОВАНИЕ, введение атома брома в химическое соединение либо путем реакции с ненасыщенной молекулой, либо замещением водорода, как при получении бромбензола из бензола. Органические бромиды широко применяются при синтезе красителей и… … Научно-технический энциклопедический словарь
бромирование — brominimas statusas T sritis chemija apibrėžtis Bromo įjungimas į molekulę, veikimas bromu. atitikmenys: angl. bromination rus. бромирование … Chemijos terminų aiškinamasis žodynas
БРОМИРОВАНИЕ — см. Галогенирование … Химическая энциклопедия
N-Бромсукцинимид — Статья содержит ошибки и/или опечатки. Необходимо проверить содержание статьи на соответствие грамматическим нормам русского языка … Википедия
ВОЛЯ-ЦИГЛЕРА РЕАКЦИЯ — замещение атома Н в положении к связи СЧС на атом Вг (аллильное бромирование) с помощью N бромамидов или N бромимидов (обычно N бромсукцинимида), напр.: Р цию проводят в кипящем СС14 в присут. бензоилпероксида или 2,2 азо бис изобутиронитрила. В … Химическая энциклопедия
НАФТИРИДИНЫ — (пиридопиридины), мол. м. 130,15. Известно шесть возможных изомеров: 1,5 Н. (ф ла I), т. пл. 75°С; 1,6 Н. (II), т. пл. 35 36°С; 1,7 Н. (III), т. пл. 64°С; 1,8 Н. (IV), т. пл. 98 99°С; 2,6 Н. (V), т. пл. 118 119°С, 2,7 Н. (VI) … Химическая энциклопедия
Адамантан — Адамантан … Википедия
Кубан — Кубан … Википедия
Бромид фосфора(V) — Общие … Википедия
Бромирование, йодирование и фторирование метана
Что такое бромирование, йодирование и фторирование метана
Процессы бромирования, фторирования и йодирования метана относятся к химическим реакциям замещения или галогенирования с радикальным механизмом замещения. Процесс реакции протекает или на свету, или при облучении УФ-светом, или при нагревании. Реакция идет поэтапно. На одном этапе замещается один атом углерода в молекуле.
Основными стадиями реакции галогенирования метана являются следующие:
Правило Марковникова гласит, что при присоединении галогеноводородов или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному углеродному атому, т. е. к атому углерода, связанному с большим числом атомов водорода. При этом атом галогена или группа —ОН присоединяется к наименее гидрогенизированному.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Название правилу было дано в честь русского химика В.В. Марковникова, сформулировавшего его в 1869 году.
Бромирование метана, как протекает на свету
Продуктами бромирования метана являются бромметан, бромоводород, четырехбромистый углерод.
По сравнению с хлорированием, процесс протекает не так активно, но остановить начавшуюся реакцию уже нельзя. При бромировании получается смесь из всех возможных продуктов реакции, состав получившейся смеси будет зависеть от изначальных пропорций метана и брома.
Полная схема реакции бромирования метана:
\(CBr_<4>\) здесь — четырехбромистый углерод.
Фторирование метана с помощью \(CoF_<3>\)
Формула реакции выглядит так:
Путем этой реакции получают перфторалканы, использующиеся для разделения изотопов урана-235 и урана-238 в виде летучих гексафторидов 235UF6 и 238UF6, и фторид кобальта (II). Также продуктами реакции фтора и метана являются фреоны, используемые для охлаждения техники.
Йодирование метана
Но если добавить к смеси окислитель для связывания HI, то реакция возможна:
[O] здесь — окислитель.
\(3CH_<3>OH + PI_ <3>\rightarrow 3CH_<3>I + H_<3>PO_<3>.\)
Реакции электрофильного присоединения к алкенам
Электрофильные реагенты являются наиболее характерными атакующими частицами в реакциях алкенов, идущих по С-Сπ связи.
Многочисленные экспериментальные данные свидетельствуют о том, что в отличие от реакций гидрирования электрофильное присоединение осуществляется по асинхронному типу.
Механизм реакции электрофильного присоединения к алкенам
Рассмотрим типичную реакцию электрофильного присоединения к алкенам — реакцию бромирования этилена:
Механизм реакции электрофильного присоединения к алкенам, в частности бромирования, в настоящее время представляется следующим
Доказательства механизма электрофильного присоединения к алкенам основаны на следующих фактах.
Циклический «неклассический» карбокатион, например норборнильный, образуется в некоторых реакциях мостиковых бициклических углеводородов и их производных. В таких «неклассических» карбокатионах атом углерода становится пентакоординированным. По В. А. Бархату [104, с. 227-411], «неклассический ион есть положительно заряженная частица, обладающая минимумом свободной энергии при данных межъядерных расстояниях, в которой делокализация положительного заряда осуществляется с помощью многоцентровой молекулярной орбитали, образованной, по меньшей мере частично, σ-перекрыванием атомных орбиталей атомов, по крайней мере часть из которых не связана между собой σ-остовом». Примерами таких ионов являются:
Направление электрофильного присоединения к алкенам. Правило Марковникова
Присоединение реагентов типа НХ к несимметричным алкенам идет по аналогичному бромированию механизму, но в данном случае возникает проблема направления присоединения.
В. В. Марковников в 1870 г. сформулировал правило, согласно которому кислоты присоединяются к несимметричным алкенам таким образом, что водород кислоты присоединяется к атому углерода, несущему наибольшее число атомов водороду. Это правило легко понять, если принять во внимание механизм реакции электрофильного присоединения, например:
Положительный конец диполя НВr ориентируется к атому углерода с наибольшей электронной плотностью, то есть к концевому. Из двух возможных карбокатионов А и Б первый, несомненно, более устойчив (стабилизация за счет положительных индуктивных эффектов трех метильных групп) и образуется быстрее. В результате при электрофильном присоединении в основном образуется mpem-бутилбромид. Следовательно, в современной трактовке правило Марковникова можно сформулировать следующим образом: присоединение НХ к алкену идет с образованием наиболее стабильного карбокатиона. Правило Марковникова в такой формулировке объясняет редкие случаи электрофильного присоединения к алкенам против классически сформулированного правила Марковникова. Например, в реакции присоединения НСl к алкену с сильной электроноакцепторной группой образуется более стабильный карбокатион А, а протон присоединяется к менее гидрогенизированному атому углерода:
Примеры реакций электрофильного присоединения
Естественное предположение о возможности присоединения к алкенам самых разнообразных электрофильных реагентов находит экспериментальное подтверждение. Необходимо, однако, помнить, что поляризация С-Сπ связи происходит в момент химической реакции, то есть реагент должен быть достаточно сильным электрофилом. Слабые электрофилы или, тем более, нуклеофилы должны быть «электрофилизированы» добавлением сильного электрофила (кислоты).
Среди типичных реагентов отметим:
Галогенирование.
Расчеты тепловых эффектов реакций галогенирования алкенов дают следующие результаты:
Все реакции галогенирования принципиально возможны и практически осуществимы, за исключением фторирования. Эта реакция вследствие очень высокой экзотермичности не поддается контролю. Легкость осуществления реакций галогенирования, например бромирования, в обычных органических растворителях, таких, как хлороформ, четыреххлористый углерод, широко используют в аналитических целях для качественного определения наличия двойной связи в органических соединениях.
Присоединение кислот к алкенам.
Механизм и особенности присоединения к алкенам рассмотрены выше. Отметим среди реакций этого типа взаимодействие с серной кислотой, которое лежит в основе важных технических процессов:
Гипогалогенирование.
Реакция гипохлорирования лежит в основе промышленного синтеза глицерина. Пропилен после пр вращения в хлористый аллил или аллиловый спирт подвергают действию хлорноватистой кислоты, которая взаимодействует по механизму электрофильного присоединения к алкенам.
Акцепторное влияние двух атомов хлора приводит к образованию обоих карбокатионов А и Б и, соответственно, смеси дихлорпропанолов. Собственно глицерин получают щелочным омылением дихлорпропанолов:
Гидратация алкенов (присоединение воды).
Вода является слабым электрофилом, и по этой причине ее прямое присоединение к алкенам осуществить не удается. Однако в присутствии сильных минеральных кислот в результате гидратации образуются спирты. Так получают синтетический этиловый спирт, техническую потребность в котором промышленность удовлетворяет гидратацией этилена, выделяемого из газов крекинга или продуктов пиролиза легких алканов (этана, пропана, бутана).
При сернокислотном методе пропусканием этилена через концентрированную серную кислоту получают этил сульфат (этил серную кислоту), который реагирует с водой, давая в итоге спирт и кислоту:
С фосфорной кислотой гидратация осуществляется под давлением. Спирт в данном случае образуется сразу при взаимодействии карбокатиона с водой.
Реакцию гидратации можно осуществить и в газовой фазе — при высоких температуре и давлении. В качестве катализаторов обычно применяют оксид алюминия ( Аl2O3 ), хлористый цинк ( ZnCl2 ) и др. Гомологи этилена образуют вторичные и третичные спирты.
Образование простых эфиров.
Присоединение спиртов к алкенам в присутствии сильных кислот приводит к образованию простых эфиров:
Образование сложных эфиров.
Карбоновые кислоты образуют с алкенами сложные эфиры. Реакция ускоряется сильными минеральными кислотами:
Алкены с галогенангидридами и ангидридами карбоновых кислот в присутствии кислот Льюиса дают продукт присоединения, который в зависимости от условий реакции далее превращается в непредельный кетон, насыщенный кетон и др.:
Непредельный кетон может образоваться и в результате отщепления протона от карбокатиона [46, т. 3].
Комплексы с переходными металлами.
В промышленности алкены из крекинг-газов выделяют с помощью раствора CuCl в аммиаке, а лучше — этаноламине.
Сорбция осуществляется при повышенном давлении, десорбция — при пониженном.
Алкилирование.
Одной из важнейших в практическом плане реакций алкенов является алкилирование — введение алкильной группы, которое приводит к алканам и может быть осуществлено различными методами.
Синтез изоалканов — высокооктанового бензина — реализован в промышленности в нескольких модификациях.
Сернокислотное алкилирование осуществляют действием 60%-ной серной кислоты на низшие алкены, выделяемые из газов крекинга или пиролиза пропан-бутановой фракции.
Трет-Бутилкатион реагирует с алкеном смеси (на схеме представлен один из вариантов). Стабилизация карбокатиона А отщеплением протона (вода прерывает процесс полимеризации) приводит к смеси алкенов, гидрирование которой дает изооктан.
Процесс, разработанный В. Н. Ипатьевым, в котором взаимодействие изобутилен-изобутановой смеси осуществляется в присутствии «твердой фосфорной кислоты» (фосфорная кислота на оксиде алюминия) или фторида бора, является примером катионоцепной реакции (см. раздел 9.5.5). Крупнотоннажное производство по этой схеме успешно реализовано самим Ипатьевым в США в 30-е годы. Взаимодействие алкенов с аренами (ароматическими углеводородами) рассмотрено в главе XV.
Аллильное бромирование алкенов N-бромсукцинимидом по К. Циглеру
Вы будете перенаправлены на Автор24
Селективность реакции
Как правило, реакция специфична относительно аллильного положения и продукт получается с высоким выходом. Однако, если промежуточно образующийся аллильный радикал несимметричен, может наблюдаться аллильный сдвиг и в результате образуется смесь двух возможных продуктов, например.
Готовые работы на аналогичную тему
Механизм аллильного бромирования
Прямое газообразное хлорирование
Реакцией, родственной аллильному галогенированию по Циглеру считается прямое газообразное хлорирование пропилена при 400 – 500 ºС:
В настоящее время эта реакция лежит в основе промышленного способа получения хлористого аллила в больших количествах. В таких условиях присоединение хлора к двойной связи становится обратимой реакцией, где равновесие сильно смещено в сторону исходных реагентов. С этой реакцией успешно конкурирует прямое радикальное замещение водорода в аллильном положении:
Аллилхлорид используется для получения эпихлоргидрина
и других соединений с аллильной группой.
Таким образом, реакции радикального замещения водорода в аллильном положении, как и реакции радикального присоединения по двойной связи, столь же типичны для алкенов, как и процессы электрофильного присоединения по кратной связи.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 03 06 2021