Что такое бром в химии
Что такое бром? Химический элемент бром: формула, свойства
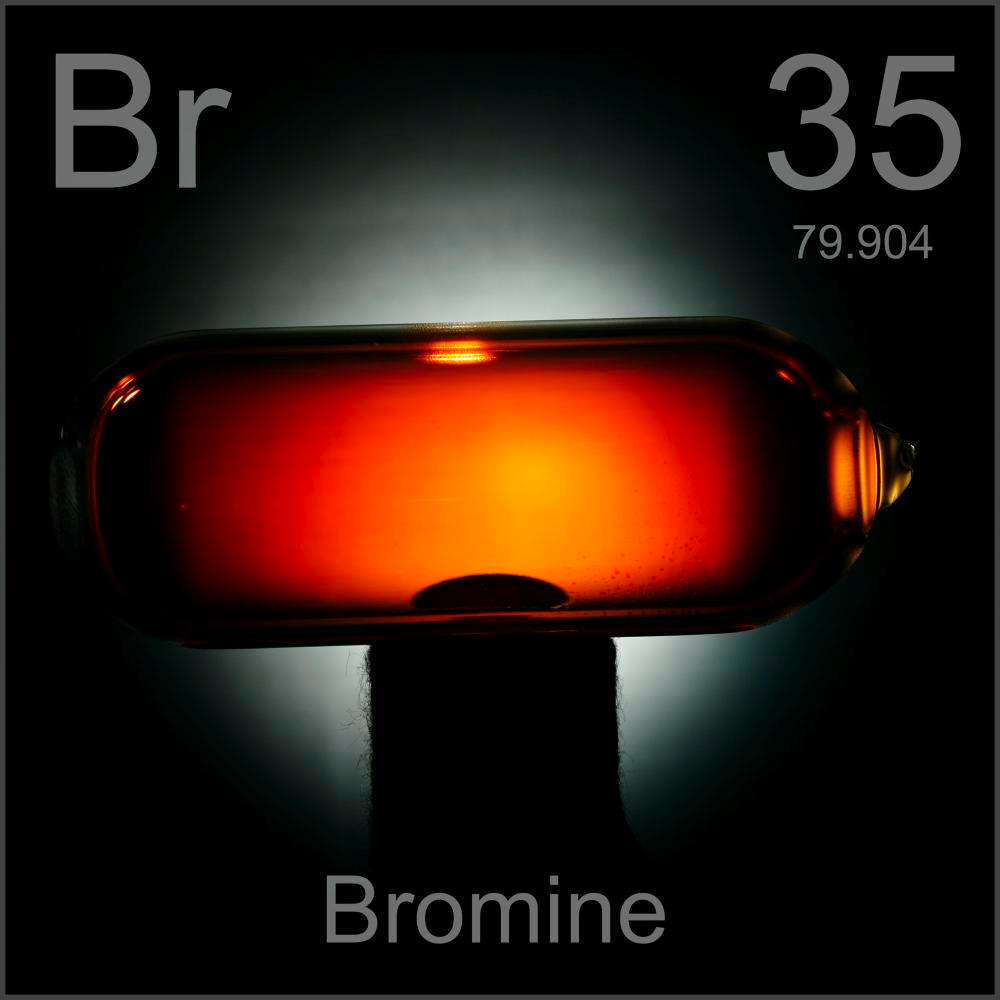
Жидкость красно-бурого цвета, с резким специфическим запахом, плохо растворимая в воде, но растворяющаяся в бензоле, хлороформе, сероуглероде и других органических растворителях. Такой ответ можно дать на вопрос: «Что такое бром?» Соединение относится к группе наиболее активных неметаллов, реагируя со многими простыми веществами. Оно является сильно токсичным: вдыхание его паров раздражает дыхательные пути, а попадание на кожу вызывает тяжелые, длительно не заживающие ожоги. В нашей статье мы изучим его физические свойства, а также рассмотрим химические реакции, характерные для брома.
Что такое бром?
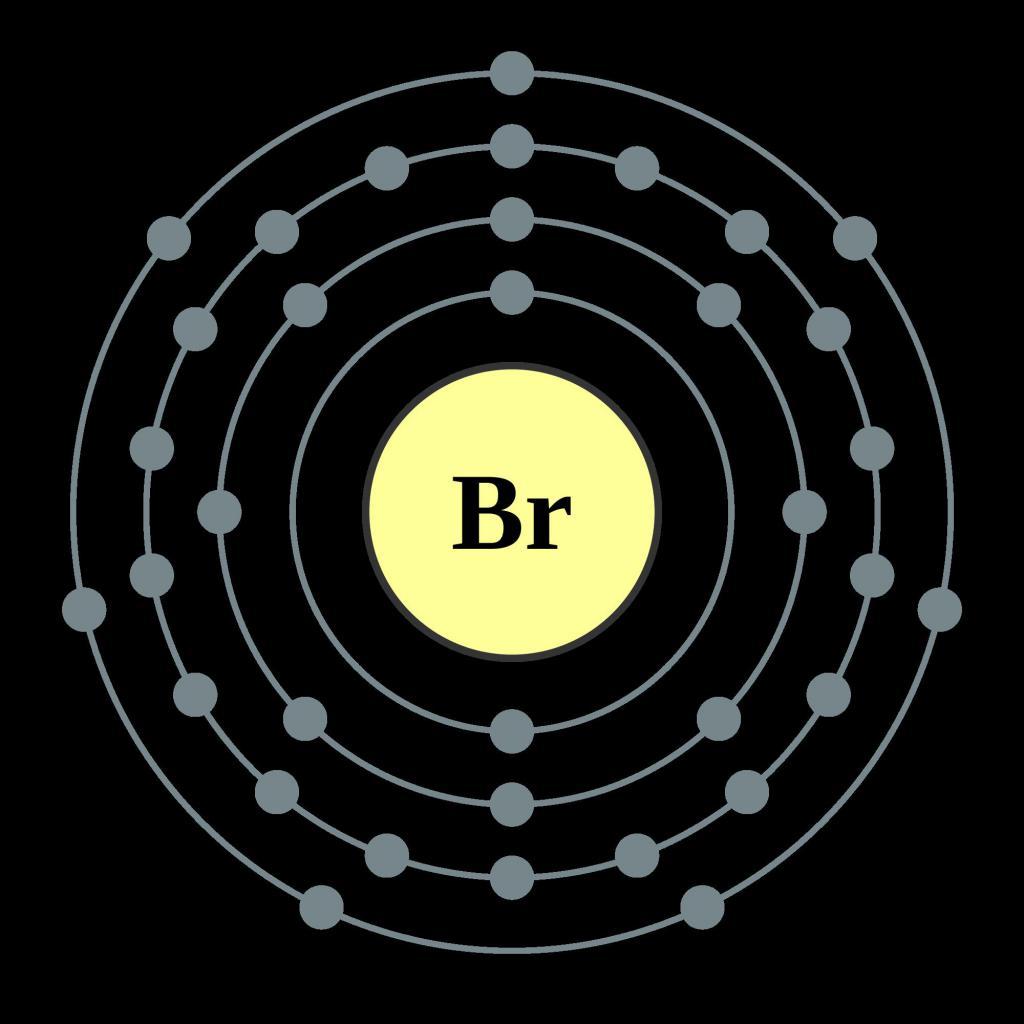
Главная подгруппа седьмой группы – место положения элемента в периодической системе химических элементов. На последнем энергетическом слое атома находится два s-электрона и пять p-электронов. Как и все галогены, бром имеет значительное сродство к электрону. Это значит, что он легко притягивает в свою электронную оболочку отрицательные частицы других химических элементов, становясь анионом. Молекулярная формула брома – Br2. Атомы соединяются между собой с помощью совместной пары электронов, такой тип связи называется ковалентной. Она также является неполярной, располагаясь на одинаковом расстоянии от ядер атомов. Ввиду достаточно большого радиуса атома – 1,14A°, окислительные свойства элемента, его электроотрицательность и неметаллические свойства становятся меньше, чем у фтора и хлора. Температура кипения, наоборот, повышается и составляет 59,2 °C, относительная молекулярная масса брома равна 180. В свободном состоянии из-за высокой активности элемент как простое вещество не встречается. В природе его можно обнаружить в связанном состоянии в виде солей натрия, магния, калия, особенно высоко их содержание в морской воде. Некоторые виды бурых и красных водорослей: саргассум, фукус, батрахоспермум, содержат большое количество брома и йода.
Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли – сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.
Взаимодействие с органическими соединениями
Молекулы Br2 способны к взаимодействию не только с простыми, но и со сложными веществами. Например, реакция замещения проходит между ароматическим углеводородом бензолом и бромом при нагревании, в присутствии катализатора – бромида трехвалентного железа. Она заканчивается образованием бесцветного соединения, не растворимого в воде – бромбензола:
Простое вещество бром, растворенное в воде, используется в качестве индикатора для определения наличия в молекуле органических веществ непредельных связей между атомами углерода. Такой качественной реакцией находят в молекулах алкенов или алкинов пи-связи, от которых зависят основные химические реакции указанных углеводородов. Соединение вступает в реакции замещения с предельными углеводородами, при этом образуя производные метана, этана и других алканов. Известна реакция присоединения частиц брома, формула которых Br2, к непредельным веществам с одной или двумя двойными, или с тройной связью в молекулах, например, к таким, как этен, ацетилен или бутадиен.
С указанными углеводородами может реагировать не только простое вещество, но и его водородное соединение – HBr.
Особенности взаимодействия галогена с фенолом
Органическое вещество, состоящее из бензольного ядра, связанного с гидроксильной группой, – это фенол. В его молекуле прослеживается взаимное влияние групп атомов друг на друга. Поэтому реакции замещения с галогенами у него протекают значительно быстрее, чем у бензола. Причем для процесса не требуется нагревание и присутствие катализатора. Сразу три атома водорода в молекуле фенола замещаются радикалами брома. В результате реакции образуется трибромфенол.
Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение – бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль – бромат калия, а из нее – и соответствующая кислота – HBrO4. Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли – бромиды, и выделяется свободный водород.
Применение соединений брома
В нашей статье мы выяснили, что такое бром, и какие физические и химические свойства для него характерны.
Что такое бром в химии
Бром — элемент главной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
История
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорченный тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда. Фраза-то была, но принадлежала она не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Сорбонне занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит βρῶμος — зловоние.
Получение
Физические свойства
Обычный бром состоит из изотопов 79 Br (50,56 %) и 81 Br (49,44 %). Искусственно получены радиоактивные изотопы.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Вещества на основе брома широко применяются в основном органическом синтезе.
В технике
— Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
— Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
— Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
— 1,2-дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца.
— Растворы бромидов используются в нефтедобыче.
В медицине
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия
Со времен Первой Мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/м³. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух; для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na2SO3
Мифы и легенды
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Бром (Br, Bromum)
История брома
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.
Общая характеристика Брома
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа ( 79 Br и 81 Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
Опасность и вред брома
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья. Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна. Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин. Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях. Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.